青心酮防治动脉粥样硬化与内脂素的关系*
张代娟, 刘同美△, 崔晓栋, 刘江月, 郭军堂, 王建英, 叶笃筠
(1潍坊医学院病理生理教研室,山东 潍坊 261053;2华中科技大学同济医学院病理生理教研室,湖北 武汉 430030)
内脂素是在2005年发现的一种新的脂肪细胞因子(adipocytokines)[1]。目前认为,内脂素是一种重要的前炎症因子,内脂素在血管平滑肌细胞、内皮细胞皆有表达,在巨噬细胞、动脉粥样硬化(atherosclerosis,AS)斑块富含脂质的区域高表达,在AS斑块不稳定性中发挥一定作用[2],因此与AS的发生发展关系密切。我们前期工作观察到活血化瘀中药成分青心酮(3,4-dihydroxyaceto-phenone,DHAP)能通过抑制TLR4表达、TNF-α分泌起到较好的抗炎作用[3]。青心酮能否通过抑制内脂素分泌来影响AS炎症反应的发生发展,目前尚无这方面的报道。本实验拟对比青心酮及辛伐他汀对ApoE(-/-)小鼠内脂素分泌的影响,探讨青心酮对AS的防治机制。
材料和方法
1 仪器
ME1000+YG-2型电镜(USA),Hoefer垂直型电泳槽和湿式电转膜槽(USA),DF-C型电泳仪(东方特力科贸中心),Bio-Rad型转膜仪(USA),KD病理切片机(科迪仪器设备有限公司),RX-2000全自动生化测定仪(Technicon)。
2 药品与试剂
青心酮为北京制药三厂赠送,批号为051202;辛伐他汀粉剂为浙江京新药业公司产品,批号为100601-200702;RT-PCR相关试剂购自Gibco-BRL。免疫印迹法相关试剂购自北京中山生物技术有限公司。免疫组化相关试剂购自晶美公司。
3 动物
C57BL/6小鼠、ApoE(-/-)小鼠,雄性,8周龄,清洁级,体重(18.14±0.70)g,购于协和医大实验动物中心,合格证号为scxk(京)2005-0013。
4 小鼠分组
取8只8周龄C57BL/6小鼠作为正常对照组;取24只8周龄雄性ApoE(-/-)小鼠,随机分成3组:动脉硬化组(n=8),建立小鼠AS模型;青心酮治疗组(n=8)肌注青心酮 10 mg·kg-1·d-1;辛伐他汀治疗组(n=8)肌注辛伐他汀 10 mg·kg-1·d-1。药物剂量根据成人每天用药临床推荐的常用量换算[4]。所有实验小鼠均为清洁级别,同样温度、湿度和光照等环境条件下适应3 d,进食进水正常,体重稳定后开始进入实验程序。所有小鼠自由进食饮水,实验用药溶于生理盐水配成混悬液,根据当天动物体重给药;动脉硬化组肌注生理盐水。所有实验小鼠均饲以含脂肪21%,胆固醇0.15%的“西方类型膳食”饲料至12周。
5 实验取材
小鼠禁食过夜(不禁水),称体重。经小鼠眼眶静脉丛采血,离心分离血清,测定血清内脂素、血脂。剪取主动脉根部靠近主动脉瓣环处约0.5 cm,用OCT组织固定液包埋固定,液氮速冻后置于-20℃冰箱保存,行冰冻切片,每个标本在显微镜下观察到完整的血管结构后继续切片10-16张,然后进行油红O染色,显微镜下观察血管壁脂质沉积、内膜增厚及斑块形成等病理改变。另取主动脉血管用2.5%戊二醛磷固定后环氧树脂618包埋,切片染色,电镜下观察血管平滑肌细胞、内皮细胞结构变化。
6 采用Western blotting法测定血浆、斑块中内脂素水平[5]
各组血样室温6000 r/min离心 10 min,取上清。SDS-PAGE(10%)电泳分离蛋白。将蛋白从电泳凝胶中转移到NC膜上。5%脱脂奶粉封闭30 min,Ⅰ抗37 ℃2 h,TBS冲洗 3×15 min,碱性磷酸酶标记Ⅱ抗37℃1 h,TBS冲洗4×15 min,NBT方法显色10 min,扫描分析。血浆总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL -C)、甘油三酯(triglycerides,TG)采用全自动生化分析仪测定。
7 统计学处理
用SPSS V13.0统计软件进行处理,数据以均数±标准差()表示,采用单因素方差分析,组间比较用LSD检验分析。
结 果
1 青心酮对ApoE(-/-)小鼠血清内脂素的影响
与对照组比较,动脉硬化组内脂素增高(P<0.01)。青心酮组、辛伐他汀组与动脉硬化组相比均明显下降(P<0.01),但高于正常对照组(P<0.01),见表1、图1。
表1 青心酮对ApoE(-/-)小鼠血浆内脂素的影响Table 1.Effects of DHAP on plasma visfatin in ApoE(-/-)mice(.n=8)

表1 青心酮对ApoE(-/-)小鼠血浆内脂素的影响Table 1.Effects of DHAP on plasma visfatin in ApoE(-/-)mice(.n=8)
**P <0.01 vs control;##P <0.01 vs AS group.
Group Dose(mg·kg-1·d-1)The ratio of plasma visfatin to β-actin Control - 10.13 ±1.06 AS - 29.22 ±1.32**AS+DHAP 10 14.01 ±0.97##AS+simvastatin 10 12.74 ±1.53##
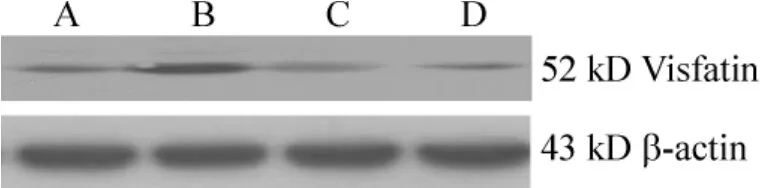
Figure 1.Effects of DHAP and simvastatin on plasma visfatin in ApoE(- /- )mice.A:control group;B:AS group;C:AS+DHAP group;D:AS+simvastatin group.图1 青心酮对ApoE(-/-)小鼠血浆内脂素的影响
2 青心酮对ApoE(-/-)小鼠血浆TC、HDL-C、LDL-C、TG的影响
青心酮对ApoE(-/-)小鼠血脂有抑制作用。与对照组相比,动脉硬化组血脂均增加(P<0.01)。青心酮组和辛伐他汀组中TC、TG较动脉硬化组下降(P <0.01),但高于空白对照组(P <0.01);青心酮和辛伐他汀对HDL-C、LDL-C的影响与动脉硬化组相比无明显差异(P>0.05)。青心酮组和辛伐他汀组之间无显著差异(P>0.05),见表2。
表2 青心酮、辛伐他汀对ApoE(-/-)小鼠TC、HDL-C、LDL-C、TG的影响Table 2.The effects of DHAP and simvastatin on plasma TC,HDL-C,LDL-C,TG in ApoE(-/-)mice(.n=8)

表2 青心酮、辛伐他汀对ApoE(-/-)小鼠TC、HDL-C、LDL-C、TG的影响Table 2.The effects of DHAP and simvastatin on plasma TC,HDL-C,LDL-C,TG in ApoE(-/-)mice(.n=8)
**P <0.01 vs control group;##P <0.01 vs AS group.
Group Dose(mg·kg-1·d-1)TC(mmol·L-1) TG(mmol·L-1) HDL -C(mmol·L-1)LDL -C(mmol·L-1)Control - 2.53 ±0.45 1.50 ±0.23 1.60 ±0.25 1.33±0.20 AS - 24.38 ±1.36** 2.43 ±0.21** 3.76 ±0.24** 10.12 ±0.25**AS+DHAP 10 14.72 ±2.30## 1.87 ±0.33## 3.55 ±0.32 9.23 ±0.21 AS+simvastatin 10 13.47 ±1.75## 1.58 ±0.27##3.64 ±0.26 9.47 ±0.28
3 主动脉根部病理改变
油红O染色可见,对照组仅在外膜有少量红染脂质,动脉硬化组血管切片中不仅可以看到红染脂质浸润,而且可以看到内膜增厚,并在多个血管切片上出现较大斑块形成,该组有4处斑块;青心酮治疗组血管切片可看到明显内膜增厚,但斑块数量较动脉硬化组减少,该组可见2处斑块;辛伐他汀治疗组内膜也有增厚,但较青心酮治疗组稍轻,有1处斑块形成,见图2。
4 青心酮对ApoE(-/-)小鼠斑块中内皮细胞、平滑肌细胞的影响
电镜观察对照组内皮细胞边缘清楚,细胞器结构正常,平滑肌细胞无迁移现象。与对照组比较,动脉硬化组内皮细胞空泡样变,线粒体髓样变,细胞质电子密度低;平滑肌细胞核不规则,内质网脱颗粒,纤维髓样变。青心酮组、辛伐他汀组有类似改变,但较动脉硬化组变化减轻,见图3。
5 青心酮对ApoE(-/-)小鼠动脉粥样硬化斑块中内脂素表达的影响
青心酮对ApoE(-/-)小鼠动脉粥样硬化斑块中内脂素表达有抑制作用。与动脉硬化组相比,青心酮组、辛伐他汀组均降低(P<0.01),但两者之间无显著差异(P >0.05),见表3、图4。

Figure 2.Oil red O staining(×4).A:control group;B:AS group;C:AS+DHAP group;D:AS+simvastatin group.图2 各组小鼠主动脉根部横断面油红O染色病理切片
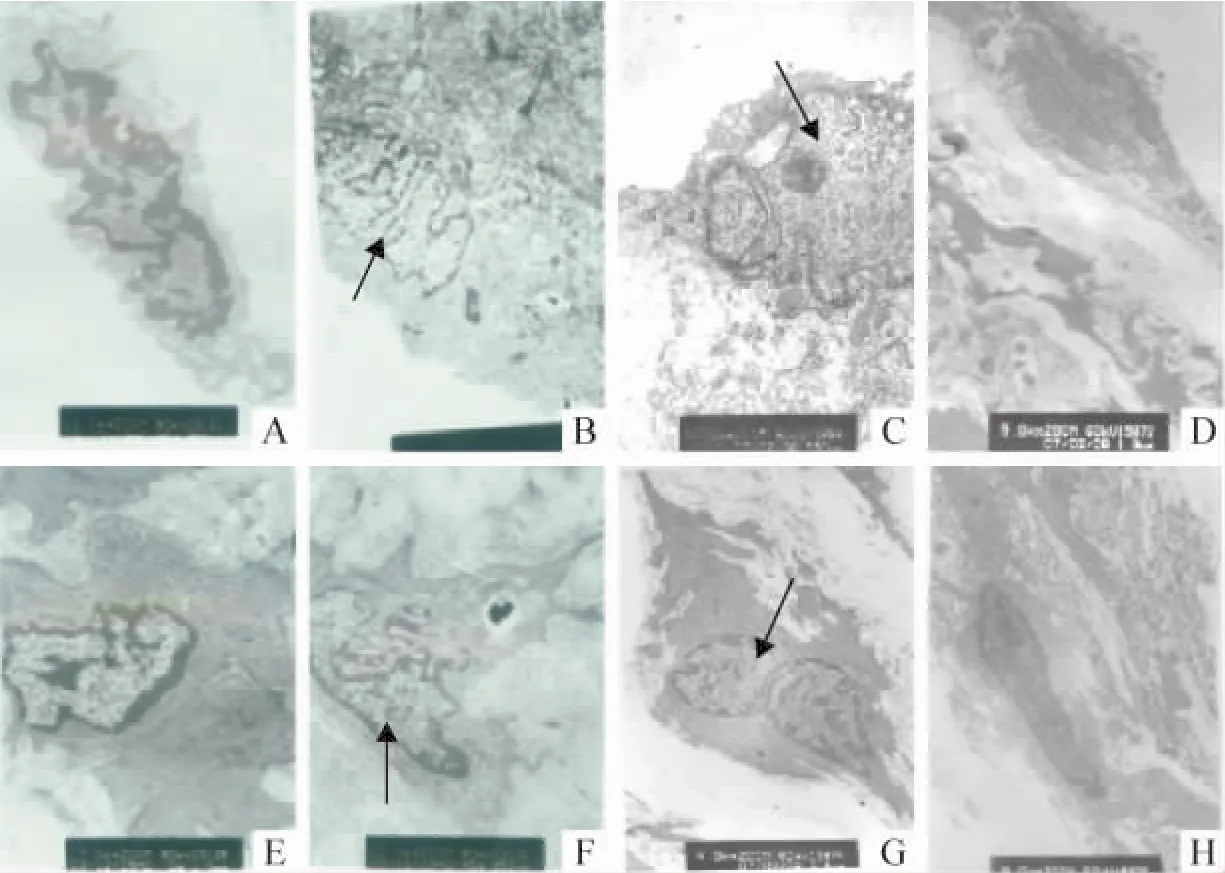
Figure 3.The effects of DHAP and simvastatin on vascular smooth muscle cells and endothelial cells at atherosclerosis plaque of ApoE(- /-)mice(×7000).A:control group;B:AS group;C:AS+DHAP group;D:AS+simvastatin group.A -D:endothelial cells;E -H:vascular smooth muscle cells.图3 青心酮对ApoE(/-)小鼠斑块中内皮细胞、平滑肌细胞的影响
表3 青心酮对ApoE(-/-)小鼠动脉粥样硬化斑块中内脂素表达的影响Table 3.The effects of DHAP on visfatin at atherosclerosis plaque of ApoE(-/-)mice(.n=8)

表3 青心酮对ApoE(-/-)小鼠动脉粥样硬化斑块中内脂素表达的影响Table 3.The effects of DHAP on visfatin at atherosclerosis plaque of ApoE(-/-)mice(.n=8)
** P <0.01 vs AS group.
Group Dose(mg·kg-1·d-1)The ratio of visfatin to β-actin Control - 3.11 ±1.54 AS - 41.20 ±1.30 AS+DHAP 10 19.94 ±0.68**AS+simvastatin 10 17.46 ±1.05**

Figure 4.The effects of DHAP on visfatin at atherosclerosis plaque of ApoE(- /- )mice.A:control group;B:AS group;C:AS+DHAP group;D:AS+simvastatin group.图4 青心酮对ApoE(-/-)小鼠动脉粥样硬化斑块中内脂素表达的影响
讨 论
内脂素是在2005年发现的一种新的脂肪细胞因子(adipocytokines)[1],又称前B细胞克隆增强因子(PBEF),研究表明,内脂素具有类胰岛素作用,能够促进脂肪的合成与聚集,与2型糖尿病、胰岛素抵抗、肥胖有关系[6,7]。现已证实:内脂素可通过和一些尚未确认的受体结合,剂量依赖性地上调单核细胞IL-1β、IL-1Ra、IL-6、IL-10和 TNF-α 水平[2,8],可诱导血管内皮细胞 MCP -1 和 IL -6 的表达[9],因此,内脂素是一种重要的前炎症因子,与AS的发生发展有密切联系,但是内脂素通过哪条途径影响AS发生发展,目前尚未明确。有研究表明内脂素可剂量依赖性增强人内皮细胞NF-κB活性,通过NF-κB通路介导基质金属蛋白酶2/9(MMP-2/9)、血管黏附分子、趋化因子等基因表达,促进血管性炎症反应的发生发展[10]。另外,内脂素还能诱导血管内皮细胞MCP-1和IL-6的表达[11]。
传统中药青心酮,又名3,4-二羟基苯乙酮(3,4-dihydroxyacetophenone,DHAP),是从活血化瘀中药毛冬青根中提取的有效成分。青心酮具有较好的抗炎作用,与其下调TLR4、抑制TNF-α分泌、促进血红素氧合酶 -1(heme oxygenase-1,HO-1)/一氧化碳(carbon monoxide,CO)生成,及作用于环加氧酶-2(cyclooxygenase-2,COX -2)有关[3]。他汀类药除能有效降低胆固醇外,还可使斑块消退,进而减少冠心病临床事件的发生及降低心血管病死亡率[12]。
本实验中普通饲料喂养的ApoE(-/-)小鼠即可出现较严重的高脂血症,并容易在动脉壁形成动脉粥样硬化斑块,高脂饲养可加速动脉粥样硬化形成,且斑块的分布与人类动脉粥样硬化斑块的分布极为相似。本实验发现:青心酮亦能降低血脂水平,与辛伐他汀有相似的作用;青心酮和辛伐他汀皆能抑制ApoE(-/-)小鼠血浆内脂素的生成量及斑块中内脂素的分布,可能通过此途径减少斑块的形成及减轻病变的程度。
[1]Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein secreted by visceral fat that mimics the effects of insulin[J].Science,2005,307(5708):426 -430.
[2]Curat CA,Wegner V,Sengenes C,et al.Macrophages in human visceral adipose tissue:increase accumulation in obesity and a source of resistin and visfatin[J].Diabetologia,2006,49(4):744-747.
[3]张代娟,武少杰,刘同美,等.青心酮对RAW264.7细胞可溶性Toll样受体4表达及炎症相关因子的影响[J].中国临床康复,2006,10(10):120 -122.
[4]徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002.202-204.
[5]J萨姆布鲁克,D W拉塞尔 著.黄培堂 译.分子克隆实验指南[M].第3版.北京:科学出版社,2002.516-701,1713-1726.
[6]Dogru T,Sonmez A,Tasci I,et al.Plasma visfatin levels in patients with newly diagnosed and untreated type 2 diabetes mellitus and impaired glucose tolerance[J].Diabetes Res Clin Pract,2007,76(1):24 -29.
[7]Berndt J,Kloting N,Kralisch S,et al.Plasma visfatin concentrations and fat depot-specific mRNA expression in humans[J].Diabetes,2005,54(10):2911 -2916.
[8]Moschen AR,Kaser A,Enrich B,et al.Visfatin,an adipocytokine with proinflammatory and immunomodulating properties.[J].J Immunol,2007,178(3):1748 - 1758.
[9]Liu SW,Qiao SB,Yuan JS,et al.Visfatin stimulates production of monocyte chemotactic protein-1 and interleukin - 6 in human vein umbilical endothelial cells[J].Horm Metab Res,2008,65(13):653 -658.
[10]Adya R,Tan BK,Chen J,et al.Nuclear factor- κB induction by visfatin in human vascular endothelial cells its role in MMP - 2/9 production and activation[J].Diabetes Care,2008,31(4):758-760.
[11]Liu SW,Qiao SB,Yuan JS,et al.Visfatin stimulates production of monocyte chemotactic protein-1 and interleukin - 6 in human vein umbilical endothelial cells[J].Horm Metab Res,2009,41(4):281 -286.
[12]Rosenson RS,Tangney CC.Antiatherothrombotic properties of statins:implications for cardiovascular event reduction[J].JAMA,1998,279(20):1643 -1650.

