受PVY诱导的烟草NtERD1的基因分离与表达分析
陈 帅,刘贯山,杨爱国,王元英,孙玉合
(中国农业科学院烟草研究所,农业部烟草类作物质量控制重点开放实验室,青岛 266101)
烟草(Nicotiana tabacumL.)是我国重要的经济作物,在国民经济中具有很重要的地位。烟草的田间种植经常受到马铃薯Y病毒(PVY)等多种病原菌的侵染且危害程度越来越重,严重影响烟草种植和烟叶生产[1]。植物在长期进化过程中,为最大限度地减轻病害胁迫造成的伤害,形成了一系列复杂的机制,期间会引发和激活上千种基因的表达[2]。
快速应答在植物应对外界环境生物胁迫和非生物胁迫中起到重要作用,是植物一种积极有效的反应。脱水诱导早期应答基因(ERD)是可以快速应答干旱反应的基因,最早是在拟南芥脱水诱导1 h获得的[3]。目前在拟南芥中已获得16个ERD基因,它们属于不同的基因家族,作用于不同的代谢途径,通过不同的方式增强拟南芥的抗旱性;除了具有快速应答干旱胁迫的特征,还具有应答冷、盐、衰老、ABA等多种逆境胁迫信号的特征[4]。其中ERD15是受干旱诱导快速应答的基因,编码1个亲水性蛋白[5-6],该基因受干旱、高盐、低温、外界损伤、ABA、水杨酸、植物病原菌等多种生物胁迫和非生物胁迫的刺激诱导快速表达[7]。
目前生产上对于烟草 PVY的防治尚无有效的药剂,所以筛选相关 PVY抗性基因,从而选育抗PVY烟草品种在该病害的综合治理中显得尤为重要。本研究通过抑制差减杂交和cDNA芯片从烟草抑制差减杂交文库中筛选得到一个脱水诱导蛋白基因。通过实时荧光定量PCR技术,分析该基因在PVY不同诱导时期的表达模式,揭示其在不同诱导时期的表达量以及对 PVY诱导的应答机制,以期为利用该基因改良普通烟草的抗 PVY能力奠定基础。
1 材料与方法
1.1 植物材料与处理
供试材料为高抗PVY的白肋烟VAM。将种子播种于消毒的土壤和播种盘中,置于温室自然光照条件下培养,待幼苗长至 4~5片真叶时,采用摩擦法[8]进行 PVY接种(10倍接种液)处理,分别收集接种处理及未接种对照(空白接种液处理)在12 h、24 h、2 d、3 d、5 d和8 d 6个时间点的叶片组织。所有实验材料冻存于-70℃冰箱中备用。
1.2 总RNA提取与mRNA分离纯化
取接种处理及未接种对照在6个不同时间点的叶片各1 g,在液氮中速冻研磨。采用Trizol法提取叶片总RNA,提取步骤参照RNApure超纯总RNA快速提取试剂盒说明书进行(盖宁生物)。将提取的RNA溶解后置于-70℃冰箱保存备用。将接种处理和未接种对照的6个时间点的总RNA等量混合,形成500 µg的总RNA池,用于mRNA的分离。mRNA的分离纯化参照PolyA Tract mRNA Isolation Systerms试剂盒(Promaga公司)的说明书进行,分离纯化mRNA的量为2 µg。
1.3 筛选PVY诱导表达的EST序列
抑制差减杂交方法的具体操作按照CLONTECH PCR-SelectTM cDNA Subtraction kit试剂盒(Clontech公司)使用手册进行。取适量纯化的抑制差减杂交产物连接、转化、构建抑制差减杂交文库。从该文库中挑取阳性PCR产物,经纯化浓缩,点制cDNA芯片。根据6个不同的接种时间点,制备6张cDNA芯片,分别反映不同接种时间点的基因表达情况。以Cy5标记接种PVY的烟草叶片mRNA(处理),Cy3标记未接种PVY的烟草叶片mRNA(对照)作为探针分别与6张芯片杂交,每张芯片反映的是处理与对照两个样品的比较结果,以两个样品的比值Ratio值作为差异表达的参考值。Ratio值≥2或≤0.5的表示表达有差异的基因;Ratio值在0.5~2之间的属于表达基本没有差异的基因。对所获得上调表达克隆进行测序,对所获得的ESTs序列信息在NCBI的Blast(http://www.ncbi.nlm.nih.gov/Blast.cgi)网站上进行比对分析,从差异表达片段中挑取脱水诱导基因的EST序列。
1.4 序列分析
利用NCBI的ORfinder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)预测该序列的开放阅读框,通过NCBI网站的Blast程序进行核苷酸序列与氨基酸序列的同源性比对。采用DNAMAN(6.0版)预测编码产物的蛋白质一级结构、分子量和等电点。应用DNAStar Protean软件预测蛋白质的二级结构。用ClustalX(1.83版)对NtERD1与拟南芥的16个ERD编码的氨基酸序列进行多重比对,并通过 MEGA4.0软件[9]构建邻接法 NJ(neighbor joining)系统树[10]。
1.5 实时荧光定量PCR分析
分别取不同接种时间点和空白接种对照的叶片组织总RNA 3 μg为模板,反转录成cDNA,cDNA的合成按照PrimeScriptTM RT reagent Kit(Perfect Real Time)的说明书操作。对实验中不同处理的cDNA模板进行 10倍梯度稀释,分别对内参基因Actin和目的基因特异引物进行扩增获得标准曲线,纵坐标为临界循环值Ct,横坐标为稀释浓度的对数值。根据标准曲线所得的线性计算公式[11]得到目的基因相对浓度。
利用荧光染料法进行相对荧光定量PCR反应,以烟草Actin基因(NTU60495)为内参,采用25 ul PCR体系,包括12.5 ul SYBR Green Master mix reagent、10 ul无菌水、0.5 ul DyeⅡ、1 ul cDNA和各0.5 ul(2 mM)的荧光定量上、下游引物(RTF:5'- CAC TGA TAA GAA CTA TGC GTT CAC -3';RTR: 5'- CTA AGC TAA TCA CAT TCA GCG AG -3';ActinF: 5'-CAA GGA AAT CAC CGC TTT GG-3';ActinR: 5'-AAG GGA TGC GAG GAT GGA-3')。PCR 程序为 95℃ 1 min,(95℃ 6s,62℃ 35 s)×35个循环。操作步骤参照 SYBR®Premix Ex Taq™(Perfect Real Time)(TakaRa公司)的操作说明书进行,每个样品设3次重复。通过ABI 7500 Fast Real-Time PCR System的SDSShell.exe分析系统分析NtERD1的相对表达量。
2 结 果
2.1 烟草脱水诱导早期应答基因的筛选及序列分析
以6个不同PVY接种时期的烟草叶片mRNA作为探针,利用cDNA芯片筛选已构建的抑制差减杂交文库。cDNA芯片分析结果显示,共有915个上调表达的克隆(Ratio值>2)(cDNA芯片结果未显示),挑选部分上调表达的克隆进行测序。克隆序列经在NCBI网站比对分析发现,其中一条745 bp的EST序列与番茄(Lycopersicon esculentum)脱水诱导早期应答基因ERD15(GenBank登录号AF261139)高度同源。ORfinder分析结果显示,该序列包含一个492 bp的开放读码框,编码163个氨基酸(图1)。氨基酸Blastp比对显示,该氨基酸序列与其他植物脱水诱导早期应答蛋白具有很高的同源性,与番茄ERD15(AAF75749)同源性为85%,与辣椒(Capsicum annuum)ERD15(ABB89735)同源性为74%,因此,该EST序列为烟草脱水诱导早期应答基因,被命名为NtERD1(Nicotiana tabacum early responsive to dehydration 1),GenBank登录号为GU144573。

注:核苷酸和氨基酸序数在左边用数字标出,起始密码子和终止密码子加框标出。
DNAMAN(6.0版)分析一级结构表明,NtERD1编码的氨基酸分子量为 18.4 kD,等电点(pI)为4.36。应用DNAStar Protean软件的Garnier法进行二级结构预测表明,NtERD1属于一种混合型蛋白,在二级结构中,α螺旋占7.98%,β片层占54%,Turn转角占19%,Coil无规则卷曲占19%。
2.2 NtERD1系统进化树分析
目前在植物中获得具有ERD特征的基因较少,研究报道主要集中在拟南芥上,功能研究较全面,因此本文利用MEGA4.0软件对烟草NtERD1和16个拟南芥ERD蛋白构建邻接法NJ系统树(图2)。进化分析表明,NtERD1与AtERD15进化关系较近,它们可能是直系同源蛋白。
2.3 NtERD1荧光定量表达分析
应用实时荧光定量PCR技术对NtERD1在空白接种对照及接种处理的表达特性进行分析。融解曲线分析表明,内参基因Actin(图3a)和目的基因NtERD1(图3b)的扩增产物均呈较为锐利的单一峰,Tm分别为83℃和84.5℃左右。将反转录得到的烟草叶片cDNA模板按照50、5-1、5-2、5-3和5-4浓度进行稀释,以稀释浓度的对数值为横坐标,以临界循环值为纵坐标分别对内参基因和目的基因进行标准曲线制作。以普通烟草Actin基因设计的ActinF和ActinR为荧光定量PCR反应引物,按荧光定量反应体系进行反应,构建内参基因标准曲线,R2=0.998297,标准曲线斜率为-3.538515,截距为31.255245,直线方程为Y= -3.538515X+31.255245(图4a);以普通烟草目的基因设计的RTF和RTR为荧光定量 PCR反应引物,构建目的基因标准曲线,R2=0.992372,标准曲线斜率为-4.266456,截距为 30.819479,直线方程为Y= -4.266456X+30.819479(图4b)。标准曲线分析表明,内参基因和目的基因的标准曲线的线性范围较广,在5个数量梯度上呈良好的线性关系。

图2 NtERD1与拟南芥16个ERD的系统进化关系Fig.2 Phylogenetic relatedness among NtERD1 and 16 ERDs from Arabidopsis thaliana

图3 内参基因(a)和目的基因(b)扩增的熔解曲线Fig.3 Melting curves of the endogenous control and test gene
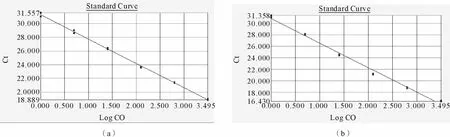
图4 内参基因(a)和目的基因(b)的标准曲线Fig.4 Standard curves of the endogenous control and test gene
在检测的线性范围分别收集12 h、24 h、2 d、3 d、5 d和8 d 6个时间点接种PVY和空白接种对照(CK)的烟草叶片组织并提取 RNA,反转录为cDNA。荧光定量PCR表达分析结果显示,NtERD1在PVY接种早期上调表达,接种PVY后12 h、1 d、2 d和3 d 4个时间点与空白接种对照相比表达量明显增高,与对照相比分别增高了11%、61.6%、35.7%和76.3%,随后表达量逐渐降低(图5)。
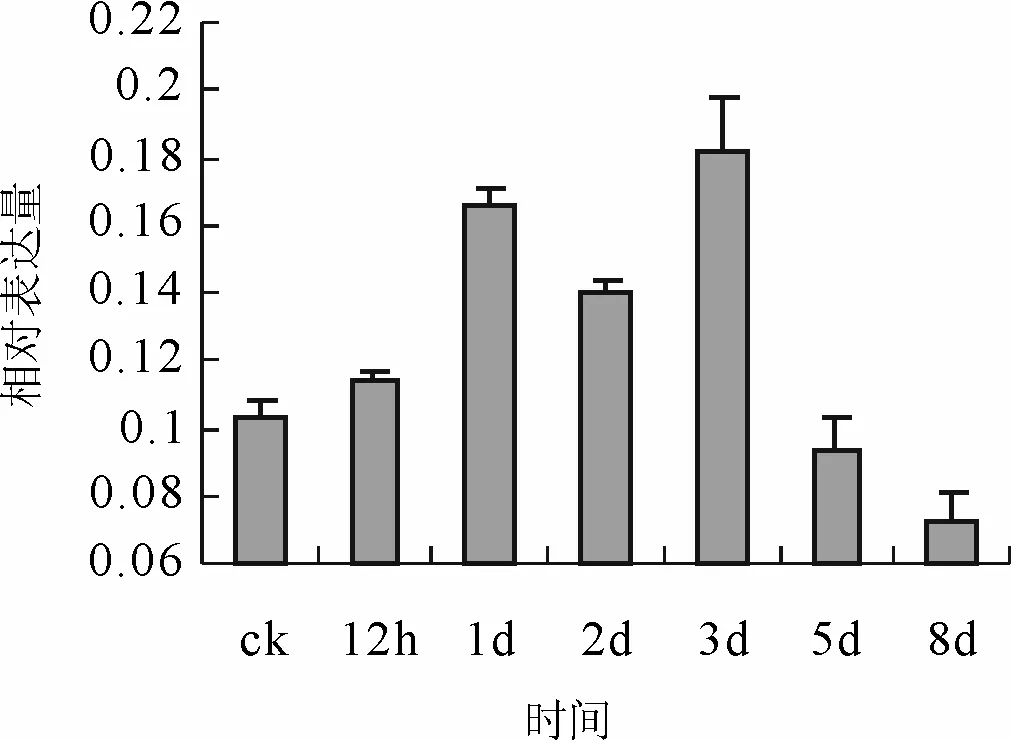
图5 NtERD1在不同时间点接种PVY的表达量Fig.5 The expression patterns of NtERD1 induced by PVY at different time stages.
3 讨 论
通过进化树的构建,可以分析分子之间的起源关系,预测分子的功能;同一亚家族或分枝往往具有相似的功能。研究表明,同源关系较近的基因往往编码同类蛋白,表现出极为相似的功能。例如拟南芥AtERD10和AtERD14,它们的编码产物属于Ⅱ型LEA蛋白家族(胚胎晚期丰富蛋白),干旱处理1 h后在拟南芥的叶片组织强烈表达,基因的表达同时还受ABA的诱导,不受低温、2,4-D、BA和GA3等其他激素的诱导[12]。AtERD11和AtERD13的编码产物属于硫代谷胱甘肽转移酶,有可能在植物脱水中避免毒素的产生[13]。与NtERD1同源关系较近的AtERD15受多种生物因子和非生物因子的诱导快速表达。过表达ERD15会降低植株对干旱、冷和ABA等胁迫的耐受力;相反,缺失ERD15的转基因拟南芥抗旱性和抗冷性都提高;过表达ERD15也伴随着ABA的含量增加,植株对ABA的敏感性降低;过表达ERD15诱导了受水杨酸调控基因的应答,可以抵抗病原菌[7]。因此,NtERD1也可能具有与AtERD15相似的功能。
依赖ABA途径的脱水反应中,植物在脱水等胁迫条件下内源 ABA水平会显著增加,胁迫信号首先激发ABA合成酶的作用,使ABA在细胞内迅速积累,然后内源ABA通过ABA受体被细胞感知,从而触发第二信号传递系统,植物做出相应的抵御胁迫的反应[14]。与 NtERD1位于同一进化组中的AtERD15可能是一个新的与ABA信号胁迫相关的调节器。不依赖 ABA途径的植物脱水诱导相关的蛋白,目前已鉴定出参与转录调解的顺式作用元件和反式作用因子(转录因子),即顺式作用元件DRE(dehydration responsive element)和含有AP2/EREBP结构域的 DRE转录因子 CBF1、DREB1和DREB2[15-16]。拟南芥DEAR1编码的蛋白包含DREB1/CBF结构域和EAR基序。试验研究表明,DEAR1在转录水平上受病原菌侵染和低温诱导上调表达[17]。
到目前为止,已有研究表明,植物脱水诱导早期应答基因参与植物体抵御多种病原菌侵染的应激反应,受真菌、细菌、病毒等病原菌的诱导。本实验获得的烟草脱水诱导早期应答基因NtERD1是利用cDNA芯片筛选受PVY诱导的抑制差减文库得到的表达上调基因,为进一步验证NtERD1是否受PVY侵染的诱导,我们利用实时荧光定量PCR研究了不同接种时期NtERD1在转录水平的表达量变化。结果表明,NtERD1在接种PVY 12 h、1 d、2 d和3 d时间点的烟草叶片组织中的表达量与空白接种对照的相比明显增高,随后逐渐降低。这表明,在PVY接种初期,NtERD1受PVY侵染早期的诱导上调表达,可能参与烟草早期的抗病毒反应。
4 结 论
本研究利用抑制差减杂交法和cDNA芯片法从受 PVY诱导的烟草抑制差减文库中筛选得到一个受 PVY诱导上调表达的脱水诱导早期应答基因NtERD1。通过系统进化分析,NtERD1与拟南芥AtERD15可能是直系同源基因。实时荧光定量PCR分析进一步证实,该基因是一个受 PVY侵染早期诱导上调表达的基因。因此可以推断,NtERD1可能在调控烟草抗病毒侵染中起重要作用。
[1]朱贤朝,王彦亭,王智发.中国烟草病害[M].北京:中国农业出版社,2002:209-212.
[2]Seki M, Narusaka M, Ishida J, et al.Monitoring the expression profiles of 7000Arabidopsisgenes under drought, cold and high-salinity stresses using a full-length cDNA microarray[J].Plant J, 2002, 31(3):279-292.
[3]Kiyosue T, Yamaguchi-Shinozaki K, Shinozaki K.Characterization of cDNA for a dehydration-inducible gene that encodes a ClP A, B-like protein inArabidopsis thalianaL[J].Biochem Biophys Res Commun, 1993,196(3): 1214-1220.
[4]刘颖慧, 王天宇, 黎裕.拟南芥脱水诱导早期应答基因研究进展[J].中国农业大学学报,2009,14(3):7-11.
[5]Kiyosue T, Yamaguchi-Shinozaki K, Shinozaki K.Cloning of cDNA for genes that are early responsive to dehydration stress (ERDs) inArabidopsis thalianaL.:identification of three ERDs as HSP cognate genes[J].Plant Mol Biol, 1994, 25(5): 791-798.
[6]Kiyosue T, Yamaguchi-Shinozaki K, Shinozaki K.ERD15, a cDNA for a dehydration-induced gene fromArabidopsis thaliana[J].Plant Physiol, 1994, 106: 1707.
[7]Kariola T, Brader G, Helenius E, et al.Early responsive to dehydration 15, a negative regulator of abscisic acid responses inArabidopsis[J].Plant Physiol, 2006, 142(4):1559-1573.
[8]竺晓平,朱常香,宋云枝,等.CP基因3'端短片段介导的对马铃薯Y病毒的抗性[J].中国农业科学,2006,39(6):1153-1158.
[9]Tamura K, Dudley J, Nei M, et al.MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0[J].Mol Biol Evol, 2007, 24(8): 1596-1599.
[10]Saitou N, Nei M.The neighbor-joining method: a new method for reconstructing phylogenetic trees[J].Mol Biol Evol, 1987, 4(4): 406-425.
[11]Pfaffl M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucl Acids Res,2001, 29(9): 2002-2007.
[12]Kiyosue T, Yamaguchi-Shinozaki K, Shinozaki K.Characterization of two cDNAs (ERD10 and ERD14)corresponding to genes that respond rapidly to dehydration stress inArabidopsis thaliana[J].Plant Cell Physiol, 1994, 35: 225-231.
[13]Kyiosue T, Yamaguchi-Shinozaki K, Shinozaki K.Characterization of two cDNAs (ERD11 and ERD13) for dehydration-inducible genes that encode putative glutathione S-transferases inArabidapsis thalianaL[J].FEBS Lett, 1993, 335: 189-192.
[14]沈元月,黄丛林,张秀海,等.植物抗旱的分子机制研究[J].中国生态农业学报,2002,10(1):30-34.
[15]Liu Q, Kasuga M, Sakuma Y, et al.Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought- and low-temperature-responsive gene expression, respectively, inArabidopsia[J].Plant Cell, 1998, 10(8): 1391-1406.
[16]Stockinger E J, Gilmour S J, Thomashow M F.Arabidopsis thalianaCBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE, a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J].Proc Natl Acad Sci USA, 1997, 94: 1035-1040.
[17]Tsutsui T, Kato W, Asada Y, et al.DEAR1, a transcriptional repressor of DREB protein that mediates plant defense and freezing stress responses inArabidopsis[J].J Plant Res, 2009, 122(6): 633-643.

