噻唑橙-壳聚糖-叶酸靶向荧光探针的制备及性能研究
孟庆洋,费学宁,王义启
(天津城市建设学院 材料科学与工程系,天津 300384)
荧光染料是一种广泛使用的荧光标示剂(又称为荧光探针),具有检测速度快、重复性好、用样量少、无辐射等优点.单体噻唑橙(TO)噁和 唑黄(YO)系列及其二聚体染料为典型的嵌入式探针,该种荧光探针染料对肿瘤细胞比对正常细胞更具亲和力,由于其标记速度快、接近生理 pH条件、对生物分子的功能活性影响小,因此已成为研究比较活跃的一类典型标记菁染料[1].
近二十多年来,随着分子生物学的发展、免疫物质的化学研究与发展,以及对新药物资源的寻找与开发,对多糖的研究受到越来越广泛的重视[2-4].壳聚糖[5-6](Chitosan,简称 CTS)是一种来源丰富、具有良好生物相容性及生物可降解性的天然高分子材料.由于壳聚糖分子内的羟基、氨基活泼性较强,因而容易对其进行化学改性;还可根据特定的对象选择合适的生物分子进行修饰,如修饰配体定位受体及修饰探针DNA、检测目标 DNA 等,为生物医学研究提供一种传统荧光检测的新方法[7].因壳聚糖的存在,在配体与染料之间起到了一种桥梁的作用,并可增加染料的细胞相容性,降低毒性.同时,一个壳聚糖上接枝多个染料分子,在与组织结合和成像时所表现出的光学加合效应,对提高探针分子的灵敏度,降低使用量方面有积极意义.2005年,朝鲜Wonkwang大学的Kim等人[8]以半乳糖修饰的壳聚寡糖异硫氰荧光染料对肝细胞进行靶向成像,光学成像主要位于肝细胞.
叶酸作为靶向配体用于肿瘤靶向识别是近年备受关注的热点之一.叶酸是一种人体必需的 B组维生素,它在体内的主要转运途径是通过叶酸受体,特别是在多种上皮肿瘤组织,叶酸受体的表达量远远高于正常组织[9],这是肿瘤组织快速增殖所必需的.已有研究显示,将壳聚糖与叶酸偶联,可作为 DNA 或RNA 的靶向载体[10-11].
本文研究的目的是用壳聚糖修饰噻唑橙类衍生物,从而改善噻唑橙荧光染料的水溶性;同时通过偶联叶酸,特异识别叶酸受体过度表达的肿瘤细胞,实现肿瘤细胞靶向识别的作用.其合成路线如图1所示.
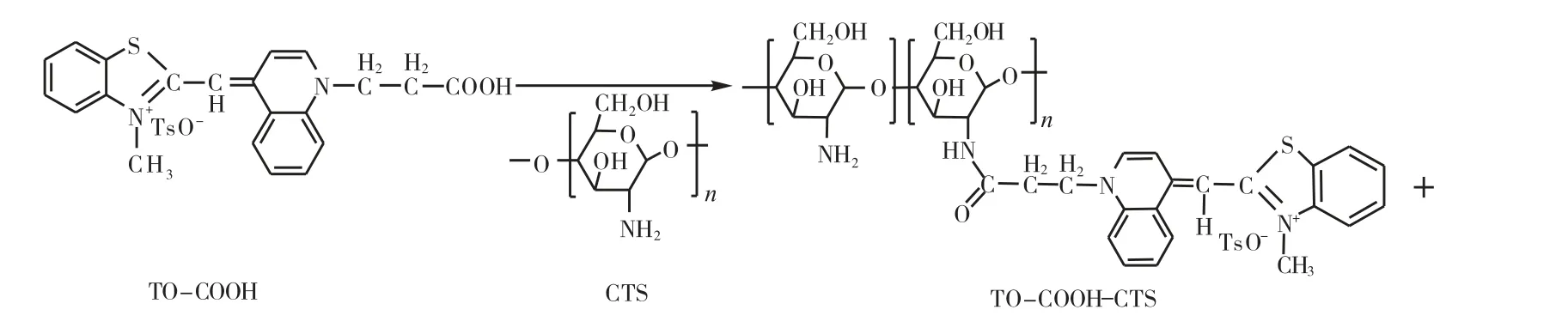
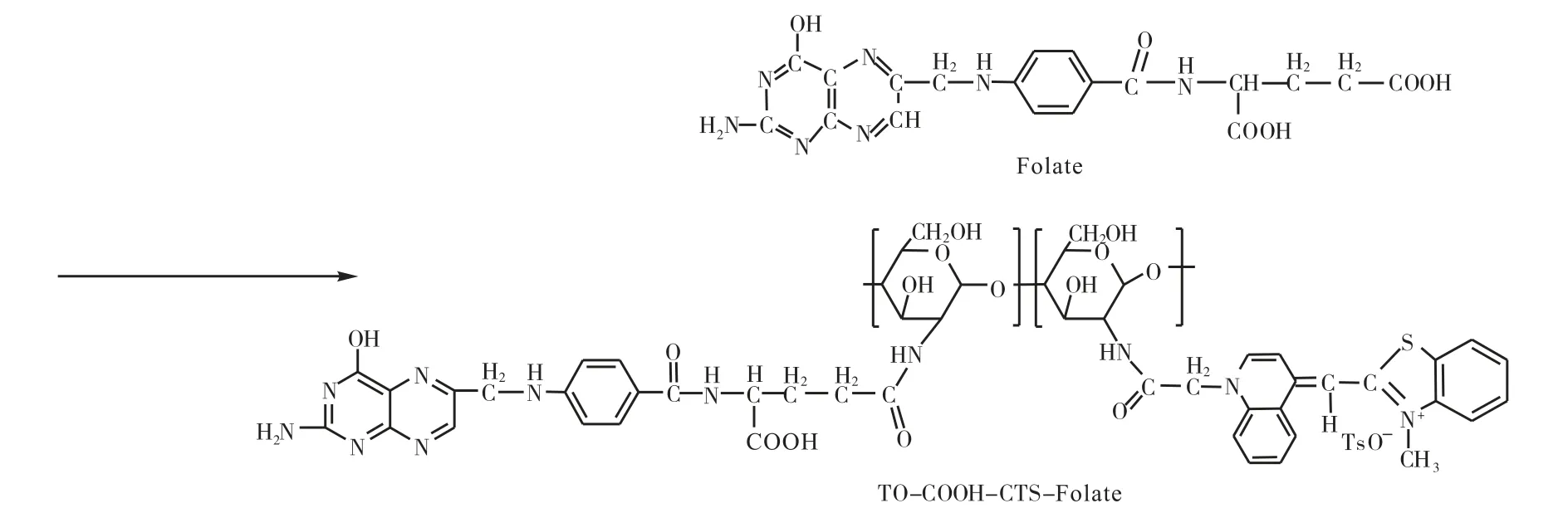
图1 TO-COOH-CTS-Folate反应示意图
1 实验部分
1.1 主要原料和仪器
所用试剂均为市售分析纯,薄层色谱所用硅胶(GF254型)为青岛海洋化工有限公司产品,荧光分光光度计为Cary Eclipase(美国瓦里安公司)生产,红外光谱仪 Nicolet380(美国热电集团),差热分析仪为EXSTAR6000 TG/DTA差热质量分析仪(日本SEIKO公司).
1.2 TO-COOH-CTS的制备
分别将 100 mg(0.19 mmol)TO-COOH、78 mg(0.38 mmol)N,N-二环己基碳二亚胺(DCC)、44 mg(0.38 mmol) N-羟基琥珀酰亚胺(NHS)和57 mg(0.57 mmol)的三乙胺加入 20 mL无水 DMSO中,室温搅拌至呈均相体系,然后加入30 mL甲醇,搅拌均匀,冷却至-5 ℃;向其中加入10 mL含有1 g CTS(相对分子质量<3 000)的 1%醋酸水溶液.在氮气保护下,60 ℃加热搅拌反应.反应停止后,加入乙醚萃取,下层溶液用 100 mL丙酮沉淀,过滤,甲醇洗涤沉淀物,干燥,得到 500 mg的红色固体.其他条件的实验操作如上所述.
1.3 TO-COOH-CTS制备工艺的优化
1.3.1 TO和TO-CTS的紫外吸收及CTS修饰后TO相对量的确定
为确定CTS修饰后的TO的浓度与吸光度的定量关系,首先要确定TO与TO-CTS的相关性.采用紫外扫描光谱确定其相互关系,结果如图2所示.
由图2可知:TO与TO-CTS具有相同的紫外吸收特征,波形一致,说明CTS对 TO的紫外吸收没有产生影响,因此可通过 TO的紫外吸收强度与浓度的线性关系来确定CTS修饰后的染料中所含TO的相对量.
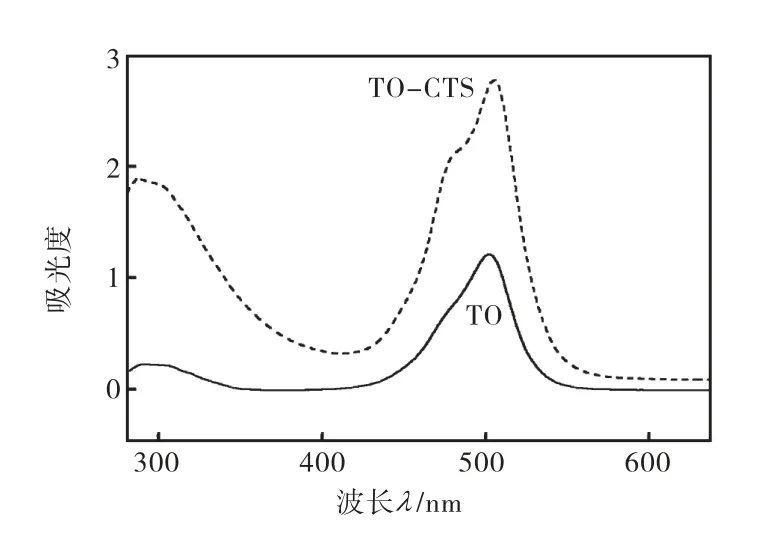
图2 荧光染料紫外吸收光谱
1.3.2 TO-COOH标准曲线的绘制
称取 TO-COOH 5 mg,置于 100 mL容量瓶中,用二甲基亚砜(DMSO)溶解并稀释到刻度;分别取10.0,6.0,5.0,4.0,3.0,2.0 mL 置于 10 mL 容量瓶中,用 DMSO稀释到刻度,以 DMSO溶液为空白,用紫外分光光度计在 507 nm 处测定吸光度.以 TOCOOH浓度对吸光度做标准曲线.
1.3.3 偶联比的计算
取制得的TO-COOH-CTS 5 mg溶于水中,用水定溶至10 mL,然后在507 nm处测定紫外吸光度,计算每毫克CTS上偶联的TO-COOH毫克数.偶联比(GR)的计算公式为
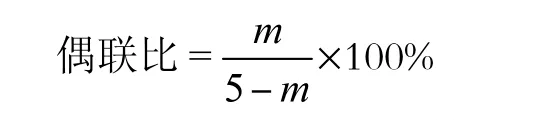
式中:m为通过标准曲线折算出的 5 mg复合物中含有的TO-COOH的质量.
1.4 TO-COOH-CTS-Folate的合成
将叶酸 1.5 g(1.7 mmol)、DCC 1.4 g(3.4 mmol)、NHS 780 mg(3.4 mmol)和1 mL的三乙胺溶于70 mL无水DMSO中,避光过夜搅拌,直至叶酸溶解,过滤除去副产物;向其中加入40 mL含有360 mgTO-COOHCTS的水溶液,氮气保护,50 ℃加热搅拌 24 h;停止反应,过滤,滤饼用pH=7.4的缓冲溶液洗涤,丙酮洗涤,干燥,得到400 mg红色固体.
2 结果与讨论
2.1 TO-COOH-CTS的结构表征
通过红外光谱(IR)和差热分析(DTA),对制得的TO-COOH-CTS和 TO-COOH-CTS-Folate的结构进行表征.
2.1.1 TO-COOH-CTS的红外光谱
采用红外光谱对TO-COOH-CTS的结构进行表征,结果如图3所示.
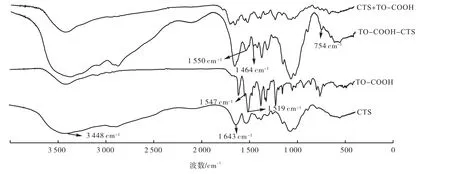
图3 CTS、TO-CTS、TO的红外光谱
由图3可知:在 3 448 cm-1左右为壳聚寡糖中O—H基的伸缩振动峰和N—H基的伸缩振动峰重叠而成的多重吸收峰;在 1 643 cm-1左右为壳聚糖上氨基的特征吸收峰;在 1 519,1 470,1 547 cm-1左右为TO内的芳环骨架振动峰;在CTS和TO-COOH物理混合物(CTS+TO-COOH)的红外谱图中也有以上特征峰;但 TO-COOH-CTS的红外光谱曲线中吸收峰1 504,1 464,1 550 cm-1为芳环骨架振动;在 754 cm-1处出现新的吸收峰,是六元环内氢键的骨架振动峰.
2.1.2 TO-COOH-CTS的差热分析谱图
采用差热分析对TO-COOH-CTS的结构进行表征,结果如图4所示.
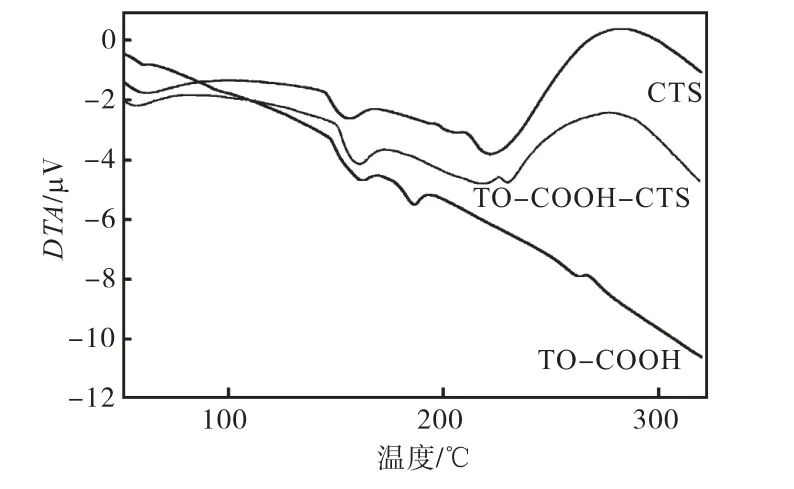
图4 CTS、TO-CTS、TO的差热分析曲线
由图4可知:①CTS的热分解可分为二个阶段,第一步分解在 30~80 ℃,主要是脱去所带的部分水分;第二步是在200~400 ℃,在220 ℃左右出现一个小的吸热峰,当温度升至 280 ℃左右时出现大量放热,峰形变宽而高.②在TO-COOH的DTA曲线中,在 30~80 ℃范围内时,TO-COOH 脱水的吸热峰很小,在160 ℃左右和185 ℃又出现两个小的特征吸热峰.③接枝后的产物的DTA曲线明显不同于CTS和TO-COOH 的,其在 276 ℃左右时出现较强的放热峰,CTS放热峰在 283 ℃;而且在 185 ℃时 TOCOOH的特征吸热峰消失;同时,TO-COOH-CTS在229 ℃时出现了新的吸热峰.
结合图3和图4可知,CTS和TO-COOH不是简单的物理混合,壳聚糖已与羧基噻唑橙反应形成了复合物.
2.2 反应条件对偶联比的影响
根据 TO-COOH-CTS的制备条件,选择反应温度、反应时间、反应底物用量等对偶联比有影响的因素分别进行研究.
2.2.1 反应时间对偶联比的影响
保持原料投量和反应温度不变,改变反应时间,测定偶联比随反应时间变化的曲线,结果如图5所示.
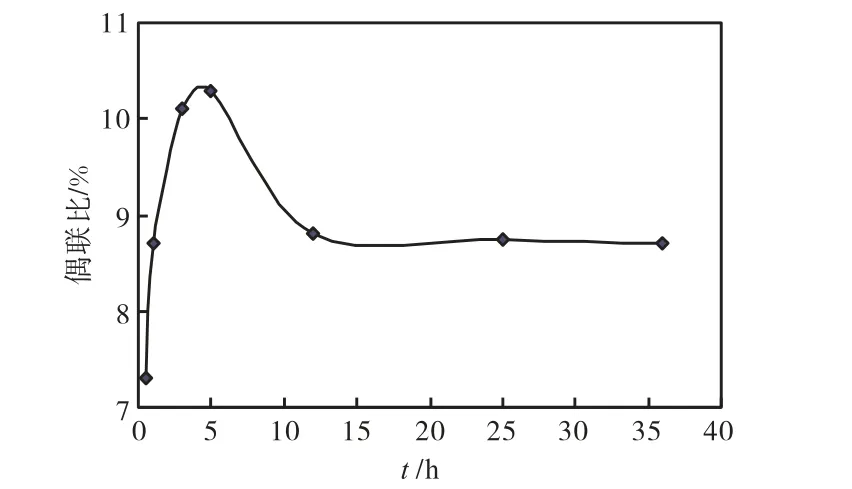
图5 偶联比随时间的变化曲线
由图5可知:开始时,反应物浓度较大,反应进行的较快,所以偶联比随反应时间的延长先增加,当反应达到 5 h时,偶联比达到最大;继续延长反应时间,随着接枝链TO-COOH-CTS的不断增长,体系黏度变大,单体难以扩散到接枝活性中心,致使偶联比开始减小;当反应时间达 12 h后,反应速率减缓,偶联比趋于平稳.
2.2.2 反应温度对偶联比的影响
保持原料投量和反应时间不变,改变反应温度,测定偶联比随反应温度的变化曲线,结果如图6所示.
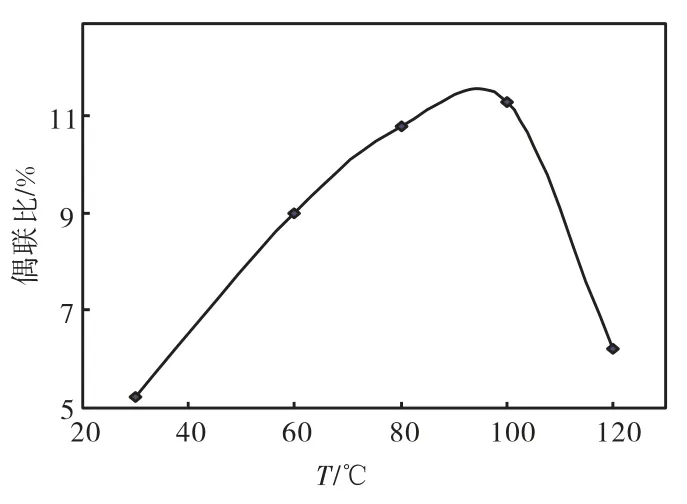
图6 偶联比随反应温度的变化曲线
由图6可知:此反应在室温条件下就可以进行,偶联比随温度升高先增大,当反应温度达到 95 ℃左右时,偶联比达到最大,随后趋于减小.这是因为温度升高时,单体运动能力增强,使 TO-COOH单体易于扩散至 CTS附近,有利于接枝;而温度过高时,反应体系不稳定,不利于反应进行.
2.2.3 CTS与TO-COOH的比例对偶联比的影响
保持反应时间和反应温度不变,改变投料比例,测定偶联比随CTS与TO-COOH的比例变化曲线,结果如图7所示.
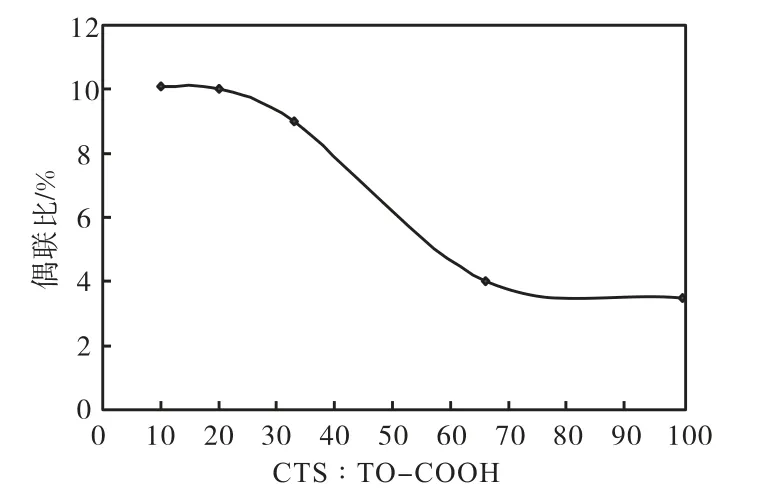
图7 偶联比随CTS与TO-COOH比例的变化曲线
由图7可知:偶联比随着CTS与TO-COOH比例的减少而增加,当 CTS与 TO-COOH的摩尔比值小于 10∶1以后,接枝率的增加趋于平缓(CTS的分子质量按每个结构单元的 161 g/mol计算).因为随着 TO-COOH比例的增加,TO-COOH的浓度相应增加,其扩散速度加快,偶联比增加;而随着反应进行程度的不断加深,体系黏度会增大,TO-COOH向接枝链的扩散受阻,从而使接枝链增加缓慢;当 TOCOOH的量增至一定值后,偶联比趋于一稳定值.综合考虑,以CTS与TO-COOH的摩尔比值等于10∶1为最佳.
2.3 TO-COOH-CTS的荧光分析
采用荧光光谱法对所制备的染料衍生物进行光谱测定,结果如图8所示.
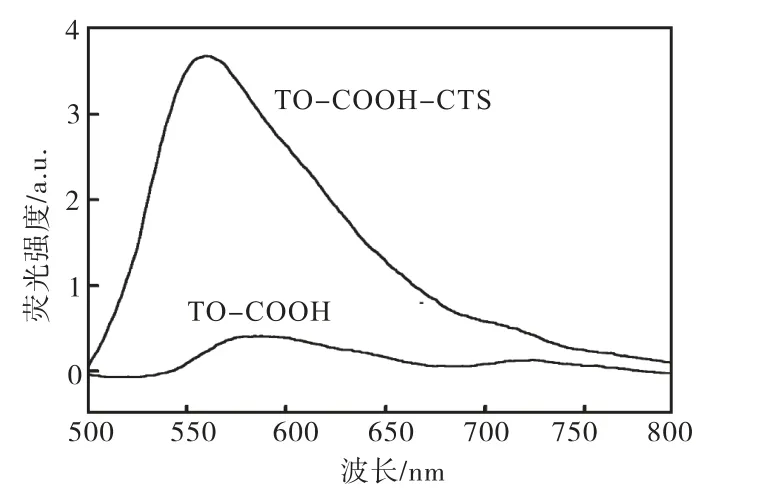
图8 TO-COOH和TO-COOH-CTS的荧光光谱
由图8可知:相同 TO浓度的 TO-COOH-CTS与 TO-COOH相比,荧光最大发射波长无明显变化,而荧光强度明显增强,荧光量子效率也有明显的提高.这是因为TO-COOH-CTS中CTS部分的空间阻碍作用在一定程度上限制了 TO分子的旋转角度,改变了 TO分子的空间构象,进而使 TO-COOH-CTS的荧光强度发生变化.关于TO-COOH与CTS及细胞的多重相互作用关系正在研究中.
2.4 TO-COOH-CTS-Folate的红外光谱
采用红外光谱法对TO-COOH-CTS-Folate的结构进行表征,结果如图9所示.
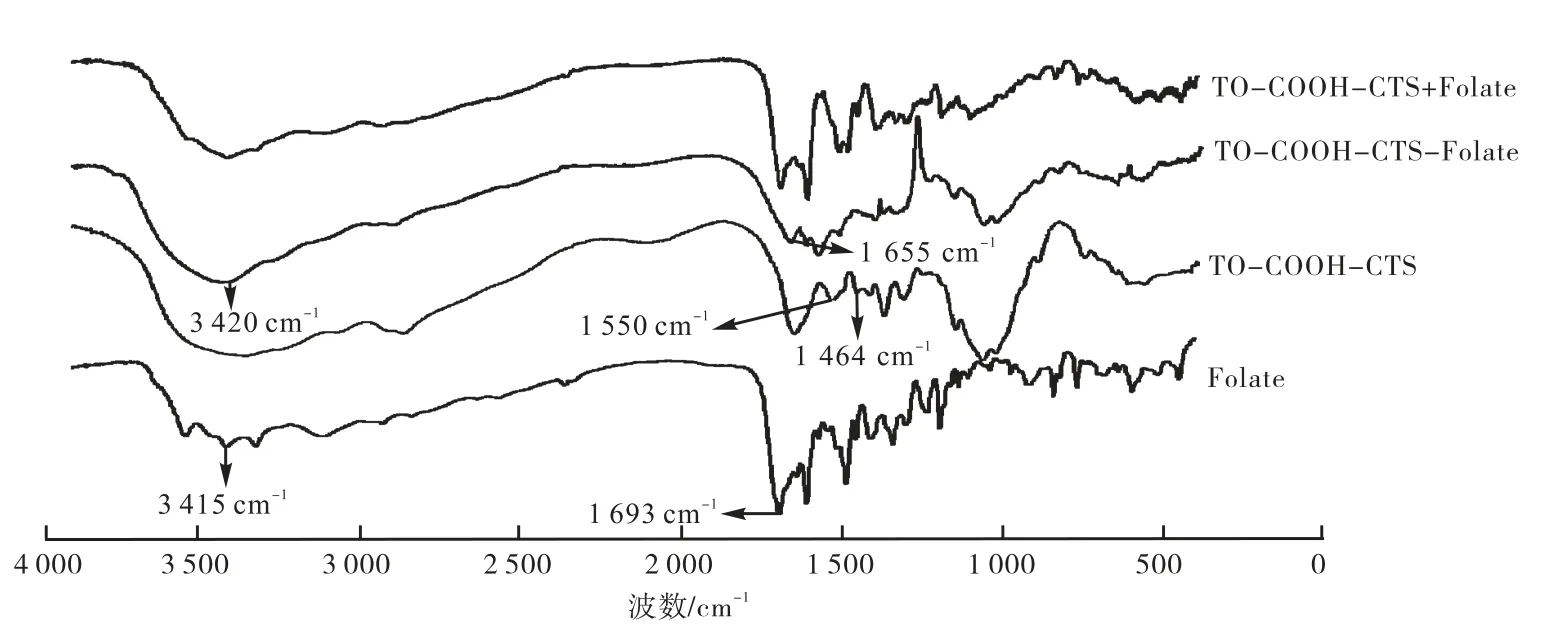
图9 TO-COOH-CTS、Folate、TO-COOH-CTS-Folate的红外光谱
由图9可知:在 TO-COOH-CTS的红外光谱曲线中,1 504,1 464,1 550 cm-1处为芳环骨架振动,1 643 cm-1为 CTS上—NH2的弯曲振动吸收峰;叶酸的红外谱图中,3 415 cm-1左右为—OH和—NH2的伸缩振动峰,1 693 cm-1为羧基中 C=O 的特征峰;在TO-COOH-CTS和叶酸的物理混合物(Folate+TOCOOH-CTS)的红外谱图中也有以上特征峰,但在叶酸偶联TO-COOH-CTS的红外谱图中,在1 655 cm-1处新出现了一个酰胺键中 C=O的特征峰;在3 420 cm-1左右的特征峰与叶酸相比有偏移现象,而且 TO-COOH-CTS-Folate中,叶酸羧基中 C=O的特征峰也消失.以上区别说明了叶酸已与 TOCOOH-CTS反应形成了复合物.
2.5 TO-COOH-CTS-Folate的差热分析
采用差热分析对TO-COOH-CTS-Folate的结构进行表征,结果如图10所示.
由图10可知:在叶酸的DTA曲线中,在130 ℃左右的小峰是脱水的吸热峰,160 ℃左右为结晶水的吸热峰,193 ℃左右出现一特征吸热峰,当温度升至423 ℃时峰形变宽,为叶酸的特征吸热峰,温度升到442 ℃左右时出现放热,峰形变高而尖;在TO-CTS的曲线中,220 ℃时出现一特征吸热峰,在276 ℃左右时出现较强的放热峰,峰形高而宽;而接枝后的产物的曲线明显不同于叶酸和TO-COOH-CTS,其在295℃左右出现放热峰,且峰形变平缓,TO-CTS放热峰在277 ℃,峰形高而宽,而且在193 ℃处叶酸的特征吸热峰消失,在385 ℃左右出现宽而低的吸热峰,叶酸的放热峰在423 ℃左右.同时,TO-COOH-CTSFolate在465 ℃左右时出现了新的吸热峰.以上区别说明了叶酸和TO-COOH-CTS不是简单的物理混合,而是叶酸已与TO-COOH-CTS反应形成了复合物.
2.6 细胞标记的研究
用 TO-COOH、TO-COOH-CTS和 TO-COOHCTS-Folate对TJ905细胞标记24 h后的照片如图11所示.
由图11可知:TO在细胞核中表现出较好的荧光性能,但细胞质中没有荧光;TO-CTS在细胞膜和细胞核中均表现出了较好的荧光性能,TO-CTS在细胞染色过程中没有对细胞产生毒性,同时修饰后的染料可透过细胞膜进入细胞内部,表现出比 TO更强的荧光现象;TO-COOH-CTS-Folate与 TO的标记情况相似,同样在细胞核中表现出较好的荧光性能,而细胞质中没有荧光.
3 结 论
TO-COOH作为噻唑橙的一种衍生物,具有独特的荧光特性,将壳聚糖引入,对 TO进行修饰设计,合成了TO-COOH-CTS,其结构经过IR、DTA确认.荧光光谱研究表明,TO-COOH-CTS与 TO-COOH相比具有明显的荧光增强效应.将叶酸接枝到 TO-COOH-CTS 上,得到了 TO-COOH-CTS-Folate,细胞荧光标记实验表明,TO及其衍生物可以穿过细胞膜进入细胞内部,表现出强的荧光现象,并在细胞生理条件下稳定存在.关于TO与CTS及细胞的多重作用关系,以及叶酸对肿瘤细胞的靶向作用的研究尚在进行中.
[1] 费学宁,刘丽娟,张宝莲,等. 荧光染料探针分子对变异细胞的识别[J]. 化学进展,2006,18(6):801-807.
[2] 辛 娟,王远亮,郭莉霞,等. 多糖的生物活性及其应用[J]. 生物医学工程研究,2004,23(3):179-182.
[3] 周永国,杨越冬,王树元,等. 天然活性多糖在生物医药领域中的研究进展[J]. 高分子通报,2006(9):16-22.
[4] 刘 颖,金 宏,程义勇. 多糖生物活性及其作用机制研究进展[J]. 中国公共卫生,2006,22(5):627-629.
[5] 黄 进,汪世龙,孙晓宇,等. 壳聚糖及其衍生物基因载体的研究进展[J]. 高分子通报,2006(1):65-69.
[6] 陈 建,左武松. 壳聚糖的应用研究综述[J]. 淮北煤炭师范学院学报,2004,25(2):42-46.
[7] 谷迎春,费学宁. 含羧基噻唑橙荧光染料的合成、修饰与光谱特性[J]. 天津城市建设学院学报,2008,14(1):45-48.
[8] KIM E M,JEONG H J,PARK I K,et al. Hepatocytetargeted nuclear imaging using 99 m Tc-galactosylated chitosan,conjugate,targeting and biodistrbution[J]. Nucl Med,2005,46(1):141-145.
[9] RYE H S,YUE S,WEMMER D E,et al. Stable fluorescent complexes of double-stranded DNA with bisintercalating asymmetric cyanine dyes:properties and applications [J]. Nucleic Acids Res,1992,20(11):2 803-2 812.
[10] Sania Mansouri,Yan Cuie,Francoise Winnik,et al.Characterization of folate-chitosan-DNA nanoparticles for genetherapy[J]. Biomaterials,2006,27(9):2 060-2 065.
[11] LEE D W,LOCKEY R,MOHAPATRA S. Folate receptor-mediated cancer cell specific gene delivery using folic acid-conjugated oligochitosans [J]. Journal of Nanoscience and Nanotechnology,2006,69:2 860-2 866.

