用于椎体造影的纤维蛋白胶基造影剂的相关研究
江 斌,周子强,陈鸿辉,李爱国,梁伟国,董 飞
(广州市红十字会医院,广东 广州 510220)
经皮椎体成形术 (Percutaneous vertebroplasty,PVP)已经广泛应用于骨质疏松压缩骨折及椎体良恶性肿瘤的治疗,并取得了良好的止痛和强化椎体的作用。该技术的常见并发症为骨水泥的渗漏,如果漏入椎管则可能造成脊髓、神经压迫的危险,漏入静脉则易导致栓塞的发生。渗漏量少的时候,通常不会出现临床症状,但一旦发生了较大量的渗漏,则危险性将大大增加,有造成瘫痪、肺栓塞及死亡的可能。因此,如何降低骨水泥渗漏的风险是学者们共同关心的问题。
纤维蛋白胶是由数种血浆蛋白成分组成的一种可降解的复合制剂,研究发现纤维蛋白胶不仅具有封闭创面、止血、促进愈合、生物黏合等多种功能,而且生物相容性好,易于被人体吸收,并可促进组织再生,已广泛用于许多外科领域。纤维蛋白胶在临床上广泛作为止血和封闭剂,理论上可以增加水溶性碘造影剂的粘滞度,从而防止造影部位过快的流空,有利于血管回流影像的观察,而且因为其性状与注射时的骨水泥近似,有利于通过椎体造影来预测注射后的骨水泥在椎体内的分布。我们拟应用纤维蛋白胶配合水溶性碘造影剂,寻找一种适合于椎体造影的造影剂,为椎体造影提供一种有利的支持。
1 材料和方法
1.1 实验材料
纤维蛋白胶由广州倍绣生物技术有限公司提供,欧乃派克(100ml/支)由上海安盛药业有限公司提供。
1.2 实验方法
1.2.1 纤维蛋白胶基造影剂的制备
欧乃派克/纤维蛋白胶复合物的制备:纤维蛋白胶包括4种成分,即浓缩的纤维蛋白原(全蛋白120mg/m l)、纤维蛋白溶解酶抑制剂(3000KIU/ml,KIU 为胰激肽蛋白原酶抑制单位Kallidinogenase Inactivator Units)、干凝血酶(500IU/ml)和氯化钙(40mmol/ml)。纤维蛋白原按体积比1∶1溶解于纤维蛋白溶解酶抑制剂为A液,凝血酶按体积比1∶1溶解于氯化钙溶液为B液,分别抽吸这两种溶液各1ml到相应的注射器以备用。
用2个5ml注射器各抽取一定量的欧乃派克液(F液)加入配制好的A液和B液中,抽吸注射器使腔内形成负压,使两种溶液充分混合后备用。
见表1。
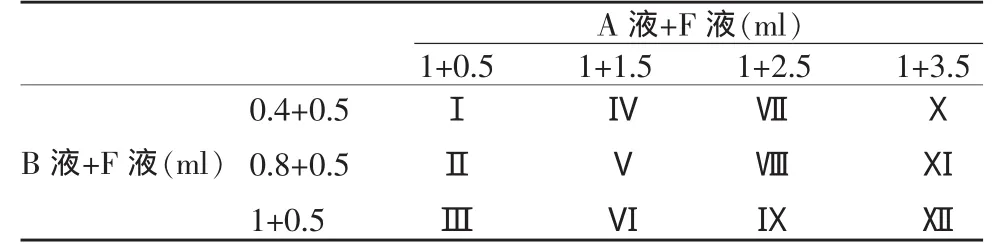
表1 以不同配比分为以下各组测试其粘度和显影性
1.2.3 X光片显影性测定
装入直径5mm、高20mm的圆柱形塑料瓶,在同一曝光条件下行X线摄片,测量其灰度值,通过Image J软件定量化其灰度值,观察显影性。
1.2.4 粘度测定
实验取粘度为4.125mPa/s的国家标准计量局标定的粘度值作为测量仪器重复性的样本。随机抽取每组3份样本试验。粘度测量严格按照流变仪(R/SSST:Brookfield,America)的操作规范及使用说明进行,测量造影剂粘度时温度控制在37.0℃,切变率范围为1~1000/s,取同一标本,分别在仪器中测定其多个切变率的粘度值。
1.2.5 急性全身毒性试验
采用健康新西兰大白兔24只(广东省动物实验中心提供),雌雄各半,体重2.3~2.5kg。动物随机分为3组:静脉实验和腹腔实验各1组,每组10只;对照组4只。将1ml的复合造影剂于无菌条件下分别注入大白兔静脉及腹腔内,对照组大白兔腹腔注射生理盐水(空白对照)。于注射后24h、48h和72h观察所有动物的一般情况、中毒表现和死亡数量,并作记录。试验组和对照组大白兔如出现中毒表现,则根据其症状程度记为无中毒、轻度中毒、明显中毒、重度中毒和死亡(表2)。根据观察结果作出评价。
1.2.6 皮内刺激试验
2) 配置连接核心交换机CS6509的端口属性Switch Port Configuration→Port Groping Parameters,设置所属的端口组为student1,启用端口聚合协议PAgP(Port Aggregation Protocol),端口模式采用desirable模式[15].
采用健康新西兰大白兔4只,雌雄各半,体重2.3~2.5kg,随机编为1~4号。实验前1d将动物背部脱毛(脱毛剂:80ml水+8g硫化钠+7g淀粉,由上海同济大学生命科学院提供)。实验动物脊柱两侧旁开2.5cm纵线上各取6个皮内注射点,每点间距3cm。一侧注射复合造影剂1ml,另一侧注射生理盐水1ml作为对照。注射后即刻和24h、48h、72h观察局部皮肤反应,并按表3所列标准进行记分,再根据记分结果推算原发刺激指数 (PII)和平均原发刺激指数(APII)。 具体方法为:PII=24h、48h 和 72h 的红斑、水肿总分/注射点总数;APII=所有动物PII总和/动物数。 0~0.4分为无刺激;0.5~1.9分为轻度刺激;2.0~4.9分为中度刺激;5.0~8.0分为强刺激。

表2 急性全身毒性试验中的动物反应程度指标

表3 皮内反应分类标准
2 结果
2.1 X光片显影性测定
标本组经X光片显影呈现出不同水平的显影性。通过Image J软件定量化不同配比实验组的灰度值,我们发现在所有的实验组中Ⅷ组的平均光密度值最接近水溶性造影剂的光密度值(图1)。

图1 不同浓度下纤维蛋白胶基造影剂X光片显影性对比。Figure 1. X-ray imaging under different concentration of fibrin glue-based contrast medium.
2.2 粘度测定
不同配比浓度的纤维蛋白胶基造影剂粘度测定见图2。实验采用美国Brookfield公司生产的R/SSST流变仪测定不同配比的纤维蛋白胶基造影剂,后经Origin软件进行分析,研究表明各实验组粘度值差距不大,实验组配比粘度值均远高于水溶性显影剂,其中在相同剪切速率下,Ⅶ组及Ⅷ组的粘度值相对较高。

2.3 急性全身毒性试验
注射后24h、48h和72h对实验动物进行观察。结果提示,所有试验组的实验动物反应良好,无运动减少、呼吸困难或腹部刺激症状,无眼睑下垂、腹泻、发绀、震颤、衰竭和体重下降等症状。术后无任何实验动物死亡。评估结果表明均无中毒反应。
2.4 皮内刺激试验
使用不同浓度纤维蛋白胶基造影剂对实验动物皮内刺激的实验结果显示,仅Ⅴ和Ⅸ组实验动物有轻微红肿反应,考虑是由于针头注射等引起的局部红肿不适,而与纤维蛋白胶基造影剂并没有明显关系(表 4)。PII<0.4、APII<0.4,提示混合材料对实验动物均无刺激反应。
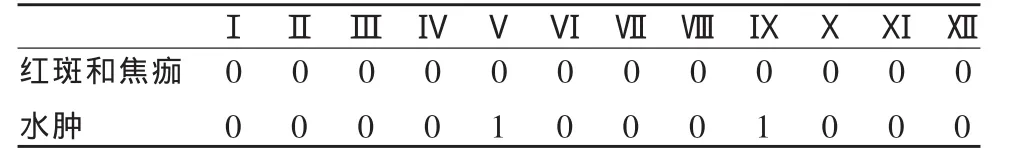
表4 不同浓度纤维蛋白胶基造影剂皮内刺激实验结果
3 讨论
PVP由于其创伤小、疗效好而被广泛应用于治疗骨质疏松骨折[1]及椎体良恶性肿瘤等[2-4]所致的椎体压缩性骨折。在椎体成形术中一般注入的填充材料以聚甲基丙烯酸甲脂(PMMA)为主,PVP中,80%~90%的病人可以通过在椎体中注射PMMA达到立即缓解疼痛的效果[8-9]。然而骨水泥在椎体成形术中泄漏率达20%~65%[8],虽然大多数情况下并没有临床症状,但骨水泥有外漏入椎管造成脊髓、神经压迫或漏入静脉导致栓塞的危险,其潜在危险极大,有造成瘫痪、肺栓塞[5]、硬膜内渗透[6]、死亡等可能。为此,如何降低骨水泥外漏风险是学者们共同关心的问题。
有学者提出在注射骨水泥前行椎体内静脉造影以预测潜在的骨水泥渗漏情况,然而该项技术的应用价值尚存在争议。Deramond等[6]认为可能出现造影剂滞留于椎体内而影响注射骨水泥的监测,一般普通的造影剂因其流体性质而排空较快,注射后迅速通过椎体内的静脉系统回流至椎体外静脉,难以通过造影剂的回流情况判断骨水泥的分布和流动趋势。因此造影剂过快的排空性不能很好的对骨水泥渗漏的风险进行一个有效的评估。
纤维蛋白胶是以纤维蛋白原及凝血酶为主要原料的医用生物材料,其通过凝血酶作用激活纤维蛋白原形成纤维蛋白凝块,除了具有止血效果外,还可以作为材料混合支架及药物缓释载体加入抗肿瘤药、生长激素、骨形成发生蛋白、消炎药、止血药等被广泛的使用。本实验应用纤维蛋白的凝胶特性与水溶性碘造影剂结合,以增强造影剂的粘滞性,应用于椎体造影时,延缓了造影剂的排空,从而更好判断和预测骨水泥分布和可能发生渗漏的情况,而且通过纤维蛋白胶对微小椎体裂隙的填充,有可能防止一部分骨水泥渗漏情况的发生。
本研究使用纤维蛋白原按体积比1∶1溶解于纤维蛋白溶解酶抑制剂,凝血酶按体积比1∶1溶解于氯化钙溶液后与不同比例的造影剂结合,分组后分别测定不同实验组的造影剂显影性和粘度值,并进行全身毒性反应和皮内注射实验。结果显示纤维蛋白胶与欧乃派克按1.8∶3的比例配合,可以在获得较高的粘滞度的情况下保持良好的显影性能,有利于通过椎体造影对骨水泥渗漏的判断,从而有助于提高PVP的疗效和安全性能。
通过实验发现,特定配比的纤维蛋白胶基造影剂具有以下优点:①价格相对便宜,材料容易获得,消毒等方面均相对容易;②粘度提高有利于动态观察造影剂在椎体内的分布形态和容量,对指导骨水泥的注射部位和体积有参考意义;③延缓其排空,更加有利于操作者的直观判断,也大大缩短了掌握椎体造影技术的学习曲线,更好的提高了疗效和安全性能。纤维蛋白胶基造影剂不仅适用于椎体成形术,同样也适用于治疗骨盆、髂骨等部位的恶性骨溶解缺损病变中骨水泥填充的经皮穿刺成形术[10]。
[1]Figueiredo N,Barra F,Moraes L,et al.Percutaneous vertebro-plasty:a comparison between the procedure using the traditional and the new side-opening cannula for osteoporotic vertebral fracture[J].Arq Neuropsiquiatr,2009,67(2):377-381.
[2]Lim BS,Chang UK,Youn SM.Clinical outcomes after percutaneous vertebroplasty for pathologic compression fractures in osteolytic metastatic spinal disease[J].J Korean Neurosurg Soc,2009,45(6):369-374.
[3]Tseng YY,Yang ST,Tu PH,et al.Minimally invasive vertebroplasty in the treatment of pain induced by spinal metastatic tumor[J].Minim Invasive Neurosurg,2008,51(5):280-284.
[4]Masala S,Anselmetti GC,Marcia S,et al.Percutaneous vertebroplasty in multiple myeloma vertebral involvement[J].J Spinal Disord Tech,2008,21(5):344-348.
[5]Krueger A,Bliemel C,Zettl R,et al.Management of pulmonary cement embolism after percutaneous vertebroplasty and kyphoplasty:a systematic review of the literature[J].Eur Spine J,2009,18(9):1257-1265.
[6]Sabuncuoglu H,Dincer D,Güclü B,et al.Intradural cement leakage:a rare complication of percutaneous vertebroplasty[J].Acta Neurochir(Wien),2008,150(8):811-815.
[7]Deramond H,Depriester C,Galibert P,et al.Percutaneous vertebroplasty with polymethylmethacrylate.Technique,indications,and results[J].Radiol Clin North Am,1998,36(3):533-546.
[8]Heini PF,Walchli B,Berlemann U.Percutaneous transpedicular vertebroplasty with PMMA:operative technique and early results.A prospective study for the treatment of osteoporotic compression fractures[J].Eur Spine J,2000,9(5):445-450.
[9]Grados F,Depriester C,Cayrolle G,et al.Long-term observations of vertebral osteoporotic fractures treated by percutaneous vertebroplasty[J].Rheumatology,2000,39(12):1410-1414.
[10]Hierholzer J,Anselmetti G,Fuchs H,et al.Percutaneous osteoplasty as a treatment for painful malignant bone lesions of the pelvis and femur[J].J Vasc Intervent Radiol,2003,14(6):773-777.

