精神分裂症和双相障碍的遗传交叠及其对精神疾病分类的影响
李 涛 王 强
精神分裂症和双相障碍的遗传交叠及其对精神疾病分类的影响
李 涛 王 强
精神分裂症和双相障碍是威胁人类健康最为严重的两类精神疾病。它们的终生致病风险都在1%左右。其病因学机制至今尚未阐明,其中遗传因素扮演了重要的角色,同时环境因素及环境因素与遗传因素的交互作用也不容忽视。自克雷丕林时代开始,由于这两种精神障碍在临床表现和预后具有各自的特点而被划分为不同的疾病单元。受这种观念的影响,一百多年来,精神分裂症和双相障碍患者在精神科临床分属于两个截然不同的诊断类别,通常被假定为具有不同病因学机制的临床表型,对精神病学的临床实践、临床基础研究以及公众对精神疾病的认识均具有深远的影响。随着对精神疾病临床症状学和遗传流行病学、病理生理学和分子遗传学研究的不断深入,不仅发现精神分裂症和双相障碍存在部分交叉的临床症状表现,而且在发病年龄、性别分布和患病率上都存在很大的相似性。值得关注的是,越来越多的证据显示精神分裂症和双相障碍存在共同的分子遗传学基础[1],传统的克雷丕林二分法受到挑战[2,3]。
1 精神分裂症和双相障碍疾病表型特征的交叠
采用遗传流行病学方法的家族聚集性研究显示:精神分裂症和双相障碍的一级亲属较正常对照患病风险都增高约7~10倍[4]。有研究证实两种精神障碍具有相似的遗传易感性[5]。精神分裂症和双相障碍家族中重型抑郁症和分裂情感性精神障碍的患病率都明显增高。来自约翰霍普金斯医院的研究显示:在双相障碍家系中,幻觉、妄想等症状存在家族聚集性—伴有精神病性症状的双相I型的亲属较不伴有精神病性症状的亲属更易出现精神病性症状;另外一方面,在精神分裂症先证者家系中存在躁狂症状和抑郁症状的家族聚集性。双生子的研究表明,精神分裂症和双相障碍都具有高达80%的遗传度。有关双生子中不一致的患病状态研究是对传统克雷丕林二分法最直接的挑战。著名的Maudzley三胞胎,一个为双相障碍患者,另外两个为精神分裂症患者[6]。Cardno等[7]的研究显示:同卵双生子一方为精神分裂症,另外一方患躁狂症的风险为8.2%;如果一方为躁狂症,另外一方患精神分裂症的风险增至13.6%;如果一方为分裂情感障碍,另外一方患精神分裂症或躁狂症的风险为26.1%。Lichtenstein等[8]新近完成了迄今为止全球最大规模的家系调查研究,对瑞士的200多万个核心家系进行分析,证实在患有精神分裂症或双相障碍的先证者中,他们的一级亲属患精神分裂症和双相障碍的风险均明显增高。
长期的随访研究发现,精神分裂症和双相障碍在临床表现上具有较高的相关性。Weiser等[9]的研究发现在后来被确诊为精神分裂症的患者中发现,27%的患者在疾病的初期被诊断为情感性精神障碍。深入研究发现抑郁症状是精神分裂症最早出现的症状之一,抑郁症状可能是遗传易感性高者向精神分裂症发展的一个预警信号或危险因素。
有关精神分裂症神经认知功能损害的研究显示,精神分裂症具有广泛的神经认知功能损害。本研究小组在对大样本的首发精神分裂症进行的研究发现,精神分裂症患者在一般精神活动、逻辑记忆、视觉再生、工作记忆,注意力和执行功能等维度都存在广泛的损害[10,11]。有研究显示双相障碍也存在广泛的神经认知功能障碍,急性期的双相障碍患者表现出同精神分裂症相同损害程度的神经认知功能障碍,即使处于稳定期,仍然存在选择性的记忆、词汇能力、注意力、精神运动速度和视觉记忆的损害。比较精神分裂症和双相障碍神经认知功能损害,发现它们的损害特征相似,但是精神分裂症患者表现的损害程度更为严重,而且这些认知维度的损害存在家族聚集性,可以作为精神分裂症和双相障碍病因学研究中的内表型。如Egan等[12]发现代表执行功能的威斯康辛卡片分类数同精神分裂症的儿茶酚胺-O-甲基转移酶的基因的功能多态性COMT108/158(Val/Met)存在关联。Tenzer等[13]的研究发现:基因DISC1/TRAX同精神分裂症患者受损的长时和短时记忆存在关联。迄今为止,有关双相障碍神经认知功能的分子遗传学研究报道较少。在双相情感中,BDNF同执行功能存在相关性。此外,COMT基因由于影响到前额叶功能(如注意功能),一些学者推测其同双相障碍的认知功能也应存在相关性。
2 分子遗传学研究提示精神分裂症和双相障碍存在遗传交叠
2.1 连锁分析
由于精神分裂症和双相障碍遗传度都高达80%以上,有关这两类疾病的分子遗传学研究一直是精神遗传学研究领域的热点。迄今为止,有关两种疾病的全基因组连锁扫描的研究在20项以上[14,15]。Badner和Gershon[16]采用合并P值的荟萃分析方法,分别纳入11篇双相障碍和18篇精神分裂症的全基因组连锁分析数据,发现位于13q和22q与双相障碍的连锁信号最强;而精神分裂症的连锁最强区域位于8p、13q和22q。两种疾病共同的连锁区域为13q和22q。此外,Segurado等[14]的荟萃分析发现与双相障碍连锁信号较强的区域为9p21-22,10q11-22,14q24-32和18p-18q21。Lewis等[15]的荟萃分析发现与精神分裂症最强的连锁区域为2p12-q22,此外还有11个区域存在较强的连锁证据。虽然这两项研究发现精神分裂症和双相障碍共同的连锁区域为8p、13q和22q,但这种连锁关系均未达到统计学的显著水平。最近McQueen等[17]的荟萃分析发现双相障碍最强的连锁区域为8q和6q。另外,我们应该注意到,这些连锁区域即使都表现为与两种精神障碍存在连锁,但是对于精神分裂症和双相障碍等复杂性遗传疾病,连锁信号代表的区域可覆盖60cM的范围,约为6 000万个碱基的染色体区域,其中包含大量的基因,因而有可能在重叠的连锁区域,与精神分裂症和双相障碍各自连锁的致病基因并不一样,这是一个需要精细定位的问题。
虽然纵向比较荟萃分析的结果没有发现精神分裂症和双相障碍存在肯定的共同连锁区域,但是单个的连锁分析提示一些染色体区域可能存在这两种疾病共同的易感基因,例如6q,13q和22q。可能的易感基因分别为痕迹氨基酸受体基因TAAR6 (6q23)、D-氨基酸氧化酶激活子基因DAOA/G30 (13q34)及COMT(22q)[3]。
2.2 关联分析
关联分析常采用候选基因法,其一是功能候选,直接将功能突变位点作为候选基因位点;其二为位置候选,将连锁区域内的基因作为候选基因进行关联分析。有时也会将两种策略结合起来运用。以往的关联分析往往注重单个基因或某个神经生物学系统的几个基因,然而随着人类基因组多样性计划(HapMap)的完成,以及基因分型技术的改进,全基因组关联分析已经在精神分裂症和双相障碍的研究中得到应用[18,19],可以预见,这类研究将为比较这两类疾病的分子遗传交叠提供更多的信息。Craddock等[2,3]对有关精神分裂症和双相障碍共同的易感基因作了以下的比较和总结(见表1)。
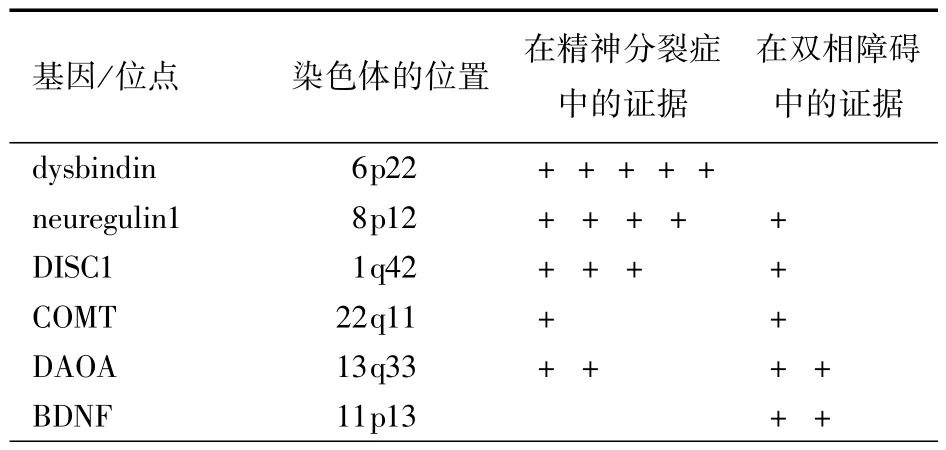
表1 精神分裂症和双相障碍共同的易感基因的评价
其中,13q33区域的DAOA/G30被7个不同样本的研究证实同精神分裂症关联,包括来自中国人群的研究,另有一个阴性的报道结果。4个不同的样本发现该基因同双相障碍关联,一项来自德国人样本的研究证实,有偏执妄想症状的双相障碍同该基因存在关联,其结果被1个来自波兰的样本重复。位于8p12的NRG1基因被10项研究支持是精神分裂症的候选基因,另外有4个研究为阴性结果,但没有发现特异性的突变位点。1项大样本的病例对照研究发现,该基因与伴有不协调精神病性症状的双相障碍关联;该研究同时发现具有躁狂发作史的精神分裂症与该基因存在关联。有10项研究支持DTNBP1(dysbindin)基因是精神分裂症的候选基因,同时发现伴有精神病性症状双相障碍的快速循环型同该基因存在关联;另有研究结果为阴性。DSIC1基因同精神分裂症存在强的关联,同时也有证据显示该基因与双相障碍有一定的相关性,但是,越来越多证据显示这种关联更有可能是由于染色体(1;11)易位造成的,因此,应该对没有易位的样本和与之连锁的基因进行深入的研究方可论证该基因与精神分裂症和双相障碍的关系[2,3]。
正如在连锁分析中的发现一样,22q12区域可能含有精神分裂症和双相障碍的易感基因,位于该区域的COMT也被众多研究证实在精神分裂症和双相障碍的发病中扮演重要的角色。1项大样本的双相障碍病例对照研究发现由11个SNPs构成的一种单倍型同双相障碍关联,该单倍型骑跨基因HMG2L1和TOM1。引起对该研究结果重视的原因是基因HMG2L1的产物与精神分裂症和双相障碍的病理生理相关的信号传导通路具有交互作用,锂盐是这个通路中关键酶(GSK3β)的抑制剂[20]。氯氮平和氟哌啶醇对GSK3β也具有抑制作用。
近年来有关精神分裂症和双相障碍的全基因组关联研究(genome-wide association studies,GWAS)为精神分裂症和双相障碍可能具有共享遗传基础提供了进一步的证据。国际上几个独立的研究小组先后报道了位于2号染色体上(2q32.1)的锌指蛋白804 A基因(zinc finger protein 804A,ZNF804A)和位于12号染色体上(12p13.3)的L型钙通道1c亚单位基因(1c-subunit of the L-type calcium channel,CACNA1C)与精神分裂症、双相障碍以及抑郁症均存在关联[21]。研究提示,多个具有微小作用的基因多态位点的共同作用不仅增加了精神分裂症的遗传易感性,也影响了双相障碍的易感性。
3 精神分裂症和双相障碍是在病因学上互有联系又各有特点的临床综合症
以上讨论了精神分裂症和双相障碍的临床表型和分子遗传病因等方面的相似之处,但不可否认的是,研究证据也支持二者在病因学上存在区别,如精神分裂症和双相障碍无论是在神经认知功能损害的表现,或是在分子遗传学的共性特征,主要体现在伴有精神病性症状的双相障碍与精神分裂症组之间,或者是双相障碍与伴有情感症状的精神分裂症组之间,在此之外的分子遗传重叠性则有所降低。精神分裂症比双相障碍有更严重的脑结构和神经心理学的异常,精神分裂症的病前儿童常常有神经认知功能和神经运动的损害,双相障碍则不然。此外,产科并发症是精神分裂症的高危因素,但双相障碍患者未见明显的产科并发症。围产期的并发症被认为导致杏仁核和海马的缩小,这种改变常见于精神分裂症,家族易感性与这些结构的变化也有关系。
有鉴于此,精神分裂症和双相障碍可能存在共同的遗传易感基因,但是各自也存在不同的特异性危险因素:共享的基因决定了个体发展为精神障碍的易感性,然而一些影响神经发育的基因和/或环境(如围产期的并发症、冬天/春天出生和出生在城市等)的作用和/或相互作用,使个体更易发展为精神分裂症。由此推测,由于神经发育缺陷不明显,双相障碍的症状显得相对单纯。在两种精神障碍发生后,共同的病因学构成了脑结构的改变、神经认知功能和社会功能障碍的基础。此外,尽管家系研究提示精神分裂症和双相障碍在遗传易感性上存在大量的交叉重叠,但同一研究也发现二者还存在非共享的遗传危险因素[8]。这一结果也被一些早期的研究所证实,构成了它们在临床表现、神经认知功能和脑结构和功能等损害程度不同的生物学基础。近年来的研究提示,二种疾病之间的这种非共享的遗传危险因素可能与个体基因组结构的变化有关,如基因组拷贝数变化(copy number variation,CNV)。研究发现,CNV对精神分裂症的影响远高于对双相障碍的作用;较大的基因组结构改变如基因组DNA的大块缺失更容易引起脑发育的异常,这些发现与精神分裂症的神经发育假说不谋而合。
4 未来的挑战
医学研究应以病人的需要和利益为前提,而临床诊断分类学研究则重在根据疾病潜在的生物学机制进行疾病分类,并可以据此优化治疗方案并进行有效的预后评估。一个多世纪以来,传统精神病学固守于以临床经验为基础的非生物医学模式而严重阻碍了学科的发展。可喜的是,进入21世纪的精神病学与时俱进,结合疾病的生物疾病模式和潜在的生物学机制研究,正在走向一个前所未有的快速发展时期。
基因的特异性作用可以表现在对疾病的不同临床症状维度或程度的影响,但目前对精神病理学症状维度或症候群的识别和评定多为主观经验性而非客观实验性。毋庸质疑,精神疾病临床表型的分类以及更科学的精神疾病分类系统将从根本上得益于对疾病生物病因学研究包括遗传学研究的进展。当然,对精神疾病临床表型与基因型之间的关系剖析,需要多个研究领域(包括遗传学、精神病理学、认知科学和神经科学等)的协作,并采用系统生物学的研究方法予以整合;需要从发展的角度考虑社会变迁和其他有关的环境变量对疾病表型的影响,前瞻性的研究尤为重要。
新一代诊断标准DSM-V和ICD-11的制定正在紧锣密鼓的进行中。从目前颁布的DSM-V草案来看,尽管工作组提出了供讨论用的、在现有疾病分类之外的、基于症状维度评定(dimensional assessments)的重要性和参考标准,精神分裂症和双相障碍仍将分属于两个相对独立的疾病单元;在临床实践中如何对精神疾病采用维度测量,以对核心精神病理学表型予以客观评定的方式、方法仍在讨论之中,传统的二分法从权威的分类系统中退出尚需经历一个更长的转变时期。尽管如此,随着现代神经科学的发展,21世纪的精神病学进入名副其实的生物-心理-社会医学模式的新时代指日可待。
1 Bramon E and P C Sham.The common genetic liability between schizophrenia and bipolar disorder:a review.Curr Psychiatry Rep,2001,3(4):332-337.
2 Craddock N,MC O'Donovan,MJ Owen.Genes for schizophrenia and bipolar disorder?implications for psychiatric nosology.Schizophr Bull,2006,32(1):9-16.
3 Craddock N,MC OˊDonovan,MJ Owen.The genetics of schizophrenia and bipolar disorder:dissecting psychosis.J Med Genet,2005,42(3):193-204.
4 Potash JB.Carving chaos:genetics and the classification of mood and psychotic syndromes.Harv Rev Psychiatry,2006,14(2):47-63.
5 Potash JB,Willour VL,Chiu YF,et al.The familial aggregation of psychotic symptoms in bipolar disorder pedigrees.Am J Psychiatry,2001,158(8):1258-1264.
6 McGuffin P,A Reveley,A Holland.Identical triplets:non-identical psychosis?Br J Psychiatry,1982,140:1-6.
7 Cardno AG,Rijsdijk FV,Sham PC,et al.A twin study of genetic relationships between psychotic symptoms.Am J Psychiatry,2002,159(4):539-545.
8 Lichtenstein P,Yip BH,Björk C,et al.Common genetic determinants of schizophrenia and bipolar disorder in Swedish families:a population-based study.Lancet,2009,373:234-239.
9 Maier W,A Zobel,M Wagner.Schizophrenia and bipolar disorder:differences and overlaps.Curr Opin Psychiatry,2006,19(2):165-170.
10 Wang Q,Chan R,Sun J,et al.Reaction time of the continuous performance test is an endophenotypic marker for schizophrenia:a study of first-episode neuroleptic-naive schizophrenia,their non -psychotic first-degree relatives and healthy population controls. Schizophr Res,2007,89(1-3):293-298.
11 Ma X,Wang Q,Sham PC,et al.Neurocognitive deficits in firstepisode schizophrenic patients and their first-degree relatives.Am J Med Genet B Neuropsychiatr Genet,2007,144(4):407-416.
12 Egan,MF,Goldberg TE,Kolachana BS,et al.Effect of COMT Val108/158 Met genotype on frontal lobe function and risk for schizophrenia.Proc Natl Acad Sci USA,2001,98(12):6917-6922.
13 Cannon TD,Hennah W,van Erp TG,et al.Association of DISC1/ TRAX haplotypes with schizophrenia,reduced prefrontal gray matter,and impaired short-and long-term memory.Arch Gen Psychiatry,2005,62(11):1205-1213.
14 Segurado R,Detera-Wadleigh SD,Levinson DF,et al.Genome scan meta-analysis of schizophrenia and bipolar disorder,part III:bipolar disorder.Am J Hum Genet,2003,73(1):49-62.
15 Lewis CM,Levinson DF,Wise LH,et al.Genome scan meta-analysis of schizophrenia and bipolar disorder,part II:schizophrenia.Am J Hum Genet,2003,73(1):34-48.
16 Badner JA and ES Gershon.Meta-analysis of whole-genome linkage scans of bipolar disorder and schizophrenia.Mol Psychiatry,2002,7(4):405-411.
17 McQueen MB,Devlin B,Faraone SV,et al.Combined analysis from eleven linkage studies of bipolar disorder provides strong evidence of susceptibility loci on chromosomes 6q and 8q.Am J Hum Genet,2005,77(4):582-595.
18 Baum AE,Akula N,Cabanero M,et al.A genome-wide association study implicates diacylglycerol kinase eta(DGKH)and several other genes in the etiology of bipolar disorder.Mol Psychiatry,2008,13(2):197-207.
19 Lencz T,Morgan TV,Athanasiou M,et al.Converging evidence for a pseudoautosomal cytokine receptor gene locus in schizophrenia. Mol Psychiatry,2007,12(6):572-580.
20 Potash JB,Buervenich S,Cox NJ,et al.Gene-based SNP mapping of a psychotic bipolar affective disorder linkage region on 22q12.3:association with HMG2L1 and TOM1.Am J Med Genet B Neuropsychiatr Genet,2008,147B(1):59-67.
21 Ferreira MA,O'Donovan MC,Meng YA,et al.Collaborative genome -wide association analysis supports a role for ANK3 and CACNA1C in bipolar disorder.Nature Genetics,2008,40(9):1056-1058.
2010-01-11)
(本文编辑:武春艳)
四川大学华西医院心理卫生中心 610041。电子信箱xuntao26@hotmail.com

