壳聚糖/β-磷酸三钙支架复合骨形态发生蛋白后成骨效能研究
赖仁发 赵清桐 刘湘宁 沈山
(暨南大学附属第一医院 口腔颌面外科,广东 广州 510632)
可注射型组织工程骨是利用初始状态为液态的生物材料加入种子细胞或生长因子复合后,动态下注射入体内骨缺损处,逐步固化,形成固态或凝胶的组织工程骨,以修复各类骨缺损[1-2]。本研究所选用的壳聚糖(chitosan,CS)/β-磷酸三钙(β-tricalcium phosphate,β-TCP)初期凝胶状结构非常利于血管的长入和骨组织再生,易于塑形,并能够很好地复合种子细胞或生长因子,发挥其缓释作用,凝固后具有一定的生物力学强度,其降解速度较为缓慢,材料在完成支持结构功能后能完全降解吸收,适应了微创外科技术发展的要求,具有组织损伤小、操作简便等优点。骨形态发生蛋白是在骨基质中存在的一种骨诱导活性蛋白,以其高效成骨活性而获公认[3-4]。本研究将CS/β-TCP与重组人骨形态发生蛋白(recombinant human bone morphogenetic protein,rhBMP)-2复合,在流动状态下注射进兔下颌骨缺损模型中,观察骨缺损修复情况,以期为临床开发一种较为理想的可注射性骨替代材料提供实验依据。
1 材料和方法
1.1 材料和设备
液相CS溶液(脱乙酰度为93%,相对分子质量为942 000)、固相β-TCP粉末(钙磷比1.50,直径50μm)(暨南大学理工学院材料与工程系提供),rhBMP-2(暨南大学生物医学工程研究所研制)。将CS 0.3mL、β-TCP 2.2 g和rhBMP-2 0.5mg各12份独立包装,用照射剂量为2Gy的γ射线照射消毒之后备用。
24只成年新西兰大白兔(广东省实验动物中心提供),雌雄不限,选自同一批次,体重约2.0 kg,同一环境下饲养。
XU850数码照相机(佳能公司,日本),X线牙片机(Trophy Trex公司,日本),Quin Plus荧光显微镜、SP1600硬组织切片机(Leica公司,德国),Lunar Prodigy骨密度仪(GE公司,美国),荧光染料(Sigma公司,美国)。
1.2 方法
模型建立:用30 g·L-1戊巴比妥钠0.03 g·kg-1沿兔耳缘静脉注射,全身麻醉,正中联合后1.5 cm沿下颌骨走行做2.0 cm长弧形切口,在下颌骨下缘手术区肌层和骨膜下注射含肾上腺素的利多卡因2mL行浸润麻醉。切开双侧下颌骨下缘皮肤、皮下组织、肌肉和骨膜,用齿科低速慢钻在双侧下颌骨体部形成15mm×6mm的全层缺损,保留下颌骨下缘,术中用生理盐水降温。
1.3 分组
将24只实验动物随机均分为4组,每组6只:实验组1,植入CS/β-TCP/rhBMP-2;实验组2,植入CS/β-TCP;对照组1,植入髂嵴处的自体骨;对照组2,不植入任何材料。术后创口用1号丝线进行缝合,并分笼饲养。术后3 d肌注庆大霉素,每次4万单位,每天2次。手术伤口不需要拆线,任其自然脱落。
1.4 组织标本观察
术后2、4、8周,通过空气栓塞法分批处死实验白兔,每组每批2只。流水冷却条件下,在原骨缺损以外4mm范围内截取整块骨标本,置入10%甲醛溶液固定48 h。取术后2、4周的全部实验动物和术后8周的一半实验动物做常规脱钙、石蜡包埋,制成厚3μm的切片,苏木精-伊红(hematoxylineosin,HE)染色后于50倍光学显微镜下观察植入物与周围骨组织的结合、新生骨基质的生成和钙化、血管和纤维组织、炎症细胞浸润、支架材料的降解吸收及其他异常情况。将每个蜡块标本间隔一定距离作连续纵向切片5片,HE染色后置于显微镜下观察,每张切片取上、下、左、右、中5个视野,使用Leica DMRA2图像分析软件测量新生骨组织占测量框架的面积百分比[5],5个视野新生骨组织面积百分比的平均值记为每张切片的新生骨面积比,再取5张切片的百分比值的平均值代表该组织块的新生骨面积比。
1.5 活体荧光标记
术后4周标记Tetracyclin(Tc,黄色,25mg·kg-1),处死动物之前2 d标记Alizarin-complen(AE,红色,30mg·kg-1),均注射于兔颈部皮下。术后8周,每组取另一半实验动物做不脱钙切片,乙醇逐级脱水、脱脂,甲基丙烯酸甲脂包埋,切片厚度100μm,表面磨至光滑,置于荧光显微镜下观察新生骨面积[6]。
1.6 骨密度测量
分别取术后2、4、8周各组的骨标本,40 g·L-1甲醛磷酸缓冲液固定后,骨密度仪检测骨缺损修复区骨矿盐含量,以此探明成骨的质量和成骨速度。
1.7 数据统计
所测数据在SPSS 14.0进行析因设计的方差分析,α=0.05。
2 结果
2.1 术后大体观察
各组实验兔手术后当天不活跃,进食量少,粪便少;第2天创口红肿明显,但创面干燥,缝线尚在;第3天以后,肿胀渐消,活跃程度、进食及排便基本正常。所有创口均Ⅰ期愈合,实验动物全部进入结果分析。
2.2 HE染色观察
实验组1:术后2周骨修复区有局灶性骨组织形成,见新形成的骨基质,成骨细胞环绕、聚集,细胞增生活跃;术后4周新生骨组织明显,骨组织所占的面积增大,骨基质钙化比例上升,可见骨小梁结构及大量成纤维细胞样细胞与小血管;术后8周可见成熟的骨小梁,内部陷窝中有成纤维细胞样细胞分布,材料降解吸收明显(图1A)。实验组2:术后2周可见少量的骨基质形成,细胞成分多,胶原纤维丰富,可见较大片材料脱钙后的残余物,材料占据区域周缘未见明显炎症细胞浸润,可见成骨细胞环绕;术后4周缺损中央区的局灶性成骨、骨小梁样结构较少,材料部分降解,其周围可见成骨细胞环绕,多核巨细胞吞噬材料颗粒现象较2周多;术后8周在近缺损壁处,可见小梁状新骨。在缺损中央区,有局灶性骨组织形成,可见形成的骨基质。材料占据区,材料已有部分降解吸收(图1B)。
对照组1:术后8周可见成熟骨小梁连接成片,细胞成分相对减少,新生血管增多(图1C)。
对照组2:术后8周时近缺损壁处新生骨小梁较少;缺损中央区,局灶性骨组织形成较少,可见大量成纤维细胞样细胞(图1D)。

不同组间骨形成面积存在显著差异(P=0.000),实验组2(均数10.73%)与对照组2(均数10.35%)无明显差异;实验组1(均数22.96%)与对照组1间(均数22.63%)也无显著差异,且两组均优于实验组2与对照组2,新骨形成效果最佳。不同观察时间之间存在显著差异(P=0.000),随着观察时间的延长,成骨面积比例也随之增高(表1)。
表1 各组不同时间点骨形成面积百分比(%,±s)Tab 1 The area percentage of bone regeneration of each group at different time point(%,±s)

表1 各组不同时间点骨形成面积百分比(%,±s)Tab 1 The area percentage of bone regeneration of each group at different time point(%,±s)
组别 术后2周 术后4周 术后8周实验组1 13.18±2.99 19.95±4.58 35.75±4.37实验组2 4.55±1.10 5.78±0.65 20.08±2.96对照组1 13.05±3.15 21.03±2.85 33.80±7.08对照组2 4.18±1.22 7.53±0.88 19.35±2.33
2.3 荧光标记图像观察
对术后8周的硬组织标本进行荧光观察显示,实验组1的黄色荧光标记面积大,红色荧光面积很小,可见骨小梁结构;而实验组2在近缺损壁处,可见小梁状新骨,黄色和红色荧光标记面积范围均较少(图2)。

2.4 骨密度值测量
不同时间点的骨密度值测量结果见表2。骨密度值从大到小依次为对照组1、实验组1、实验组2、对照组2。实验组1术后各时间点的骨密度值明显优于实验组2和对照组2,且与对照组1间无明显差异。不同观测时间之间也存在有显著性差异,随着观察时间的延长,骨密度也随之增高。
表2 不同时间点各组的骨密度值(g·cm-2,±s)Tab 2 Bone density value of each group at different time point(g·cm-2,±s)
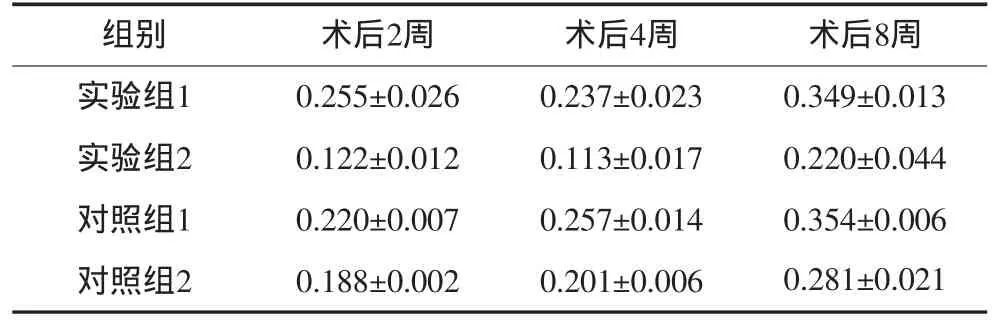
表2 不同时间点各组的骨密度值(g·cm-2,±s)Tab 2 Bone density value of each group at different time point(g·cm-2,±s)
组别 术后2周 术后4周 术后8周实验组1 0.255±0.026 0.237±0.023 0.349±0.013实验组2 0.122±0.012 0.113±0.017 0.220±0.044对照组1 0.220±0.007 0.257±0.014 0.354±0.006对照组2 0.188±0.002 0.201±0.006 0.281±0.021
3 讨论
随着组织工程学的兴起,利用组织工程的方法体外构建人工骨以修复骨缺损成为研究的一个热点[7]。传统固态组织工程骨难于满足口腔颌面部不规则骨缺损的修复。随着微创伤外科技术的发展,研制和应用可注射性骨替代材料己成为一个重要的努力方向。注射方法具有损伤小、易操作、适应证广等优点,具有广阔的临床应用前景[8-9]。
低温相TCP的化学性质近似于羟磷灰石,钙磷比近似为1.5,含有CaO和P2O52种成分的磷酸钙陶瓷是构成人体硬组织的重要无机物质,植入人体后,其表面同人体组织可达到键的结合,达到完全亲和。β-TCP在水溶液中的溶解度较羟磷灰石大,能缓慢被体液吸收。除此,β-TCP的降解能为新骨的形成提供更丰富的Ca、P,在体内可通过新陈代谢途径促进新骨组织的生成,通过自身降解逐步被新生骨组织置换。本实验将固态的β-TCP和液态的CS共同作为rhBMP-2的复合载体,制成可注射人工骨。利用CS降解快的特性,复合材料的孔隙率逐渐提高,以加速新骨的长入。其抗压强度达到骨松质的抗压强度。β-TCP可作rhBMP-2支架的原因为:单纯的壳聚糖为酸性,pH值为3.0,骨形态发生蛋白在酸性条件下稳定,当pH>8.5时则易丧失活性[3],按0.3mL CS和2.2 gβ-TCP比例混和5min后,pH值为6.5左右,经检测rhBMP-2活性良好,凝固过程中基本不产热,温度在室温和人体正常温度之间,不会产生过高的热量导致rhBMP-2活性丧失;故复合rhBMP-2的时间选择在材料混和5min后加入充分混匀;在室温条件下,0.3mL CS和2.2 gβ-TCP比例混和后由液体到凝固时间约为20min,能够满足可注射组织工程骨支架的术中操作时间;凝固成型后为多孔网状结构,有一定的细胞生长空间,利于骨组织再生。
骨组织的生长、改建和钙化的研究方法很多,除常规的HE染色、X线观察、骨密度测量等检测方法外,荧光标记法也可以提示钙化过程的开始,并确认新骨的形成,并且方法简单,标记可靠。自1970年Olerud等[10]首创3色荧光标记法以来,此法已在骨研究中得到广泛的应用。在本实验中,通过对实验组1和实验组2不同时期荧光标记的观察进行比较发现,骨荧光标记出现了明显的差别,表明新骨的形成受到了影响。实验组1中的部分骨小梁黄色荧光标记面积比实验组2中的大,表明术后4周在rhBMP-2诱导下新骨的形成比较快。2组的红色荧光标记面积都很小则表明术后8周时骨组织已趋向成熟,新骨的形成较慢。这也从另一个角度表明,rhBMP-2对颌骨发育存在一定的影响。
[1]Gauthier O,Bou ler JM,Weiss P,et al.Kinetic study of bone ingrowth and ceramic resorption associated with the implantation of different injectable calcium-phosphate bone substitutes[J].J Biomed Mater Res,1999,47(1):28-35.
[2]Gauthier O,Boix D,Grimandi G,et al.A new injectable calcium phosphate biomaterial for immediate bone filling of extraction sockets:A preliminary study in dogs[J].J Periodontol,1999,70(4):375-383.
[3]Urist MR.Bone:Formation by autoinduction[J].Science,1965,150(698):893-899.
[4]Urist MR,Mikulski A,Lietze A.Solubilized and insolubilized bone morphogenetic protein[J].Proc Natl Acad Sci U S A,1979,76(4):1828-1832.
[5]Ebbesen EN,Thomsen JS,Mosekilde L.Nondestructive determination of iliac crest cancellous bone strength by pQCT[J].Bone,1997,21(6):535-540.
[6]祝颂松,李继华,胡静,等.下颌骨牵张成骨过程中新骨生成的定量组织学观察[J].上海口腔医学,2005,14(4):382-386.ZHU Song-song,LI Ji-hua,HU Jing,et al.Quantitative histomorphometric observation of distraction osteogenesis during mandibular lengthening[J].Shanghai J Stomatol,2005,14(4):382-386.
[7]裴国献,金丹.骨组织工程研究进展[J].中华创伤骨科杂志,2004,6(l):38-42.PEI Guo-xian,JIN Dan.Advances in tissue engineering of bone[J].Chin JOrthop Trauma,2004,6(l):38-42.
[8]Yamada Y,Ueda M,Naiki T,et al.Tissue-engineered injectable bone regeneration for osseointegrated dental implants[J].Clin Oral Implants Res,2004,15(5):589-597.
[9]Park DJ,Choi BH,Zhu SJ,et al.Injectable bone using chitosan-alginate gel/mesenchymal stem cells/BMP-2 composites[J].J Craniomaxillofac Surg,2005,33(1):50-54.
[10]Olerud S,Lorenzi GL.Triple fluorochrome labeling in bone formation and bone resorption[J].J Bone Joint Surg Am,1970,52(2):274-278.

