α-干扰素对脐血来源的树突状细胞分化成熟及功能影响的体外研究
李来元 ,杜 智 ,朱争艳 ,吴尘轩 ,高英堂 ,王 鹏 ,白 同 ,姚 晨
(1.天津医科大学研究生院,天津300070;2.天津市第三中心医院,天津市人工细胞重点实验室)
树突状细胞(dendritic cells,DC)是体内功能最强大的专职抗原提呈细胞之一,其主要功能是摄取、加工处理和提呈抗原,刺激初始T细胞活化,从而启动特异性免疫应答,在T淋巴细胞和肿瘤细胞的相互作用中起桥梁作用。大量资料显示,在诱导DC成熟过程中通过添加不同细胞因子可增强其抗肿瘤免疫应答的能力,因此,DC成熟与否对其功能的发挥至关重要。Randvanyi等[1]报道低浓度(10~100 U/ml)α-干扰素 (IFN-α)能促进外周血单核细胞来源的DC成熟,IFN-α可能通过调节DC的功能来调节DC的免疫反应。为进一步探讨高浓度 (500 U/ml)IFN-α对DC成熟的影响,笔者在常规培养条件中加入不同剂量的IFN-α,以观察IFN-α对DC表型和功能的影响,为临床应用DC进行细胞免疫治疗提供一定的理论基础。
1 材料与方法
1.1 材料 正常足月剖宫产新生儿脐血10份由天津市第三中心医院产科提供;IFN-α(Biolegend LTD);rhIL-4、rhGM-CSF、TNF-α (Pepro Tech EC LTD);PE anti-HLA-DR、FITC anti-CD 1a、FITC anti-CD 83、FITC anti-CD 86、PE anti-CD 14、FITC anti-CD 40 (BD Biosciences LTD);丝裂霉素(协和发酵株式会社);IL-12、IFN-γ、IL-10 ELISA 试剂盒(ANTIBODYSHOP LTD);T 细 胞 尼 龙 毛 柱 (GIBCO LTD);Epics Altra 流式细胞仪 (BECKMAN COULTER LTD);全自动酶标仪 Model-353(Fortune Labsystems LTD)。
1.2 方法
1.2.1 脐血DC的体外诱导 取新鲜抗凝脐血50ml,用HES液自然沉降法分离单个核细胞,以PRMI-1640完全培养液悬浮细胞,计数并调整细胞浓度为2×106个/ml。将单个核细胞接种于6孔培养板(2 ml/孔),分 A、B、C 3 组,每组 2 孔,置于 37℃、5%CO2培养箱中孵育2 h后,收集悬浮的非贴壁细胞备用。贴壁的单核细胞加入1000 U/ml rhGM-CSF、500 U/ml rhIL-4和INF-α诱导培养,其中A组IFN-α 0 U/ml、B 组 IFN-α100 U/ml、C 组 IFN-α 500 U/ml; 第 3 天全量换液,第5天各组加入20 U/ml TNF-α。培养第7天收获成熟DC备用,而上清液用于IL-12、IFN-γ和IL-10的ELISA检测。
1.2.2 DC的形态观察及流式细胞仪检测 每日倒置显微镜下观察DC诱导过程中细胞形态及增殖情况,透射电镜观察DC超微结构并摄片。于培养第7天将每组其中一孔细胞浓度调到1×105个/ml,流式细胞仪检测细胞表型 HLA-DR、CD1a、CD14、CD40、CD83、CD86的表达率。
1.2.3 诱导成熟DC对同种异体T细胞增殖的影响收集1.2.1中非贴壁的单个核细胞,尼龙毛柱法纯化未致敏的初始型T淋巴细胞,以含1000 U/ml IL-2、10%FBS的PRMI-1640培养。将诱导成熟的DC用50 μg/ml丝裂霉素处理30 min,然后与T淋巴细胞按 1∶10、1∶50、1∶100 的比例加入 96 孔板共同培养72 h。于培养结束前4 h每孔加入20 μl MTT(l5 mg/ml),继续孵育 4 h后加入酸性异丙醇(含0.04 mol/L盐酸)100 μl/孔, 用酶标仪读取波长570 nm的吸光度OD(A)值,结果取3孔平均值。
1.3 统计学处理 所有统计分析应用SPSS13.0软件进行处理。计量资料以±s表示,计数资料以百分率(%)表示,两均数比较采用t检验,几个均数比较采用单因素F检验,S-N-K检验对数据进一步两两比较,P<0.05时具有统计学意义。
2 结果
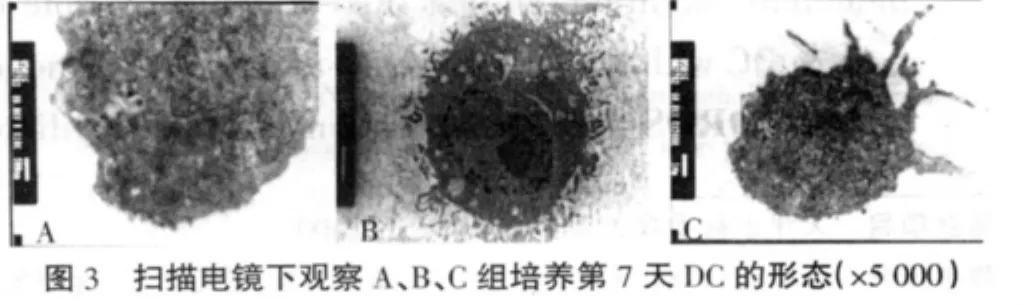
2.1 脐血DC的形态学观察 倒置显微镜下观察,培养第5天时各组细胞大部分呈悬浮生长,细胞体积增大,B、C组细胞表面有少量树枝状突起,A组细胞未见突起(图1);第7天时B、C组细胞体积进一步增大,细胞表面有明显树枝状突起,呈现典型的树突状细胞形态,以C组形态变化更明显(图2);第7天扫描电镜下可见脐血来源DC胞体突起形成不规则状,细胞表面粗糙,层叠状皱襞明显可见,胞浆丰富,核大不规则,核质丰富(图3)。
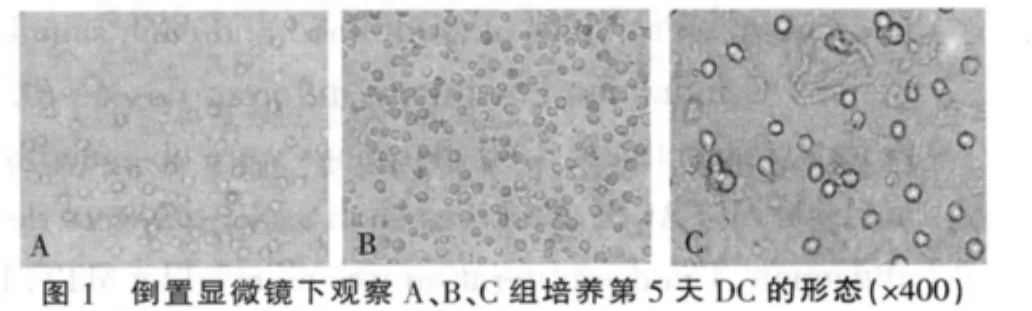

2.2 流式细胞仪检测DC的表面标志 如表1所示,DC 表面成熟标志 HLA-DR、CD1a、CD83、CD86和CD40等的表达在B、C组较 A组有显著增高(P<0.05),HLA-DR、CD1a、CD83、CD86 等的表达在C组又显著高于B组(P<0.05);同时,DC不成熟标志CD14的表达正好相反,在A组中高于B、C组(P<0.05)。
2.3 DC分泌细胞因子的观察 收集A组、B组、C组DC培养7 d的上清液,用ELISA法测定IL-12、IFN-γ和IL-10的含量,结果表明C组DC分泌的IL-12、IFN-γ 高于 A、B 组(P<0.05);而 IL-10 的表达低于 A、B 组(P<0.05),见表 2。
表1 不同浓度IFN-α对脐血培养第7天DC表面标志物表达的影响(%,±s)

表1 不同浓度IFN-α对脐血培养第7天DC表面标志物表达的影响(%,±s)
与A组比较▲P<0.05;与B组比较#P<0.05
CD1a 20.09±1.86#32.02±3.22▲37.95±1.91▲#CD8348.48±2.3053.01±2.7672.08±3.46▲#HLA-DR 78.14±1.7982.56±1.69▲89.36±2.37▲#CD1437.68±1.8831.64±2.38▲28.25±1.55▲#CD4023.00±1.9226.76±5.5830.06±2.59▲CD8676.40±1.9786.83±5.80▲96.10±1.10▲#组别ABC
表2 不同浓度rhIFN-α对脐血培养细胞第7天上清液细胞因子的影响(±s)

表2 不同浓度rhIFN-α对脐血培养细胞第7天上清液细胞因子的影响(±s)
与A组比较▲P<0.05;与B组比较#P<0.05
组别IL-12(pg)IFN-γ(pg)IL-10(pg)A25.18±1.6241.80±1.24#39.49±1.73 B28.91±1.72▲42.49±1.0337.53±0.53▲C33.09±1.76▲#44.65±1.17▲#35.58±0.96▲#
2.4 MTT法检测DC刺激T细胞的增殖能力 收集A组、B组、C组培养7 d的悬浮细胞,进行同种异体T淋巴细胞混合反应,结果如图3,B组和C组DC刺激T淋巴细胞增殖的能力显著高于A组(P<0.05);C 组又显著高于 B 组(P<0.05)。

3 讨论
IFN-α广泛用于治疗恶性肿瘤、病毒性和免疫性疾病。目前研究提示,IFN-α能促进人外周血单个核细胞向DC分化和成熟,且能通过外周血单个核细胞诱导的 DC高表达 HLA-DR、CD80、CD86和CD54[2-5];进一步能诱导机体产生获得性免疫,提高DC的成熟度可诱导产生高效细胞毒性T细胞[6-9]。因此深入探讨IFN-α对DC分化成熟及功能的影响,将有助于DC在细胞免疫治疗方面发挥更大的临床作用。
笔者应用IFN-α联合经典培养DC的细胞因子(rhGM–CSF/rh IL-4/TNF-α)诱导培养脐血单个核细胞生成DC,分别选择INF-α的最高临床血清浓度100 U/ml(B组)和超过临床血清浓度的大剂量500 U/ml(C组)作为实验组观察INF-α在DC培养中的作用。动态观察发现:B、C组在培养第5天即诱导出DC样细胞;7 d时流式细胞仪分析表明:B、C组DC的CD86(对同种异体T淋巴细胞增殖最重要的分子)表达较A组DC显著增高,B、C组的单核细胞特异性表面标志CD14较A组减少;混合淋巴细胞反应实验发现:B、C组DC刺激同种异体T淋巴细胞增殖的能力较A组增强。说明上述两种浓度的IFN-α均可以促进DC成熟和功能的增强。我们的结果与 Luft等[2]、Daucr等[5]和 Tamir等[10]研究结果一致,Luft等[2]和 Tamir等[10]研究发现 INF-α 能够充分刺激DC的成熟、活化,能上调CD86/CD80/CD83等成熟DC表面分子的表达,具有刺激T淋巴细胞增殖的能力;Daucr等[5]研究表明IFN-α在含GM-CSF/IL-4的培养液中能促进单核细胞分化为成熟DC。本实验采用ELISA法检测进一步发现:B、C组诱导培养DC分泌的IL-12、IFN-γ较A组增高,且C组DC分泌功能较B组更强,说明在体外IFN-α能增强脐血诱导培养DC的分泌功能,更有利于细胞免疫及抗肿瘤免疫反应。
本实验提示,在体外INF-α有促进脐血单个核细胞向成熟DC转化的能力,此种方法培养的DC表达丰富的CD分子,具有高度刺激同种异体T淋巴细胞增殖能力和高度分泌细胞因子的能力,此结果将为INF-α和DC联合应用于临床免疫治疗提供实验依据,同时为在体内重新评估INF-α对DC分化成熟和功能的影响奠定基础。
[1]Randvanyi LG,Banerjee A,Weir M,et al.Low levels of interferon-alpha induce CD86(B7.2)expression and accelerates dendritic cell maturation from human peripheral blood mononuclear cells[J].Scand J Immunol,1999,50(5):499
[2]Luft T,Pang KC,Thomas E,et al.Type I IFNs enhance the terminal differentiation of dendritic cells[J].J Immunol,1998,161(4):1947
[3]Santini SM,Di Pucchio T,Lapenta C,et al.The natural alliance bctween type I interferon and dendritic cells and its role in linking innate and adaptive immunity[J].J lnterferon Cytokinc Res,2002,22(11):1071
[4]Tough DF.Type I interferon as a link between innate and adaptive immunity through dendritic cell stimulation[J].Lcuk Lymphoma,2004,45(2):257
[5]Daucr M,Schad K,Daucr M,et al.IFN-alpha promotes definitive maturation of dendritic cells generated by short-term culture of monocytes with GM-CSF and IL-4[J].J Leukoc Biol,2006,80(2):278
[6]Jego G,Palucka AK,Blanck JP,et al.Plasmacytoid dendritic cells induce plasma cell differentiation through type I interferon and interleukin 6[J].Immunity,2003,19(2):225
[7]Santini SM,Lapenta C,Logozzi M,et al.Type I interferon as a powerful adjuvant for monocyte-derived dendritic cell development and activity in vitro and in Hu-PBL-SC1D mice[J].J Exp Med,2000,191(10):1777
[8]Montoya M,Schiavoni G,Mattei F,et al.Type I interferons produced by dendritic cells promote their phenotypic and functional activation[J].Blood,2002,99(9):3263
[9]Fukui H,Mitsui S,Harina N,et al.Novel functions of herbal medicinesindendriticcells:roleofamouisemenintumorinmunity[J].Microbiol Immunol,2007,51(11):1121
[10]Tamir A,Jordan WJ,Ritter M.Interferon-alpha-a is sufficient for promotingdendriticcellimmunogenicity[J].ClinExpImmunol,2005,142(3):471

