原发性高血压患者循环内皮祖细胞与颈动脉内膜中层厚度及炎性介质的相关性研究
西安交通大学医学院第二附属医院(西安 710004)金爱萍 王 红 韩东刚
动脉粥样硬化是原发性高血压的病理基础,而内皮损伤被证实为动脉粥样硬化的主要诱因。最新研究发现,外周循环中存在的内皮祖细胞(EPCs)可维持内皮完整性、促进内皮细胞的再生修复,显著影响动脉粥样硬化的进程,是心血管事件的独立预测指标[1]。颈动脉内膜中层厚度(IM T)是近年来国外大规模心血管病临床试验中最常采用的替代终点之一,可作为反映全身动脉粥样硬化的一个窗口[2]。已证实,炎症在心血管疾病的发生、发展过程中扮演着重要的角色[3]。本研究通过观察原发性高血压患者循环 EPCs与 IMT及炎性介质的相关性,进一步探讨其在此类患者发病机制中的作用。
对象与方法
1 研究对象 选取我院2007年4月至2008年11月收治的50例初诊原发性高血压患者作为高血压组,其中男 29例,女 21例,年龄 50.31±11.41岁。诊断根据 2005年《中国高血压防治指南》修订版,即收缩压≥140 mmHg和 (或 )舒张压≥90 mm Hg。排除标准:冠心病病史、2月内服用他汀类药物、未绝经女性、合并其他器质性心脏病如心肌炎、心肌病等;感染性疾病、肝肾功能不全、血脂异常者。选择同期门诊体检合格的50例健康者作为对照组,其中男 27例,女 23例,年龄 52.13±13.85岁。两组在年龄、性别上具有可比性(P> 0.05)。
2 方 法 (1)炎性因子的测定:受试者夜间禁食 12h后,清晨测量血压,抽取空腹静脉血 10ml,采用免疫透射比浊法测定血清超敏 C反应蛋白(Hs-CRP)含量,采用 ELISA法测定白介素-6(IL-6)和肿瘤坏死因子 -α(TNF-α)水平。 (2)EPCs的分离、培养、计数和鉴定:取抗凝外周血,以 Ficoll密度梯度离心法收集白膜层的单个核细胞,PBS洗涤 2次,接种于包被人纤连蛋白的24孔培养板中。在添加了青霉素100U/ml、链霉素 100 μ g/ml、 VEGF 50ng/ml、 20%优 质 胎牛 血清 的M199培养液中培养,3~ 4d更换培养液 1次;培养 14d后倒置相差显微镜下计数细胞克隆形成单位。细胞与DiI-Ac-LDL(2.4 μ g/ml)37℃下孵育 1h以检测 EPCs对 acLDL的摄取。然后用 2%多聚甲醛固定细胞10min。固定后用 PBS液浸洗,再将 FITC-UEA-I(10 μ g/ml)加于上述标本 37℃下孵育 1h。荧光显微镜鉴定 DiI-Ac-LDL和 FITC-UEA-I染色双阳性细胞为正在分化的内皮祖细胞。(3)IMT测定:仪器为美国HP5500型超声诊断仪,7.0M Hz线阵探头。患者取仰卧位,检查部位包括颈总、颈内动脉,于颈总动脉分叉近端1 cm处后壁测量或IM T最厚处,纵向超声显像可表现为由相对较低回声分隔的两条平行亮线,两线间距离即 IMT,冻结颈动脉窦以下 1 cm图像,测量 3次IM T,取3次测量值的平均值为颈总动脉IMT厚度值。
结 果
1 两组受试者循环EPCs数量比较 高血压组循环 EPCs克隆形成单位数目为20.88±7.64个,显著低于对照组 62.51±9.22个(P < 0.05)。
2 各组受试者临床指标的比较 见附表。高血压组的颈动脉 IM T、Hs-CRP、IL-6、TNF-α、收缩压和脉压均显著高于对照组(P<0.05)。
附表 两组患者临床指标比较(n=50,±s)
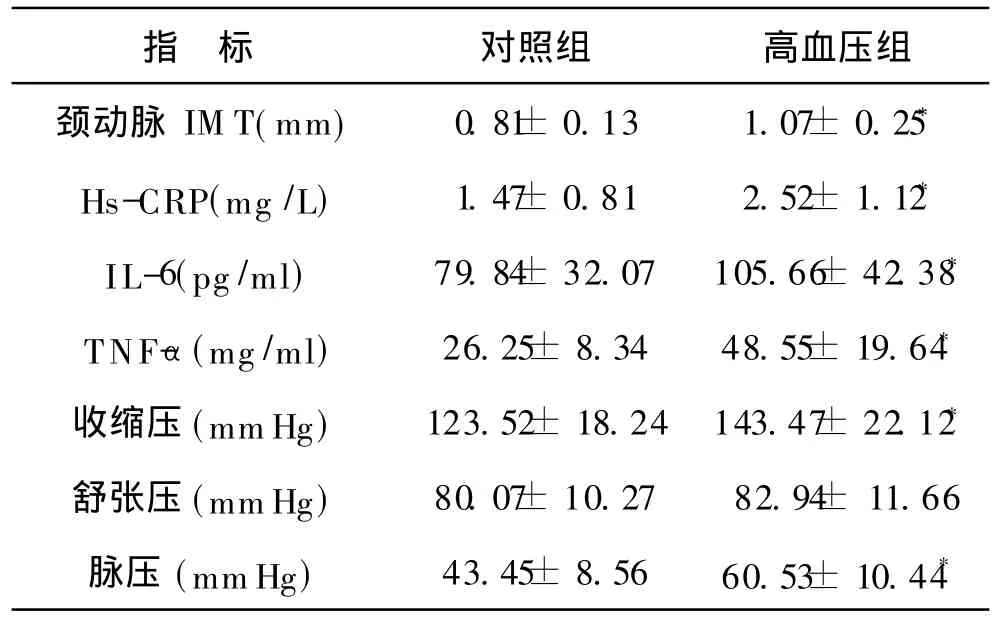
附表 两组患者临床指标比较(n=50,±s)
注:与对照组比较,*P<0.05
指 标 对照组 高血压组颈动脉 IM T(mm)0.81±0.13 1.07± 0.25*Hs-CRP(mg/L)1.47± 0.81 2.52± 1.12*IL-6(pg/ml)79.84± 32.07 105.66± 42.38*TNF-α(mg/ml)26.25± 8.34 48.55± 19.64*收缩压(mmHg)123.52± 18.24 143.47±22.12*舒张压(mmHg)80.07±10.27 82.94± 11.66脉压 (mmHg)43.45± 8.56 60.53± 10.44*
3 EPCs数量与颈动脉 IMT、炎性因子和血压的相关性分析 高血压患者的 EPCs数量与颈动脉 IM T(r=0.552,P=0.001)、Hs-CRP(r=0.457,P=0.004)、 IL-6(r=0.401,P=0.01)、脉压 (r=0.363,P=0.023)、收缩压 (r=0.336,P=0.025)和 TNF-α(r=0.281,P=0.041)呈显著负相关。偏相关分析表明,EPCs数量与颈动脉 IMT(r=0.577,P=0.000)、Hs-CRP(r=0.483,P=0.003)、IL-6(r=0.442,P=0.008)和脉压(r=0.390,P=0.011)呈显著负相关。
讨 论
内皮细胞是“内皮-高血压-心血管事件”链条中重要的始动环节和核心步骤,高血压作为重要的心血管病危险因素,其血管内皮结构的完整性和内皮细胞功能均受到损害[1],并可引起血管重塑,导致外周阻力进一步升高,后者将加重血管内皮的损伤,进而形成恶性循环,最终引发严重的靶器官损害和心血管事件。
EPCs是一种多能干细胞,可循环、增殖并分化为血管内皮细胞,但尚未表达成熟血管内皮细胞的表面特征[4]。其从骨髓释放,并在外周循环中运行,在损伤信号的诱导下迁移到损伤局部,分化为成熟内皮细胞,参与血管新生和修复。同时亦可通过旁分泌机制分泌血管内皮生长因子、肝细胞生长因子,胰岛素样生长因子等血管生成物质[5],从而促进 EPCs增殖分化。新近研究表明,EPCs可反映内皮及血管再生能力及动脉粥样硬化斑块负荷,是动脉粥样硬化性疾病的独立危险因素[4],外周血 EPCs的数量可以作为评价血管功能的指标,对心血管事件具有独立预测价值。本研究原发性高血压患者循环EPCs数目减少,提示后者可能参与原发性高血压的发病机制:①高血压状态下EPCs加速衰老,可能与 EPCs端粒酶的失活有关,EPCs分化成熟为完整内皮细胞的能力减弱,不利于血管的修复[4];②导致内皮功能障碍;③刺激血管平滑肌细胞增殖[5];④促进血栓形成;⑤影响肾素-血管紧张素-醛固酮系统,减少一氧化氮的产生和利用[5,6]。
已证实,高血压是动脉粥样硬化的危险因素,长期高血压损伤血管内膜,高压力、高流量的血流动力学改变是靶器官损伤的直接原因,血管结构和功能的改变发生较早,也较明显,主要表现为血管平滑肌细胞肥大、增生、结缔组织增加,使血管壁增厚,尤其是中层肥厚,壁腔比例明显加大,血流阻力和血管反应性增加,进而导致患者的血压持续升高[7]。文献显示,颅外颈动脉与冠状动脉、脑动脉粥样硬化的发生及严重程度存在明显相关性,颈动脉 IMT的改变早于斑块的发生,已被公认为一种反映早期动脉粥样硬化的无创伤性可靠指标[2]。本研究亦得出相似结论。
本研究原发性高血压患者的 Hs-CRP、IL-6和TNF-α显著增高,可能原因在于:高血压损伤血管内皮细胞,可引起单核-巨噬细胞、T淋巴细胞等炎性细胞粘附,激活单核-巨噬细胞系统,促使炎性细胞进入受损细胞,产生 IL-6、TNF-α等初级炎症因子,IL-6和TNF-α共同促进肝脏合成及释放 CRP,后者与脂蛋白结合,由经典途径激活补体系统,继而产生大量终末复合物,造成血管内膜受损;同时,单核细胞、粒细胞均含有 CRP受体,CRP的大量产生可使其受体活化,通过直接或间接作用,造成血管损伤[8]。反之,细胞因子对血压亦有调节作用,IL-6可通过影响下丘脑-垂体-肾上腺轴而参与血压的调节,TNF-α则被证实为能够刺激血管平滑肌细胞分泌内皮素,促进血管紧张素原在肝脏中的表达[8]。随着 EPCs研究被引入到炎症领域,一些学者认为,外周血EPCs的数量可以反映炎症相关性肺损伤和 sepsis时血管损伤的程度,与疾病的预后相关,因而有诊断的价值[9,10]。原发性高血压患者EPCs与颈动脉 IM T、Hs-CRP、IL-6和脉压呈显著负相关,提示 EPCs可作为高血压患者反映血管炎症损伤的指标和对炎症的预后判断,从而预测高血压危险,评价治疗,并判断预后。同时还提示了高血压的发生发展是内皮系统、血管重构和炎性反应等多因素综合作用的结果。
[1]Oliveras A,Soler M J,Mar tí nez-Estrada OM,et al.Endothelial progenitor cells are reduced in refractory hypertension[J].J Hum Hypertens,2008,22(3):183-190.
[2]Holaj R,Zelinka T,Wichterle D,et al.Increased carotid intima-media thickness in patients with pheochromocytoma in comparison to essential hypertension[J].J Hum Hypertens,2009,23(5):350-358.
[3]Virdis A,Ghiadoni L,Plantinga Y,et al.C-reactive protein and hypertension:is there a causal relationship[J].Curr Pharm Des,2007,13(16):1693-1698.
[4]Marsboom G,Pokreisz P,Gheysens O,et al.Sustained endothelial progenitor cell dysfunction after chronic hypoxia-induced pulmonary hypertension[J].Stem Cells,2008,26(4):1017-1026.
[5]胡剑平.高血压与内皮祖细胞[J].心血管病学进展,2008,29(1):133-135.
[6]Pirro M,Schillaci G,Menecali C,et al.Reduced number ofcirculating endothelialprogenitorsand HOX A9 expression in CD34+cells of hypertensive patients[J].J Hypertens,2007,25(10):2093-2099.
[7]王文统,周剑宇,金宏江,等.高血压病患者颈动脉超声检测与分析 [J].中国超声诊断杂志,2004,5(2):81-83.
[8]娄青林.老年高血压患者颈动脉粥样硬化与血尿酸及相关炎症因子的关系[J].实用老年医学,2007,21(5):309-311.
[9]RafatN, Hanusch C, BrinkkoetterPT,etal.Increasedcir-culating endothelialprogenitorcellsin septicpatients:Cor-relation with survival[J].Crit Care M ed,2007,35(7):1677-1684.
[10]SeguinT,BraunT,MiraJP.Endothelialprogenitorcells:new biomarkers and potential therapy in intensive care[J].M ed Mal Infect,2007,37(6):305-311.

