不同溶剂制备的锂离子电池负极材料SnS
周从雨,张 颖,汪大云,韩恩山
(1.河北工业大学化工学院,天津 300130; 2.河北工业大学理学院,天津 300130)
锡基负极材料具有比容量高的优势,具有用于锂离子电池的潜力。A.H.Robert[1]研究了 SnO2和 SnS2的电化学性能,发现LixS的作用与Li2O相似,两者均可在复合电极中充当缓冲基体,说明锡基硫化物可用作锂离子电池负极材料。
溶剂热法是制备硫化物的常用方法。以SnCl2◦2H2O和硫脲为反应物,Q.Li等[2]在苯中制备出微米级线形SnS;C.H.An等[3]在乙二胺中制备出粒径为60~200 nm的棒状SnS。由此可见,选择的溶剂不同,所制备材料的形态和粒径不同,而材料的形态、粒径等直接影响电化学性能。由于苯、乙二胺等溶剂毒性较大、价格较贵,不适合广泛应用。
本文作者通过溶剂热法,以乙醇和氨水为溶剂制备了负极材料SnS,并分析了样品的晶体形貌、电化学性能。
1 实验
1.1 SnS材料的制备
将等物质的量的SnCl2◦2H2O(天津产,AR)与硫脲(天津产,AR)分别放入有聚四氟乙烯内衬的、体积为50 ml的水热反应釜中。一个釜放入无水乙醇(天津产,AR)作为溶剂(所得产物记为产物A);另一个釜放入氨水(天津产,AR)作为溶剂(所得产物记为产物B),用量均为反应釜容积的75%。将水热反应釜密封后,放入烘箱中,在160℃下反应 20 h,自然冷却至室温。将产物用无水乙醇和蒸馏水反复洗涤、过滤至无Cl-(用AgNO3溶液检验),再在80℃下真空(真空度为0.095 MPa,下同)干燥6 h,得到SnS材料。
1.2 物相及表面形态的分析
用D/max-2500PC型X射线粉末衍射仪(日本产)对样品进行物相分析,CuKα,λ=15.406 nm,管流150 mA、管压40 kV,扫描速度为8(°)/min,步长为0.02°。用6700F型电子扫描显微镜(日本产)观察样品的表面形貌和粒径。
1.3 测试电池的制备
将制备的SnS样品与导电剂乙炔黑(焦作产,电池级)、粘接剂聚偏氟乙烯(日本产,电池级)按质量比 70∶20∶10溶于适量N-甲基吡咯烷酮(天津产,电池级)中,混匀后涂覆在10μ m厚的铜箔(清远产,电池级)上,在80℃下真空干燥10 h后,在自制压片机上压制(3 MPa)并裁剪成直径为11 mm、140 μ m厚的工作电极,每片工作电极约含5.6 mg活性物质,在100℃下真空干燥12 h,备用。以金属锂片(秦皇岛产,99.5%)为负极,1 mol/L LiPF6/EC+DMC+DEC(体积比1∶1∶1,天津产,电池级)为电解液,Celgard 2400膜(美国产)为隔膜,在RH<4%的手套箱中组装CR2032型模拟电池,静置24 h再进行测试。
1.4 性能测试
用CT2001A电池测试仪(武汉产)测试电池在0.1 C、0.5 C、0.8 C和1.0 C时的充放电性能,1.0 C=780 mA/g,电压为0.01~1.20 V。用CHI660B电化学工作站(上海产)进行循环伏安和电化学阻抗测试。循环伏安测试的扫描速率为0.2 mV/s,电压为0~2.5 V;电化学阻抗测试的频率为10-2~ 105Hz。
2 结果与讨论
2.1 物相及表面形态分析
制备的SnS样品的XRD图见图1。
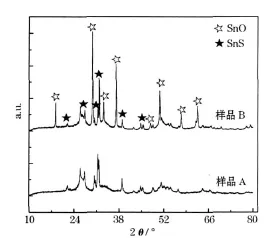
图1 制备的SnS样品的XRD图Fig.1 XRD patterns of prepared SnS samples
从图1可知,样品A的衍射峰与正交型SnS晶体标准卡(PDF卡号39-0354)吻合;样品B中有SnO和SnS的衍射峰,说明以氨水为溶剂未得到纯净的产物。这是由于乙醇做溶剂时,反应体系为酸性,硫脲与SnCl2◦2H2O中的结晶水反应,产生H2S气体,H2S再与Sn2+发生沉淀反应,生成 SnS。氨水做溶剂时,与Sn2+发生沉淀反应的阴离子除硫脲水解产生的S2-外,还有少量的OH-,导致出现SnO的衍射峰。
制备的SnS样品的SEM 图见图2。

图2 制备的SnS样品的SEM图Fig.2 SEM photographs of prepared SnS samples
从图2可知:样品A的粒径较小、基本为球状;而样品 B存在块状和球状两种形态,且粒径分布不均。这可能是由于在碱性体系中,SnS的生长速度过快,造成了SnS晶体粒径分布不均匀及形貌难以控制。
2.2 电化学性能研究
2.2.1 循环伏安曲线
制备的SnS样品的循环伏安曲线见图3。
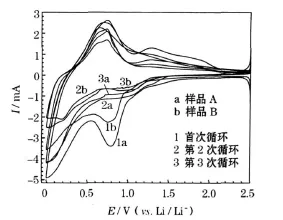
图3 制备的SnS样品的循环伏安曲线Fig.3 CV curves of prepared SnS samples
从图3可知,两种样品在首次阴极扫描过程中,还原电流均在1.2 V左右开始增大,并在0.8 V左右出现一个较强的不可逆还原峰,一般认为是电极表面形成稳定的固体电解质相界面(SEI)膜及不可逆反应SnS分解共同造成的[4],反应方程式见式(1)。位于0.75~0 V的还原峰,主要是发生了Li与Sn的合金化反应所致,反应方程式见式(2)。与阳极扫描过程中0.75 V左右出现的氧化峰相对应,该处的氧化峰主要发生Li与Sn的去合金化反应。从图3可知,样品A在该处的重现性优于样品B。
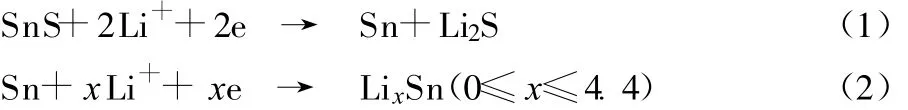
在随后的两次阴极扫描过程中,两种样品在1.2 V左右均有重现性较差的还原峰,与1.2~1.8 V重现性较差的氧化峰对应,可能是循环过程中Li2S等物质减少引起的[5]。
2.2.2 充放电性能
导电剂乙炔黑的存在和SEI膜的形成,均会在首次充放电过程中造成较大的不可逆容量损失,因此,从第2次循环开始讨论充放电性能。制备的SnS样品在不同电流下第2次循环的充放电曲线见图4。
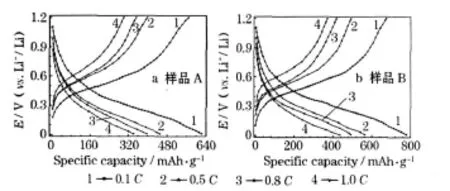
图4 制备的SnS样品第2次循环的充放电曲线Fig.4 Charge-discharge curves of prepared SnS samples at the 2nd cycle
0.01 ~0.50 V是放电的主要嵌锂区;0.40~0.80 V是充电的主要脱锂区。从图4可知,随着电流从0.1 C增大到1.0 C,电极极化增强,上述两个电压范围内的曲线变陡,充放电比容量降低。样品A的充电比容量从0.1 C时的566.6 mAh/g降至 1.0 C时的 297.8 mAh/g,放电比容量则从621.9 mAh/g降至 341.4 mAh/g,分别减少了 268.8 mAh/g和280.5 mAh/g,库仑效率均保持在88.6%左右;在相同条件下,样品B的充放电比容量分别减少了 304.4 mAh/g和345.2 mAh/g,库仑效率均保持在85.8%左右。这说明样品A受电极极化的影响较小,电化学性能较好。
2.2.3 循环性能曲线
制备的SnS样品在不同电流下的循环性能见图5。
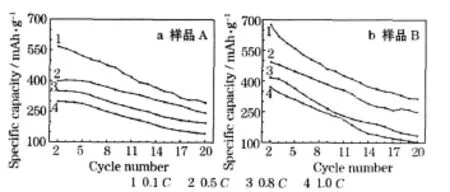
图5 制备的SnS样品的循环性能Fig.5 Cycle performance of prepared SnS samples
从图5可知,两种样品的充电(脱锂)比容量均随着电流的增大而降低。在相同电流下,样品A的曲线比样品B的平缓,平均每次循环的容量衰减率低些;两种样品的容量衰减率均在0.5 C时最低,说明样品A的循环性能优于样品B,且在0.5 C时具有最好的循环性能。以0.1 C充放电,电化学反应较慢,反应时间长,在循环过程中活性物质容易从极片上脱落,造成容量衰减较快[6];当电流大于0.5 C时,由于电极材料的Li+扩散系数较小,Li+在电解液中的传输速度大于在电极材料固相中的传输速度,内外锂浓度差增大,造成电极的浓差极化增大,循环性能降低。由于样品A的粒径比样品B均匀,充放电过程中材料局部和整体的体积变化较一致,减缓了循环过程中电极材料的粉化脱落,循环稳定性得到提高。综合上述因素,样品A的容量衰减比样品B慢。
2.2.4 电化学阻抗谱
首次放电过程中,制备的SnS样品在不同电位下的电化学阻抗谱见图6。
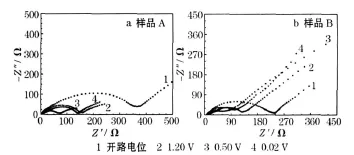
图6 制备的SnS样品在首次放电过程中的电化学阻抗谱Fig.6 EIS plots of prepared SnS samples when the initial discharge process
从图6可知,两种样品的阻抗谱均由高频区近似半圆的曲线和低频区近似45°的直线构成,分别代表电解液与电极界面电荷迁移引起的电化学阻抗Rct和Li+在固相活性物质中扩散的Warburg阻抗Zw。两种样品在开路电位下的 Rct均很高,说明此时 Li+反应困难;放电至1.20 V,两种样品的Rct均明显降低,可能与SnS的分解有关;继续放电至0.50 V,Rct进一步降低,表明在该电位下有利于锂与锡发生合金化反应;进一步放电至 0.02 V,Rct增大,说明合金化反应几乎完成,电荷转移困难。在整个过程中,样品B曲线形状的变化更明显,可能与活性物质团聚有关。
3 结论
采用简单的溶剂热法,分别以乙醇和氨水为溶剂制备了锂离子电池负极材料SnS。SnS材料的纯度、粒径及表面形态等受溶剂性质的影响较大。以乙醇为溶剂制备的SnS材料纯净,形貌为球状,颗粒比以氨水为溶剂制备的要均匀。
分别以 0.1 C、0.5 C、0.8 C和1.0 C的电流对制备的样品进行充放电测试,发现以乙醇为溶剂制备的SnS样品第2次循环时的库仑效率为88.6%左右,高于以氨水为溶剂制备的样品,且在0.5 C时的脱锂容量衰减率最低。电化学阻抗谱表明,以乙醇为溶剂制备的SnS的电化学性能较好。
[1]Robert A H.Lithium alloy negative electrodes formed from convertible oxides[J].Solid State Ionics,1998,113-115:57-67.
[2]Li Q,Ding Y,Wu H,et al.Fabrication of layered nanocrystallines SnS and β-SnS2via a mild solution route[J].Mater Res Bull,2002,37(5):925-932.
[3]An C H,Tang K B,Jin Y,et al.Shape-selected synthesis of nanocrystalline SnS in different alkaline media[J].J Cryst Growth,2003,252(4):581-586.
[4]Wang F M,Cheng H M,Wu H C,et al.Novel SEI formation of maleimide-based additives and its improvement of capability and cyclicability in lithium ion batteries[J].Electrochim Acta,2009,54(12):3 344-3 351.
[5]Li Y,Tu J P,Wu H M,et al.Mechanochemical synthesis and electrochemical properties of nanosized SnS as an anode material for lithium ion batteries[J].Materials Science and Engineering,B,2006,128(1-3):75-79.
[6]FAN Xing(樊星),ZHENG Yong-ping(郑永平),SHEN Wan-ci(沈万慈).电解刻蚀集流体铜箔对负极性能的影响[J].Battery Bimonthly(电池),2009,39(3):131-134.

