三维标测系统Carto指导下消融特发性室性心动过速*
陶海龙,张金盈,李 凌,张 力,王小芳
郑州大学第一附属医院心内科郑州450052
特发性室性心动过速(ventricular tachycardia,VT)包括右室/左室特发性流出道VT、特发性左室VT等,既往通常采用常规影像模式进行标测、消融,但标测、消融时间长,术后复发率较高[1-3]。Carto三维心电解剖标测系统能够实时、立体显示心脏腔室的电解剖信息,并可以实现三维解剖重建,有利于室性等复杂心律失常的标测与消融,提高消融疗效。作者对特发性VT患者采用Carto指导下标测和消融,观察消融疗效、手术时间及X线曝光时间,评价该方法的临床应用效果。
1 对象与方法
1.1 研究对象 郑州大学第一附属医院2008年至2009年收治住院的16例特发性VT患者(男12例,女4例),年龄17~38(35.0±4.6)岁,VT 病史(2.3 ±1.1)a。患者术前均完善导管消融术前常规检查,包括血常规、凝血酶原时间(PT)、心脏超声检查等,排除心肌病、心肌梗死等器质性心脏病;收集患者临床发作VT体表心电图,以备心腔内电生理检查。
1.2 心腔内电生理检查 术前停用抗心律失常药物5个半衰期,并签署知情同意书。常规穿刺左锁骨下静脉、右股静脉,放置6F电极导管(极距10 mm)至冠状静脉窦(CS)及右心室心尖部。依次行心室、心房程序期前刺激和分级递增刺激诱发VT。如不能诱发VT,静脉滴注异丙肾上腺素1~4 μg/min,将心率提升30%后重复前述程序刺激以诱发VT。对伴1∶1室房关系的VT行快速心房起搏,以确定诊断。比较诱发VT与临床发作VT图形,对于与临床VT图形一致的VT行Carto指导下激动顺序标测。
1.3 Carto指导下心内标测 设置解剖参考电极固定于患者背部,约平第7胸椎水平。VT持续发作状态下,选择体表心电图QRS波主波稳定的导联作为参考导联,R波或S波顶点作为参考零点,Carto消融电极双极远端(M1-M2)记录作为标测导联。兴趣窗口间期设定为心动过速周期的90%,填充阈值为15 mm。标测/消融导管为7F Navi-Star(Cordis Webster)冷盐水灌注导管。在VT持续发作状态下,逐点取点进行相应心室电解剖重建,并根据消融电极局部电位特征进行逐点校正。在构建的心室激动顺序传导图上,选取激动顺序提前区域(红色区域),密集取点,确定电激动图上最早激动点处为消融靶点。如VT不持续,采用起搏标测,选取与临床型VT波形一致的心室腔内起搏点作为消融靶点。
1.4 消融 采用Navi-Star(Cordis Webster)冷盐水灌注导管消融,能量设置为35 W,45℃,静息冷盐水灌注流量为2 mL/min,放电时最大流量17 mL/min,每次放电30~60 s。以消融放电后VT终止或消融后30 min内重复心室程序刺激和静脉滴注异丙肾上腺素不能诱发VT作为消融终点。消融术中达到消融终点作为即刻消融成功标准;消融后6个月内无VT发作,行心电图及动态心电图(Holter)检查无既往相同形态VT发作为消融后随访期成功标准。
1.5 随访 患者术后均进行门诊随访,行心电图、Holter检查,观察有无VT复发、新的心律失常以及各种并发症等。
2 结果
2.1 心腔内电生理检查 除1例未诱发出VT外,其余15例电生理检查均诱发出临床型VT,其中10例单纯采用心室程序刺激诱发VT,5例静脉滴注异丙肾上腺素后程序刺激诱发VT。13例VT持续发作;3例VT不持续,以频发室性早搏为主,其形态与临床VT的QRS波形态一致。Carto指导下对13例持续性VT行激动顺序标测,对3例不持续性VT在解剖重建后行起搏标测。其中,诱发诊断特发性右室流出道VT 11例,左室特发性VT 4例。
2.2 Carto指导下心内标测 所有患者均完成相应心室腔解剖重建,取点(52±12)个,心室容积(35.0±8.2)mL。11例右室流出道 VT激动顺序标测显示,起源于间隔面(激动顺序最早)VT 8例,游离壁VT 2例,肺动脉瓣上VT 1例(图1);密集标测最早激动区域后,确定理想靶点较参考零点提前(22±8)ms。4例左室特发性VT激动顺序标测均显示左室后间隔区域激动最早,密集标测最早激动区域,记录到P电位3例(图2),舒张晚期电位2例,理想靶点较参考零点提前(23±7)ms。

图1 右室流出道VT三维电解剖标测及影像记录
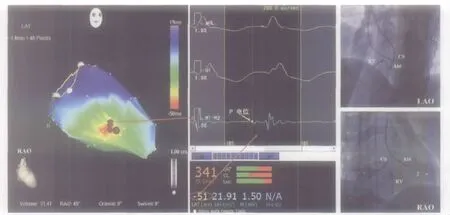
图2 左室特发性VT三维电解剖标测及影像记录
2.3 消融结果评价 每例 VT消融放电次数(4.2 ±1.1)次,累计放电时间(205.0 ±13.4)s,单次消融后VT终止或不能诱发者占13/15。12例VT在心动过速下放电,放电后11例VT终止,1例转变为一过性加速性VT及频发室早,放电距VT终止时间(4.9±3.7)s。4例左室特发性 VT,消融后3例出现左后分支阻滞图形。手术时间(3.50±0.85)h,X 线曝光时间(15.0 ±7.9)min。所有患者消融后均进行诱发刺激,其中13例使用异丙肾上腺素诱发,2例诱发出VT,经再次消融后无VT发作。15例患者术中即刻均达到消融终点。
2.4 随访 所有患者均完成消融术后随访,随访时间(6.3 ±2.1)个月,结合患者症状及心电图、Holter检查,14例患者无VT发作,1例出现偶发室早(38次/24 h),未特殊治疗,仍在随访。
3 讨论
以往,特发性VT是在X线透视指导下进行消融的。常规方法标测流出道VT时,常常以最早心室激动点和(或)起搏标测来确定消融靶点;而左室特发性VT的标测通常以最早心室激动点或浦肯野电位(P电位)处作为靶点消融。以上标测过程均需要不同的透照体位观察,因而X线曝光时间以及手术时间均较长。此外,经常出现有效消融靶点在放电过程中发生移位,而通过重复透视,再次寻找靶点进而补充消融,往往并不可靠。由此导致消融靶点位置不固定,加之普通的消融电极对于心室肌难以达到透壁损伤的效果,因而消融术后复发风险增加。
Carto三维心电解剖标测系统采用磁场定位示踪技术[4],通过导管标测建模,不仅能重建心腔解剖结构,同时能够显示心腔的电学传导激动顺序。在此基础上,通过对较早激动区域的密集标测,能够快速、直观地发现最早激动点(消融靶点)[5],并进行标记、定位,明显提高了标测效果和准确性。该系统能够直观地显示心腔解剖结构以及导管位置和运行方向,减少了X线体位投照的需要,极大地缩短了X线曝光时间。同时结合该系统的标测定位记忆功能,能够识别有效靶点和无效靶点,避免无效靶点的多次放电,提高消融的可靠性,减少放电次数。
研究结果显示,Carto指导下VT消融疗效较常规标测消融方法明显提高。研究中发现个别特发性VT可起源于特殊部位,如肺动脉瓣上VT。此种情况下的消融靶点图具有其特征性[6-7],由于病灶解剖位置的特殊性,采用常规标测方法常难以成功,而且难以保证消融靶点位置的一致性;而Carto标测消融系统可实现直观、准确标测定位,同时具备导航定位记忆功能,因而能够保证在有效靶点位置重复放电,提高消融效果。对于伴有器质性心脏病VT以及非典型部位VT的消融,Carto系统较常规操作系统更具优势,疗效更突出[8-9]。
研究中采用冷盐水灌注系统治疗特发性VT,取得了良好的疗效,这与其能够增加能量传导,造成更深的心肌损伤有很大关系[10-12]。冷盐水灌注消融电极通过盐水灌注,冷却电极导管、心肌组织表面以及周围血流,减少焦痂的形成,允许更大的能量传导,增加消融损伤的透壁性。但因为冷盐水灌注导管射频消融治疗可以产生较大且深的心肌损伤,引起心脏穿孔和心包填塞的并发症风险也会增加[13-14]。研究中消融温度阈值设置为45℃,消融过程中注意密切观察阻抗的变化,如阻抗出现大幅度的变化即停止消融,并未观察到相关的并发症。而对于相对薄弱的解剖结构,如肺动脉瓣上部位,消融时则应更加注意放电时阻抗的变化以及消融电极的稳定性,以保证消融安全。
[1]Wellens HJ,Smeets JL.Idiopathic left ventricular tachycardia.Cure by radiofrequency ablation[J].Circulation,1993,88(6):2 978
[2]Morady F,Kadish AH,DiCarlo L,et al.Long-term results of catheter ablation of idiopathic right ventricular tachycardia[J].Circulation,1990,82(6):2 093
[3]吴书林,杨平珍,李海杰,等.特发性室性心动过速靶点标测与射频消融方法研究[J].中国介入心脏病学杂志,1999,7(2):61
[4]Gepstein L,Evans SJ.Electroanatomical mapping of the heart:basic concepts and implications for the treatment of cardiac arrhythmias[J].Pacing Clin Electrophysiol,1998,21(6):1 268
[5]Nademanee K,Kosar EM.A nonfluoroscopic catheter-based mapping technique to ablate focal ventricular tachycardia[J].Pacing Clin Electrophysiol,1998,21(7):1 442
[6]Srivathsan KS,Bunch TJ,Asirvatham SJ,et al.Mechanisms and utility of discrete great arterial potentials in the ablation of outflow tract ventricular arrhythmias[J].Circ Arrhythm Electrophysiol,2008,1(1):30
[7]Suleiman M,Asirvatham SJ.Ablation above the semilunar valves:when,why,and how:Part I[J].Heart Rhythm,2008,5(10):1 485
[8]Codreanu A,Odille F,Aliot E,et al.Electroanatomic characterization of post-infarct scars comparison with 3-dimensional myocardial scar reconstruction based on magnetic resonance imaging[J].J Am Coll Cardiol,2008,52(10):839
[9]Mizobuchi M,Enjoji Y,Ejima E,et al.An unmappable ventricular tachycardia in the arrhythmogenic right ventricular cardiomyopathy:elucidation of critical isolated delayed components with high-resolution electroanatomical mapping[J].Europace,2010,12(2):279
[10]Nakagawa H,Yamanashi WS,Pitha JV,et al.Comparison of in vivo tissue temperature profile and lesion geometry for radiofrequency ablation with a saline-irrigated electrode versus temperature control in a canine thigh muscle preparation[J].Circulation,1995,91(8):2 264
[11]Delacretaz E,Stevenson WG,Winters GL,et al.Ablation of ventricular tachycardia with a saline-cooled radiofrequency catheter:anatomic and histologic characteristics of the lesions in humans[J].J Cardiovasc Electrophysiol,1999,10(6):860
[12]Ruffy R,Imran MA,Santel DJ,et al.Radiofrequency delivery through a cooled catheter tip allows the creation of larger endomyocardial lesions in the ovine heart[J].J Cardiovasc Electrophysiol,1995,6(12):1 089
[13]Yamane T,Jais P,Shah DC,et al.Efficacy and safety of an irrigated-tip catheter for the ablation of accessory pathways resistant to conventional radiofrequency ablation[J].Circulation,2000,102(21):2 565
[14]Abdelwahab A,Sapp JL.NaviStar ThermoCool catheter for ventricular tachycardia [J].Expert Rev Med Devices,2007,4(3):307