悬铃木组培快繁技术研究
王春荣,毕 君,曹福亮,刘树丰
(1.河北省林木良种工程技术研究中心,河北 石家庄 050061;2.河北省林业科学研究院,河北 石家庄 0500611;3.南京林业大学,南京 210037;4.丰宁县千松坝林场,河北 丰宁 068300)
悬铃木组培快繁技术研究
王春荣1,2,毕 君1,2,曹福亮3,刘树丰4
(1.河北省林木良种工程技术研究中心,河北 石家庄 050061;2.河北省林业科学研究院,河北 石家庄 0500611;3.南京林业大学,南京 210037;4.丰宁县千松坝林场,河北 丰宁 068300)
选用悬铃木带腋芽(裸露)的半木质化茎段为外植体,进行组织培养技术研究。结果表明:6月中旬接种外植体较好,适宜消毒处理为75%酒精表面消毒10s后用0.1%HgCl2灭菌3、6min;最佳增殖培养基为MS+6-BA0.1+IBA0.5;20~25d增殖系数为5.92;试管苗根诱导以1/2MS+IBA0.5为宜,生根率为80%。
悬铃木;半木质化茎段;组织培养
悬铃木(Platanus acerifolia)别名二球悬铃木或英国梧桐,属于悬铃木科悬铃木属。它是三球悬铃木(又名法国梧桐)和一球悬铃木(又名美国梧桐)的杂交种。其树干高大,枝叶茂盛,遮荫面积大,绿化效果好,同时耐修剪,抗烟尘,是世界著名的行道树和庭荫树,享有“行道树之王”的赞誉,已成为我国大中城市重要的行道树及园林绿化树种。本实验选用悬铃木带腋芽茎段为外植体进行了悬铃木组织培养快繁技术研究,以期对优良种源和变异个体进行种质保存和快速繁殖。
1 材料与方法
1.1 试验材料
试验材料为河北省林业科学研究院苗圃内8a生悬铃木树冠中下部枝条。
1.2 试验方法
1.2.1 外植体的获取 6~9月取当年萌生的枝条中部带腋芽的茎段为外植体。剪除叶片(但保留叶柄),在自来水下冲洗2h,再用自来水冲洗干净。用75%的酒精浸10~30s后再用0.1%的HgCl2消毒5~15min,然后用无菌水冲洗6遍,无菌滤纸吸干表面水分,然后用镊子拽去叶柄,使腋芽祼露,将带芽茎段切成长度为0.5~1.0cm的单芽小段,接种在芽诱导培养基上。芽诱导培养基为MS+6-BA1.0mg/L(单位下同)+NAA0.05和MS+6-BA1.0+IBA0.1。每瓶接种1个外植体,每处理30~40瓶。
1.2.2 增殖培养 接种5d后腋芽萌发开始生长,约20~25d不定芽高1~2cm时,切下转入分化培养基中进行继代培养,待不定芽达一定基数时用MS+6-BA0.5+IBA0.2连续继代2次使芽丛长势和积累激素一致后,转入预先设计的培养基中进行增殖试验。增殖培养以MS培养基为基础培养基,附加不同浓度的6-BA、IBA、KT、GA3;光强设定1500、2000、3000、4000lx 4 种;光照时间分别为 10、12、14、16h;培养温度分别为(20±2)℃、(23±2)℃、(25±2)℃、(28±2)℃,每处理7~10瓶,每瓶接种6块,20~25d继代1次,调查每一代的苗高、增殖系数、苗长势等。
1.2.3 根诱导 取高1.5~2cm生长健壮的悬铃木试管苗单株切下转到生根培养基上,生根培养基以1/2MS为基本培养基并分别附加不同浓度的IBA和NAA。每处理12瓶,每瓶5株。培养30d后调查生根情况。
1.2.4 炼苗移栽 生根苗经7d开口炼苗后,取出,洗净基部培养基,用1000倍多菌灵溶液浸泡30min后栽于蛭石中,保持相对湿度85%左右,室温20~28℃。
2 结果与分析
2.1 外植体接种与无菌芽诱导
不同时间、取材部位、消毒处理间外植体接种情况见表1,从试验结果分析,不同时间、取材及消毒处理间外植体污染率、枯死率,以及芽诱导率均有影响。6月15日接种,外植体污染率最低,在18.18%以下,枯死率为10%~54.55%,保存率最高可达80%,萌芽率高;8月13日和24日接种,外植体污染率高,保存率低;9月17日接种秋梢,外植体污染率较低,但枯死率高,保存率在27.27%以下,芽萌发率也在27.27%以下。以嫩茎段为外植体接种,外植体污染率低、死亡率高,而且不萌芽,半木质化茎段芽萌发率最高可达100%。不同消毒处理对外植体接种成功与否影响很大,以75%酒精表面消毒10s后用0.1%HgCl2灭菌3、6min最好,外植体保存率为80%,萌芽率100%。因此,悬铃木组织培养不宜选用嫩茎段为外植体;最佳接种时间为6月中旬,消毒处理以75%酒精表面消毒10s后用0.1%HgCl2灭菌3、6min最好,外植体保存率80%,萌芽率100%。
外植体接种5d后腋芽萌发开始生长,不同培养基间悬铃木外植体萌芽率差异不明显,MS+6-BA1.0+NAA0.05培养基中平均芽诱导率为55.4%,MS+6-BA1.0+IBA0.1培养基中平均芽诱导率为54%。
2.2 继代增殖
2.2.1 KT、GA3和6-BA对悬铃木试管苗增殖的影响 从表2中看,KT和6-BA对悬铃木试管苗增殖系数影响不大,但对生长势影响很大,使用0.3~1.0mg/L6-BA的处理试管苗长势较好,矮壮,枯死率低或无枯死;使用0.3~1.0 mg/LKT的处理试管苗较高,但长势普遍较差,枯死现象严重,而且基部发黑;加入1.0mg/L GA3后试管苗长势差,苗矮,25d时全部枯死。因此可以推断悬铃木增殖不宜使用KT和GA3,6-BA为适宜悬铃木增殖的细胞分裂素。
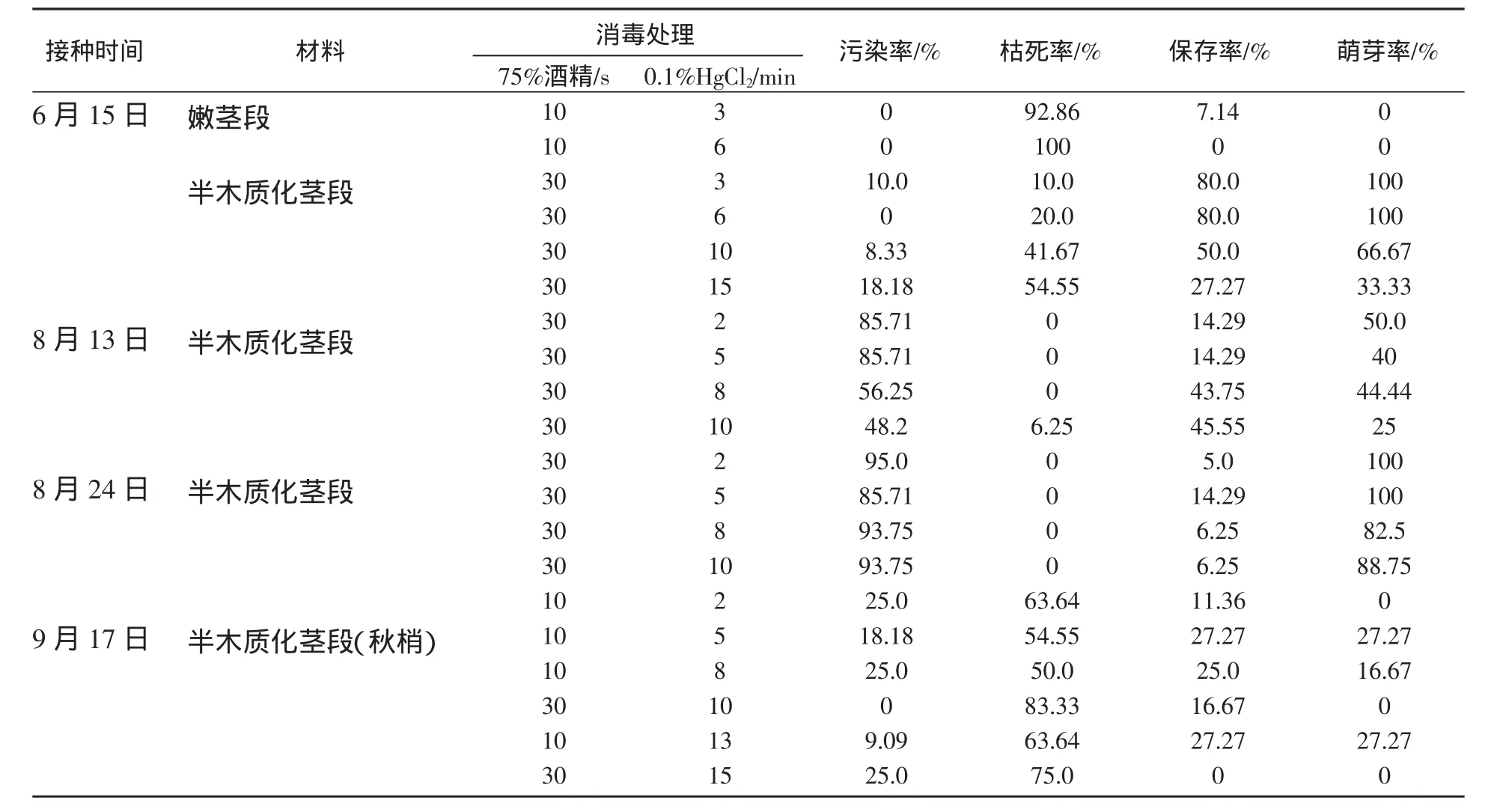
表1 不同处理间悬铃木外植体污染情况及芽诱导率

表2 KT、GA3和6-BA对悬铃木不定芽增殖的影响
2.2.2 6-BA和IBA对悬铃木增殖的影响 6-BA、IBA对悬铃木试管苗的增殖均有很大影响。悬铃木不定芽长势及基部形成的愈伤与6-BA浓度的关系紧密,随着6-BA浓度的增加愈伤加大,试管苗生长势也有变弱的趋势。IBA浓度0.1~0.5mg/L,当6-BA浓度在0.1~0.3mg/L时,试管苗增殖系数随着IBA浓度的升高而增加,当6-BA浓度在0.5~1.0mg/L时,试管苗增殖系数随着IBA浓度的升高而降低。其中6-BA0.1mg/L,IBA0.5mg/L时,试管苗增殖系数最高,为5.92倍,显著高于其他处理,其他处理均在3.5倍以下。悬铃木增殖培养基以MS+6-BA0.1+IBA0.5为宜。
2.2.3 不同继代次数对不定芽增殖系数的影响 随着继代次数的增加,不定芽的增殖系数有一定的变化。对悬铃木继代培养的前12代不定芽的增殖试验观察中发现,在4代之前,每次继代芽的增殖水平无变化;继代4次以后,随着继代次数的增加,增殖系数有明显的递增趋势;8代以前在增殖培养基上得到的芽均为有效芽,从第9代起开始出现玻璃化苗,而且随后几代虽然增殖系数显著增加,但玻璃化越趋严重,枯死现象也严重,玻璃化苗所占比例由第9代的20%迅速增至第12代的80%,枯死率也增加到30%以上,有效芽的增殖系数显著降低。
2.2.4 培养环境对悬铃木不定芽增殖的影响 试验观察中发现,悬铃木不定芽增殖受光照时间影响不大;光强对其生长势有明显的影响,光强4000lx时,不定芽生长势明显变弱,叶色发黄,有枯叶现象,光强以2000~3000lx为宜;温度对不定芽增殖和生长势均有影响,随着温度的升高增殖系数有增加的趋势,但高温(28±2)℃会使不定芽玻璃化现象加重,有效增殖系数降低,其适宜培养温度为23~25℃。

表3 6-BA和IBA对悬铃木增殖的影响
2.3 根诱导
将高1.5~2cm的悬铃木试管苗单株接种在生根培养基上,10d后可观察到有根生出,15d后根开始伸长,到30d时,形成较完整根系。结果见表4。
从表4中可以看出,IBA对悬铃木根诱导效果好于NAA,在1/2MS培养基上添加0.1~1.0mg/L NAA,生根率在60%以下,而且基部形成较大愈伤,根系从愈伤上生出,影响移栽成活,添加0.5mg/L IBA,生根率可达80%,而且生根状态比其他培养基上的好,平均根数为3.6条/株,平均根长2.5cm。所以悬铃木根诱导培养基以1/2MS+0.5mg/L IBA为宜。

表4 不同处理间悬铃木试管苗根诱导情况
2.4 炼苗移栽
当生根试管苗的根长3cm左右、苗高2~3cm时,将培养瓶移至自然室温下揭开封口膜,并在培养瓶里加0.5cm高的一层水,炼苗7d。炼苗后将小苗取出,洗净苗上附着的培养基,用1000倍多菌灵浸泡30min后移栽蛭石中。移栽后盖上塑料薄膜进行保温保湿,并加以遮荫,每天掀开薄膜1次使其透气并适量喷水,7d后去掉薄膜,并适时喷水。移栽25d后,苗高约2~5cm,叶片明显长大,长出1~2条新根。移苗成活率达85%。
3 结论
试验成功建立了悬铃木组织培养快繁技术体系:6月中旬取当年生半木质化茎段为外植体,用75%酒精表面消毒10s后用0.1%HgCl2灭菌3、6min,将带腋芽(祼露)的茎段接种在芽诱导培养基MS+6-BA1.0+NAA0.05或MS+6-BA1.0+IBA0.1上,外植体保存率80%,萌芽率100%;增殖培养基以MS+6-BA0.1+IBA0.5为宜,20~25d增殖系数为5.92倍,而且生长健壮;试管苗根诱导以1/2MS+0.5mg/L IBA较好,生根率80%,平均根数为3.6条/株,平均根长2.5cm。
S792.370.5
A
1002-3356(2010)04-0011-03
2010-05-30
国家科技支撑计划林业项目(2006BAD03A01)

