BRD-2基因在急性淋巴细胞白血病中表达的临床研究
范 红,程远东,孙 哲,吕晓东
(1.郑州大学第五附属医院干部病房,河南郑州450052;2.郑州大学第一附属医院血液科,河南郑州450052;3.河南省肿瘤医院肿瘤研究所,河南郑州450052)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一种多基因异常所致的血液系统恶性疾病,包括了复杂的基因突变、缺失、扩增、癌基因激活、抑癌基因失活以及融合基因转录等多种分子生物学水平的异常。基因治疗为其提供了一种高度特异性的治疗手段,应用标记基因能够更准确地掌握患者接受免疫治疗后以及肿瘤特异性杀伤细胞在体内存在、分布及活性等方面的信息[1]。迄今为止,ALL的发病和或复发机制并未完全清楚,故寻找新的白血病相关基因一直是这一领域的研究热点。筛选出表达异常和功能异常的白血病相关基因不仅有助于阐明白血病发生、发展的机制,而且为找到新的治疗靶位点提供可能[2]。BRD-2是一种与细胞的增殖和凋亡相关的基因,但其与ALL的相关性研究报道很少。本研究对78例A LL患者BRD-2 mRNA表达水平进行了检测,探讨其在ALL患者中的表达情况及其与预后的关系。
1 临床资料
1.1 一般资料 2004年1月至2008年12月郑州大学附属第五医院和河南省肿瘤医院收治的ALL患者78例,男38例,女40例,中位年龄23岁(14~68岁)。健康对照外周血 35份,取自异基因干细胞移植患者的健康供者及健康体检者,其中男20例,女15例,平均年龄26岁(16~48岁)。
1.2 半定量 RT-PCR 取外周血5 mL或骨髓2 mL,用Ficoll方法收集1×107个细胞,细胞总 RNA用 TRIzol抽提试剂盒提取,-80℃保存。引物均由上海生工生物工程公司合成。BRD-2 上游引物:5′-CTG CCT ATG CTG GCC ZTTC-3′;下游引物:5′-TCC TCC TCG TCC TCC TCA TC-3′;扩增长度455 bp。β-actin 作为内参,上游引物:5′-CTA CAA TGA GCT GCG TGT GGC-3′;下游引物 :5′-CAG GTC CAG ACG CAG GAT GGC-3′,扩增长度271 bp。逆转录反应:使用 Promega公司ImProm-IITM Reverse Transcription System试剂盒,步骤为:70℃5 min,42℃60 min,25℃5 min。cDNA作为PCR反应的模板,-20℃保存备用。PCR扩增:β-actin作为内参照与BRD-2基因的引物一起扩增。PCR反应体系25 μ L,包括 cDNA 1.6 μ L,10×Mg free buffer 2.5μ L,25 mmol/L M gCl21.5 μL,10 mmol/L dNTP 0.5 μL,BRD-2 上下游引物终浓度为0.4 umol/L,β-actin上下游引物终浓度为0.2 μ mol/L,Taq聚合酶1.5 u,用去离子水补足至25 μ L。扩增的循环参数:94℃变性5 min,再94℃30 s,62℃30 s,72℃40 s,共28个循环,循环结束后72℃延伸5 min。PCR产物经2%琼脂糖凝胶电泳后使用BIO-RAD凝胶扫描系统进行分析,用目的基因与β-actin电泳条带荧光强度的比值来检测目的基因转录水平。
1.3 治疗方法 78例ALL患者均采用VDP方案(长春新碱、柔红霉素、泼尼松)、CODP方案(环磷酰胺、长春新碱、柔红霉素、泼尼松)[3]诱导化疗 2个疗程,其中 40例青少年患者在不同阶段接受不同形式的造血干细胞移植。移植前状态包括:第1个疗程达到完全缓解(CR1)者20例、第2个疗程达到完全缓解(CR2)者10例、部分缓解(PR)2例、复发状态8例。移植方式包括:骨髓移植20例、外周血干细胞移植15例、脐血移植5例。其中非血缘关系(包括骨髓或脐血)移植15例、亲属间(包括骨髓或外周血干细胞)移植11例、自体外周血干细胞移植14例。其余38例患者在VDP、CODP方案基础上加用中剂量甲氨蝶呤(M TX)、中剂量阿糖胞苷(Ara-C)、鬼臼乙叉甙(Vp16)等巩固强化治疗;CR半年以上者接受巯嘌呤(6-MP)、MTX维持治疗;定期应用M TX、Ara-C、地塞米松(Dex)二或三联鞘内注射预防中枢神经系统白血病。
1.4 疗效判断 参照《血液病诊断及疗效标准》第2版。
1.5 统计学处理 采用SPSS11.5软件进行统计学分析,计数资料采用χ2检验,计量资料采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 BRD-2 mRNA阳性率 78例 ALL患者 BRD-2 mRNA阳性率为75.31%,明显高于健康对照组(37.14%,P<0.05)。ALL患者BRD-2 mRNA的表达水平(0.912±0.137)高于健康对照组(0.466±0.209,P<0.01)。见图1。
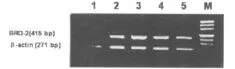
图1 BRD-2 mRNA表达情况
2.2 3年无病生存(DFS)率BRD-2 mRNA阴性ALL患者3年DFS率为47.43%,优于BRD-2mRNA阳性表达患者(32.55%),差异有统计学意义(P<0.05)。40例肝细胞移植患者中,CR1期移植组的3年DFS率优于CR2、PR、复发状态移植者,差异有统计学意义(P<0.05)。
3 讨 论
BRD-2基因是从T细胞文库中克隆出来的,包括一个开放阅读框,编码的蛋白质含754个氨基酸[3],是促细胞活化的丝/苏氨酸激酶,该酶定位于细胞核。BelAiba等[4]研究表明该酶专一性地存在于胞核内,细胞增生时活性增高,并且发现在ALL、慢性淋巴细胞白血病(CLL)患者该酶的活性也显著升高。提示这种胞核激酶是信号传导通路上的组分之一,在细胞周期应答中发挥作用,这种功能的发挥与E2F转录因子家族相关[5]。E2F既可控制细胞的增殖,又能诱导细胞凋亡,既能促进肿瘤的发生,又能抑制肿瘤的发生,既有转录激活作用,又有转录抑制作用,原因在于E2F的双重调节功能是相互独立的,其调节作用的发挥与其量的水平有很大关系。Guo等[6]发现BRD-2是一种新的与人类白细胞增多症有关的蛋白激酶,包括两个高度保守的溴结合区。BRD-2可促进E2F调控细胞周期的进展,该机制的异常可能是白细胞增多的遗传因素。Mungall等[7]的报道再次证实BRD-2在白血病患者的白细胞中活性很高,提示这种酶可能参与了白血病和其他增生性疾病的发病机制。
本研究结论表明,BRD-2基因在ALL患病组表达水平高于健康对照组,差别有统计学意义,提示该基因可能与ALL的发病有某种相关性,但其确切机制及调控方式仍有待于进一步研究。
大部分学者认为,ALL单纯化疗的长期生存率低,只要有人类白细胞抗原(HLA)相合的同胞供者都应在CR1期进行异基因移植[8]。本组发现BRD-2 mRNA阳性表达患者的3年DFS率明显低于BRD-2 mRNA阴性表达的患者,而且40例患者接受移植,其中异基因移植26例,自体移植14例,结果显示,异基因移植的长期生存率优于化疗,但由于样本数量有限,随访时间较短,还有待大规模随机对照试验确定ALL的移植适应证和移植时机。
综上所述,BRD-2基因异常表达在ALL的发生、发展中可能起重要作用,检测该基因可作为临床诊断及预后评估指标。但是BRD-2基因是否是一个新的白血病相关基因,其在白血病的发生、发展及复发中究竟起什么作用,这些问题的解决有待于更深入的实验研究。
[1]陈幸华.血液肿瘤治疗的现状与前景[J].重庆医学,2003,32(10):1281.
[2]Caligiuri MA,Strout MP,Gilliand DG,et al.Molecular biology of acute myeloid leukemia[J].Semin Oncol,1997,24(1):32.
[3]Pal DK,Evgrafov OV,Tabares P,et al.BRD2(RING3)is a probable major susceptibility gene for common juvenile myoclonic epilepsy[J].Am J Hum Genet,2003,73(2):261.
[4]BelAiba RS,Baril P,Chebloune Y,et al.Identification and cloning of an 85-kDa protein homologous to RING3 that is upregulated in proliferating endothelial cells[J].Eur J Biochem,2001,268(16):4398.
[5]Denis GV,Vaziri C,Guo N,et al.RING3 kinase transactivates promoters of cell cycle regulatory genes through E2F[J].Cell Growth Differ,2000,11(8):417.
[6]Guo N,Faller DV,Denis GV.Activation-induced nuclear translocation of RING3[J].Cell Sci,2000,113(17):3085.
[7]Mungall AJ,Palmer SA,Sims SK,et al.The DNA sequence and analysis of human chromosome 6[J].Nature,2003,25(6960):805.
[8]Zhou M,Peng C,Nie XM,et al.Expression of BRD7-interacting proteins,BRD2 and BRD3,in nasopharyngeal carcinoma tissues[J].Ai Zheng,2003,2(2):123.

