柔肝消饮对肝硬化大鼠血清Leptin含量以及肝脏Leptin mRNA表达的影响*
杨牧祥 张一昕 于文涛 徐华洲 高 玮 韩 雪
河北医科大学中医学院(石家庄050091)
1 材料
1.1 实验动物清洁级SD大鼠60只,雌雄各半,体质量
180~200g,由华中科技大学同济医学院实验动物学部提供,动物合格证号:SCXK(鄂)2004-007。
1.2 药物柔肝消饮组成:由香附、青皮、炙黄芪、炒白术、白芍、三棱、莪术、地鳖虫、郁金、姜黄、丹参等药物组成,水煎浓缩成所需浓度的药液。复方鳖甲软肝片:由内蒙古福瑞中蒙药科技股份有限公司生产,批号国药准字Z19991011,实验时用蒸馏水配制成所需浓度的药液。
1.3 主要试剂Leptin试剂盒购自北京普尔伟业生物科技有限公司;Trizol RNA试剂盒购自美国Invitrogen公司;PCR试剂盒购自大连TaKaRa公司。Leptin的引物由北京塞百盛基因技术有限公司合成,以β-actin为内参照。Leptin的上游引物为5'-CCTGTGGCTTTGGTCCTATCTG-3';下游引物为5'-CTGCTCAGAGCCACCACCTCTG-3',扩增片段为420bp。β-actin上游引物为5'-CCA AGGCCA ACCGCGAGA AGATGA C-3',下游引物为5'-AGGGTACATGGTGGT GGCGCCAGAC-3',扩增片断长度为577bp。
1.4 主要仪器756MC型紫外-可见分光光度计、PE9600型PCR扩增仪、电泳仪及电泳槽、凝胶图像分析系统、紫外透射仪、超低温保存箱、高速冷冻离心机等。
2 方法
2.1 模型制备60只大鼠适应性喂养1周后,随机分为造模组48只和正常组12只。参照文献[5-6],48只造模组大鼠首次予皮下注射40%CCl4花生油溶液(0.5mL/100g体质量),以后每周2次皮下注射(0.3mL/100g体质量),共9周。造模开始前2周均以20%猪油、0.5%胆固醇、79.5%玉米面混合饲料(由河北医科大学动物实验中心加工)喂养,第3~9周以0.5%胆固醇和99.5%玉米面混合饲料(由河北医科大学动物实验中心加工)喂养。整个造模期间以30%乙醇作为饮料让大鼠自由饮用。正常组则以正常饲料和纯净水喂养。实验第9周末,确认造模成功后予以分组治疗。
2.2 分组与治疗造模成功后,正常组随机抽取大鼠10只,将造模成功大鼠随机抽取40只,并分为4组,每组10只,雌雄各半。即:正常组,灌服生理盐水;模型组,灌服生理盐水;柔肝消
2.3 动物取材治疗4周末,于最后1次给药后禁食12h,麻醉状态下腹主动脉取血,3500r/min离心5min,分离血清待检。同时切开腹部迅速剖取肝脏,一部分液氮冷冻,一部分用4%多聚甲醛固定。
2.4 指标检测
2.4.1 肝组织病理形态学观察取用4%多聚甲醛固定的大鼠肝组织,常规石蜡包埋切片,HE染色,光学显微镜观察。
2.4.2 血清Leptin的检测采用放免法,严格按照试剂盒说明操作。
2.4.3 RT-PCR法测定大鼠肝LeptinmRNA表达 (1)采用Trizol提取总RNA,然后测定RNA样品含量及纯度:A260/A280=1.8~2.0间方可使用。(2)RT反应:取总 RNA 2μg,加入RT 反应体系(含 AMV Buffer,dNTPs,Oligo dT Primer,AMV,Rnase Inhibitor等)管中,并用DEPC处理水补足到50μL反应液体积,震荡混匀后短暂离心,加少许矿物油于PCR仪50℃ 30min,99℃ 5min,5℃ 5min。-20℃保存备用。(3)PCR反应:50μL反应体系含Taq DNA聚合酶、dNTPs、上样染料、稳定剂、优化剂、反应缓冲液、逆转录反应产物、上下游引物等。震荡混匀后短暂离心,加少许矿物油于PCR仪扩增。反应条件:变性94℃,30s,退火 61℃,30s,延伸 72℃,30s,30 个循环,最后延伸 10min。(4)半定量分析:取每个标本的扩增产物6μL于1%的含GV核酸染料的琼脂糖凝胶电泳,以DNA Marker(DL2000)作为标准分子量标记,电泳后于紫外透射仪观察,并用数码相机照相,输入微机应用法国VL公司BIO-PROFIF凝胶图像分析系统对目的电泳条带进行分析,以相应的内参电泳条带作为参照,结果以两者之积分吸光度的比值表示。
2.5 统计学处理数据以(±s)表示,运用SPSS 11.5统计软件,采用方差分析、Student-Newman-Keul检验。
3 结果
3.1 肝组织病理形态学改变正常组大鼠肝组织结构完整、清晰,肝小叶结构正常,肝细胞排列规则成索状,在中央静脉周围呈放射状分布。肝血窦结构清晰,无异常改变。肝细胞呈多边形,胞浆均匀,细胞核形态正常。模型组大鼠肝小叶正常结构消失,间质内弥漫性淋巴细胞浸润。肝细胞体积明显增大,局部肝细胞出现严重的脂肪变性,可见到再生的肝细胞(双核)。肝间质广泛纤维组织增生,将正常肝小叶分割成大小不等的肝细胞团(即假小叶形成)。高剂量组大鼠肝小叶结构轻度受损,少数肝细胞气泡样变性,偶见坏死细胞,较少炎性细胞浸润,少量纤维组织增生,但未见形成间隔。低剂量组肝小叶结构被破坏,部分肝细胞气泡样变性并伴有细胞坏死,较多淋巴、单核细胞浸润,纤维组织增生,但较少形成间隔。阳性药对照组与低剂量组基本相似。
见表1。与正常组相比,模型组大鼠血清Leptin的含量异常升高 (P<0.01),给药后,各治疗组均能显著降低血清Leptin的含量(P<0.01),且柔肝消饮高剂量组Leptin的含量低于低剂量组和对照组(P<0.01),而柔肝消饮低剂量组与阳性药对照组之间差异无统计学意义(P>0.05)。
见表1、图1、图2。RT-PCR后,琼脂糖凝胶电泳,在420bp、577bp处分别显示出Leptin和β-actin电泳带,与预期结果一致。模型组大鼠Leptin mRNA的表达显著高于正常组 (P<0.01)。给药后,各治疗组Leptin mRNA的表达显著低于模型组(P <0.01),柔肝消饮高剂量组Leptin mRNA的表达低于柔肝消饮低剂量组和阳性药对照组(P<0.05),而柔肝消饮低剂量组与阳性药对照组之间差异无统计学意义(P>0.05)。
表1 各组大鼠血清Leptin含量和肝组织Leptin mRNA的表达情况(±s)

表1 各组大鼠血清Leptin含量和肝组织Leptin mRNA的表达情况(±s)
与模型组比较,*P<0.01;与阳性药对照组比较,△P<0.05,△△P<0.01;与柔肝消饮高剂量组比较,▲P<0.05,▲▲P <0.01
组别正常组模型组柔肝消n饮高剂量组柔肝消饮低剂量组阳性药对照组10 10 10 10 10 Leptin(ng/mL)0.54±0.09*2.08±0.29 0.99±0.14*△△1.38±0.25*▲▲1.52±0.19*Leptin/β-actin mRNA 0.285±0.023*1.212±0.109 0.649±0.594*△0.818±0.123*▲0.857±0.114*
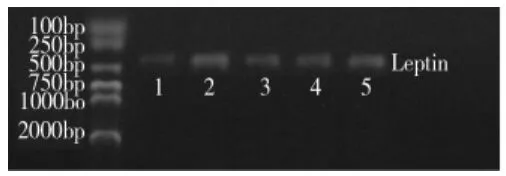
图1
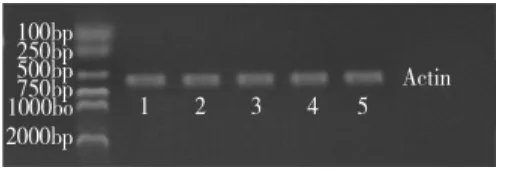
图2
4 讨论
Leptin是由肥胖基因编码的一种多肽类激素,除全身的脂肪组织外,肝脏、胃黏膜、胎盘、胎儿心脏、骨骼肌、骨及软骨组织等均可以分泌Leptin[7]。Letin受体分布广泛,是一种多靶器官、多功能的激素,具有广泛的生物学效应,它参与糖、脂肪及能量代谢的调节,促使机体摄食减少,增加能量释放,抑制脂肪细胞的合成,抑制胰岛素的分泌[8]。自 Potter等[9]发现活化的肝星状细胞(HSCs)中Leptin mRNA和蛋白质合成增加之后,Leptin与肝脏疾病的关系逐渐引起重视。大量动物实验证明,瘦素可通过调节HSC对细胞因子及胶原的表达促进肝纤维化进程[10]。Bolukbas等[11]发现进展期肝病患者的血清Leptin水平明显升高。近年来研究显示:慢性肝病时激活的HSCs产生Leptin,Leptin又进一步促进HSCs的增殖与活化,导致Letin水平明显升高。Leptin通过与库普弗细胞、SECs上的瘦素受体结合,提高库普弗细胞、肝窦内皮细胞中细胞因子TGF-β1的表达,导致胶原的大量产生及肝硬化的形成[4]。
肝硬化根据临床表现可归属于中医学“胁痛”、“积聚”、“臌胀”等范畴。中医学认为本病多由酒食不节,损伤脾胃,脾失健运,壅阻气机,肝失条达,气血郁滞,或情志抑郁,肝失疏泄,气郁日久,血流不畅,瘀血停积,胁络痹阻所致。其病位在肝脾两脏,主要病机为肝郁脾虚、气滞血瘀。故当以疏肝健脾,行气活血,逐瘀消为主要治法。课题组经多年临床观察,精心筛选相关药物组成“柔肝消饮”。方中香附、青皮疏肝理气,炙黄芪、炒白术健脾益气,四药相合,共达抑肝扶脾之效;炙黄芪、炒白术益气健脾;三棱、莪术、地鳖虫、丹参、郁金、姜黄破血行气,逐瘀消;白芍养血柔肝,既可助香附、青皮疏肝解郁之力,又可防止破血太过之弊;诸药合用,共奏疏肝健脾,行气活血,逐瘀消之功效。
本实验研究表明,模型组大鼠血清Leptin含量异常升高,肝脏Leptin mRNA表达明显增强(P<0.01),显示肝硬化的发生与发展与Leptin的分泌与释放有密切关系。经过治疗,各治疗组大鼠血清Leptin含量明显降低,肝脏Leptin表达减弱,说明柔肝消饮通过抑制HSCs分泌Leptin,以达到抗肝硬化的作用,这可能是其治疗肝硬化的分子机制之一。
[1]杨牧祥,张一昕,王少贤,等.柔肝消饮对肝硬化大鼠肝功能的影响[J]. 中医药通报,2007,6(3):58-59.
[2]杨牧祥,张一昕,王少贤,等.柔肝消饮对肝硬化大鼠肝组织病理形态学和肝细胞超微结构的影响 [J].中西医结合肝病杂志,2008,18(1):38-42.
[3]郑吉敏,姜慧卿,李芳,等.肝硬化患者血清瘦素水平变化及相关因素分析[J]. 山东医药,2008,48(40):10-11.
[4]张宏力,赵东强,王和.瘦素与肝硬化 [J].临床荟萃,2009,29(8):729-730.
[5]李仪奎,王钦茂,周金黄.中药药理实验方法学[M].上海:上海科学技术出版社,1991:463-464.
[6]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1991:458.
[7]Levin N, Nelson C, Gurney A, et al.Decreased food intake does not completely account for adiposity reduction after ob protein infusion[J].Proc Natl Acad Sci,1996,93(4):1726-1730.
[8]Potter JJ,Womack L,Mezey E,et al.Transdifferentiation of rat hepatic stellate cells results in leptin expression[J].Biochem Biophys Res Com-mun,1998,244(1):178-182.
[9]Lin J, Barb CR, Matteri RL, et al.Long form leptin receptor mRNA expression in the brain, pituitary, and other tissues in the pig[J].Domest Anim Endocrinol,2000,19(1):53-61.
[10]白平平,朴云峰.瘦素与肝星状细胞[J].临床肝胆病杂志,2006,22(6):461-462.
[11]Bolukbas FF,Bolukbas C,Horoz M,et al.Child-Pugh classification dependent alterations in serum leptin levels among cirrhotic patients:a case controlled study [J].BMC Gastroenterol,2004,4(1):23.

