脂多糖诱导人支气管上皮细胞β防御素-3表达的时效和量效性
李 嘉, 张 兵, 钟礼立, 王曼知
2.湖南省人民医院儿科。
近年来,由于细菌耐药株的日益增多,从新的角度研发抗感染物质,成为全球医药界面临的紧迫问题,抗菌肽的研究为这一问题的解决带来了希望。人 β防御素-3(human β-defensin-3,hBD-3)是最为引人注目的抗菌肽。它不仅具有广谱抗微生物活性,而且能通过 Toll样受体(Toll-like receptors,T LR)的介导,连接先天和获得性免疫应答,保护黏膜和上皮细胞免受感染[2],成为抗感染研究热点之一。但由于外源性 hBD-3获取难度大、费用昂贵[3],在体内的活性可能被体液抑制[4]等原因,难以应用于临床,故探索适当的内源性hBD-3诱导途径成为该领域研究的重点。因此,了解内源性hBD-3的表达与诱导物的浓度以及诱导时间长短的关系有积极意义。急性呼吸道感染是我国儿童的常见病,所以,本研究以人支气管上皮细胞为对象,选择多种革兰阴性菌细胞壁的主要成分脂多糖(lipopolysaccharide,LPS)为诱导物,观察不同浓度、不同时间LPS诱导人支气管上皮细胞后hBD-3的表达变化,为人工诱导、调控内源性hBD-3的表达增强其在体内的抗菌活性,从而为治疗呼吸道感染打下基础。
材料与方法
一、材料
(一)细胞株 人支气管上皮细胞(HBEC)(购自中南大学湘雅医学院湘雅细胞中心)。
(二)主要试剂 新生牛血清(FCS)(杭州四季青公司),1640(美国 GIBCO公司),LPS(E.coli L2880)及琼脂糖(Sigma公司),T rizol(invitrogen公司),RT试剂盒(Fermentas公司),TAG酶及dNTP(tiangen公司),二乙基焦碳酸酯(DEPC)(北京鼎国生物技术公司),hBD-3引物及阳性对照β-actin引物由上海英骏生物工程技术服务有限公司合成,兔抗人hBD-3抗体(absun公司),辣根酶标记山羊抗兔IgG(北京中杉公司)。
二、方法
(一)实验分组 生长良好人支气管上皮细胞随机分为5组,分别为对照组和4个不同浓度LPS组。其中,对照组加入含10%FCS的1640培基5 mL,LPS组又分为4组,分别加入含 LPS浓度为0.01、0.1、1和10 mg/L的10%FCS的1640培基5 mL,各组均置于培养箱(37℃,5%CO2)中培养,然后在诱导4 h后行免疫细胞化学染色检测hBD-3蛋白的表达;分别在诱导 1、2、4和8 h后行 RT-PCR检测hBD-3 mRNA的表达。
(二)免疫细胞化学检测hBD-3蛋白的表达取生长良好的支气管上皮细胞,0.25%胰蛋白酶消化后,调细胞浓度为1×107个/mL,细胞悬液接种在预先放置清洁无菌干燥盖玻片的6孔板中,放入37℃含5%CO2培养箱中培养,24 h后倒置显微镜下见细胞贴壁。对照组和LPS组(0.1 mg/L)分别诱导4 h后检测蛋白表达。一抗为兔抗人hBD-3抗体(1∶100稀释),二抗为辣根酶标记山羊抗兔IgG。对照组用PBS代替一抗。
(三)RT-PCR检测 hBD-3mRNA的表达 取不同实验组的支气管上皮细胞,分别在LPS诱导1、2、4和8 h后采用Trizol法抽提RNA。依吸光度值,取等量总 RNA进行反转录,含1 μ L随机引物,2 μ L dNTP,1 μ L 反转 录酶(MMLV), 总体积 20 μ L。反应条件为:70 ℃5 min,37 ℃5 min,42℃60 min,70℃10 min。以反转录产物为模板,采用Tag酶,按以下程序进行 PCR。上游引物为:5′-AGCCTAGCAGCTATGAGGATC-3′,下 游 引 物为 :5′-CTTCGGCAGCAT TT TCGGCCA-3′,产 物长206 bp。反应条件为:98℃预变性5 min,再经94℃变性30 s,58℃退火30 s,72℃延伸30 s共32个循环,最后72℃延伸7 min。产物在2%琼脂糖凝胶上电泳。同时设阳性对照β-actin,产物长450 bp。
三、统计学处理
结 果
一、免疫细胞化学染色检测hBD-3蛋白表达
对照组人支气管上皮细胞中hBD-3蛋白有微量表达,胞质呈淡棕色颗粒。用0.1 mg/L的LPS诱导细胞4 h后,用hBD-3多克隆抗体染色,可见培养的支气管上皮细胞胞质中hBD-3蛋白明显表达,呈棕褐色阳性颗粒,结果见图1。
二、RT-PCR检测hBD-3 mRNA的表达
(一)对照组人支气管上皮细胞hBD-3 mRNA的表达 发现对照组人支气管上皮细胞中 hBD-3 mRNA有微量表达,不同时间组间(1、2、4和8 h)差异无统计学意义,结果见表1、图2。
(二)LPS诱导人支气管上皮细胞hBD-3mRNA表达的量效关系 用不同浓度的LPS(0.01、0.1、1、10 mg/L)诱导人支气管上皮细胞后,在每个相同时间点(1、2、4和8 h)hBD-3mRNA表达均随之增多,且在上述浓度范围内呈剂量依赖型,不同浓度组间比较差异有统计学意义(P<0.01),结果见表1、图3。

图1 hBD-3蛋白表达的免疫细胞化学染色结果FIG.1.The immunocytochemical stain showing hBD-3 expression

图2 对照组HBEC hBD-3mRNA的表达FIG.2.The expression of hBD-3 mRNA in HBECs in control group
(三)LPS诱导人支气管上皮细胞hBD-3mRNA表达的时效关系 每一相同浓度LPS(0.01、0.1、1和10 mg/L)在诱导人支气管上皮细胞不同时间(1、2、4和8 h)后,随时间增加hBD-3 mRNA表达量亦增加,在同一浓度组呈时间相关性,不同时间组间比较差异有统计学意义(P<0.01)。hBD-3 mRNA表达的半定量结果以hBD-3/β-actin吸光度的相对值计算,结果见表1、图4。
(四)LPS浓度与hBD-3 mRNA表达的相关性从图5可见,每个相同时间点LPS浓度与hBD-3mRNA 表达呈正相关(1、2、4和8 h的r=0.98,P<0.01)。同一浓度下,LPS诱导人支气管上皮细胞8 h后所产生的hBD-3 mRNA明显高于1 h组,并且这种差距随诱导浓度增加而增大。

图3 LPS诱导HBEC不同时间后hBD-3mRNA的表达FIG.3.The expression of hBD-3 mRNA in HBECs induced by LPS for different times
表1 不同浓度 LPS不同时间点hBD-3mRNA的表达(±s)(n=8)Table 1.The mRNA expression of hBD-3 at different time points after stimulation by different concentrations of LPS(±s)(n=8)
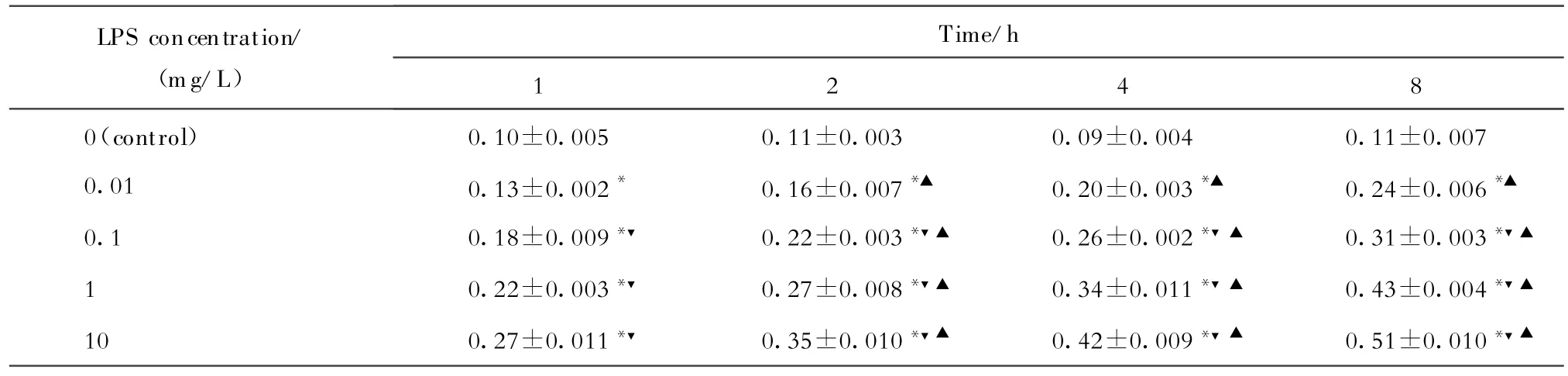
表1 不同浓度 LPS不同时间点hBD-3mRNA的表达(±s)(n=8)Table 1.The mRNA expression of hBD-3 at different time points after stimulation by different concentrations of LPS(±s)(n=8)
*P<0.01 versus control;▼P<0.01 versus the previous lower concentration;▲P<0.01 versus the previous time point.
0(control) 0.10±0.005 0.11±0.003 0.09±0.004 0.11±0.007 0.01 0.13±0.002* 0.16±0.007*▲ 0.20±0.003*▲ 0.24±0.006*▲0.1 0.18±0.009*▼ 0.22±0.003*▼▲ 0.26±0.002*▼▲ 0.31±0.003*▼▲1 0.22±0.003*▼ 0.27±0.008*▼▲ 0.34±0.011*▼▲ 0.43±0.004*▼▲10 0.27±0.011*▼ 0.35±0.010*▼▲ 0.42±0.009*▼▲ 0.51±0.010*▼▲

图4 不同浓度LPS诱导HBEC不同时间后hBD-3mRNA的表达FIG.4.The expression of hBD-3 mRNA in HBECs induced by different concentrations of LPS for different times

图5 LPS浓度与hBD-3 mRNA表达的相关关系FIG.5.Relationship between LPS concentration and the expression level of hBD-3 mRNA
讨 论
宿主的防御功能和病原体毒力的相互作用是感染发生、发展和转归的关键。细菌除具有毒力外,还需要足够的数量才能引起感染。细菌数量越多,释放的毒素越多,产生的毒力越强,炎症反应越重。本研究选择不同浓度LPS诱导人支气管上皮细胞,是为了研究不同数量的细菌毒素在人体下呼吸道产生的炎症反应所导致hBD-3表达强弱的变化,从而探讨如何采用可调控方式诱导其分泌;选择不同诱导时间是为了了解hBD-3表达在诱导后何时起效,持续的时间多长。
本研究利用多种革兰阴性菌死亡后释放的产物LPS诱导人支气管上皮细胞,观察hBD-3能否被诱导表达。通过免疫细胞化学染色我们发现,人支气管上皮细胞胞质中有淡棕色颗粒,有微量hBD-3蛋白表达;用一定浓度的LPS诱导4 h后,可见培养的支气管上皮细胞胞质中有棕褐色阳性颗粒,hBD-3蛋白表达明显,证实hBD-3在人支气管上皮细胞有表达并能被诱导。
本研究采用半定量RT-PCR发现,LPS在一定浓度范围(0.01~10 mg/L)内诱导hBD-3mRNA的表达呈剂量依赖性;每一相同时间点LPS浓度与hBD-3 mRNA表达呈正相关;同一浓度下,LPS诱导人支气管上皮细胞8 h后所产生的hBD-3 mRNA明显高于1 h组,并且这种差距随诱导浓度增加而增大。推测随着细菌数量增多,毒素增多,感染加重,hBD-3分泌亦增加,机体抵抗细菌感染的能力也增加,可能在局部免疫防御反应中起着重要作用。本研究诱导物的剂量范围为0.01~10 mg/L,是参考了廖伟等[5]的报道,当剂量<0.01 mg/L时,机体是否会被诱导表达,>10 mg/L时,是否会引起过激反应而对机体有害,目前尚不清楚,有待我们进一步研究。
本研究中,我们利用LPS诱导人支气管上皮细胞后,用RT-PCR检测不同时间细胞中hBD-3的表达水平。发现hBD-3 mRNA在诱导后1 h即有较强表达,并随着时间增加表达亦随之上调,在一定时间范围(1~8 h)内呈时间相关性,表明hBD-3 mRNA的诱导表达具有明显的时效关系。推测当细菌侵袭下呼吸道时,hBD-3在短时间内即可诱导表达,是一个即早应答事件,参与气道最初的防御反应。在没有LPS诱导下,人支气管上皮细胞在不同时间点所产生的hBD-3 mRNA差异无统计学意义,推测正常人体内支气管上皮细胞hBD-3呈恒定表达,细菌感染在诱导hBD-3表达中占据重要地位,一旦机体受到外界病原体入侵时,即可能通过自身防御机制增强hBD-3表达,起到抗感染作用。
钟小林等[6]在用 LPS诱导小鼠心、肝、脾、肺、肾各组织后,仅在肝脏组织中检测到hBD-3 mRNA的表达,并在注射后6 h才出现,8、10 h达峰值,12 h后表达水平下降。本研究与之相比,诱导表达时间出现较早,考虑与hBD-3在呼吸道上皮细胞中表达相对较多以及不同物种和细胞中信号传导途径可能不一样有关。本研究未看到hBD-3表达的衰减,可能因观察时间尚不够长所致。在下一步的研究中,可进一步观察随时间增加hBD-3表达的变化及有无衰减的过程,为研究hBD-3治疗的时间窗及药动学打下基础。
hBD-3乃至抗菌肽功能的深入研究需得到有活性的肽,在抗菌过程中真正起作用的也是蛋白。急性时相反应蛋白在疾病的早期辅助诊断和监测以及对机体的保护作用中至关重要。相对于钟小林等[6]仅从基因水平上研究hBD-3的表达不同,本课题的前期研究中还从蛋白水平研究了hBD-3表达的变化,同样发现正常人支气管上皮细胞中hBD-3蛋白有微量表达[7],用不同浓度LPS诱导培养的上皮细胞,4 h后即出现hBD-3蛋白的明显表达,并在一定范围内呈剂量依赖性。进一步说明了 hBD-3与LPS的剂量依赖关系,为以后hBD-3作为抗菌物质的使用打下基础。
[1] Koczulla A R,Bals R.Antimicrobial peptides:current status and therapeutic potential[J].Drugs,2003,63(4):389-406.
[2] Harder J,Bartels J,Christophers E,et al.Isolation and characterization of human beta-defensin-3,a novel human inducible peptide antibiotic[J].J Biol Chem,2001,276(8):5707-5713.
[3] 庹晓晔,徐明达,陈璧,等.人β防御素3在大肠杆菌中的融合表达及其抗微生物活性的初步分析[J].军事医学科学院院刊,2004,28(2):114-122.
[4] Maisetta G,Di Luca M,Esin S,et al.Evaluation of the inhibitory effects of human serum components on bactericidal activity of human beta-defensin-3[J].Peptides,2008,29(1):1-6.
[5] 廖伟,钱桂生,雷撼.脂多糖及前炎症细胞因子诱导人原代气道上皮细胞β防御素-2表达的实验研究[J].中国呼吸与危重监护杂志,2007,6(2):127-130.
[6] 钟小林,杨卫华,周建新,等.小鼠β防御素-3基因表达调控的初步研究[J].重庆医学,2004,33(6):841-844.
[7] 李嘉,张兵,钟礼立.不同浓度脂多糖诱导人支气管上皮细胞β防御素3的表达[J].中国当代儿科杂志,2009,11(7):577-580.

