富血小板血浆对人牙周膜成纤维细胞在脱矿病变牙根表面增殖及分化的影响
高 丽 ,马叶华 ,何权敏 ,张 剑 ,刘 琪
(1.遵义医学院附属口腔医院口腔内科,贵州遵义563003;2.江苏省宜兴市牙病防治所,江苏宜兴214200)
牙周组织再生需要形成新附着,而新附着的形成是一个复杂的过程,它包括了牙周组织细胞和胞外基质在时间和空间上的协作[1],涉及牙周组织细胞的迁移、附着及增殖;而新附着形成的首要条件是PDLFs在牙骨质表面的附着与增殖,在这一过程中起主要调控作用的是细胞因子和生长因子[2]。PRP是血液经离心后获得的含有较丰富的生长因子,其中以TGF-β和PDGF所占比例最大,而且,自体PRP克服了免疫原性和传染疾病的可能性。且体外实验结果显示,PRP可以促进牙周细胞在病变牙根表面的附着、增殖及细胞外基质胶原的形成[3,4],本实验旨在研究不同浓度PRP在不同时间内对人牙周膜成纤维细胞在脱矿的病变牙根表面附着、增殖及对碱性磷酸酶活性的影响的情况,以进一步阐明PRP促进牙周组织再生的机制,为将PRP应用于临床奠定理论基础。
1 材料与方法
1.1 主要试剂与仪器 新鲜全血(遵义医学院中心血库)、标准胎牛血清(中国医学科学院生物工程研究所)、DMEM 培养基 (SIGMA,USA)、CO2培养箱(Shel Lab,USA)、洁净工作台(北京冠鹏净化设备有限公司)、倒置相差显微镜及照相系统(Olympus,JAPAN)、Centrifuge 5804R高速冷冻离心机(eppendorf,Germany)、Sysmex KX-21N 全自动血液分析仪(Germany)、噻唑盐(Biomol,USA)、对硝基磷酸二钠(p-Nitrophenyl Phosphate Disodium,pNPP,Sigma,美国)48孔板和96孔板(Becton Dickinsen Labware)、酶联免疫检测仪(BIO-TEK INSTRUMENTS.INC)。
1.2 实验方法
1.2.1 hPDLFs的体外培养鉴定 采用组织块法培养进行原代培养,选取因正畸需要、年龄在12至15岁之间、新鲜拔除的健康前磨牙,刮取根中1/3牙周膜组织,剪成1mm3大小,平铺于25mL培养瓶瓶底,加入2mL DMEM培养液(为含25%胎牛血清,100U/mL青霉素,100U/mL链霉素置于饱和湿度、5%CO2、95%空气、37℃的标准坏境下)中培养,倒置相差显微镜下观察细胞的生长状况,待细胞长满瓶底的85%时加入预热至37℃的0.25%胰蛋白酶消化并进行传代,取第5代细胞用于实验,实验前利用免疫组化ABC法进行细胞胞浆波形丝蛋白和角蛋白染色,作细胞来源鉴定。
1.2.2 hPDLFs的形态学观察 从原代开始逐日在倒置相差显微镜下观察hPDLFs形态变化特征、生长状况并照相。
1.2.3 牙根片的制备 取因重度牙周炎拔除的患牙(纳入标准:牙周探诊深度>5mm,附着丧失>5mm,X线片显示牙槽骨吸收至少达根尖1/3,患者年龄40岁至65岁,无全身系统性疾病,牙周基础治疗史,根面无龋坏及充填物),用刮治器轻轻刮净附在根面上的软组织,取根中1/3段,在冷水冷却的条件下用金刚砂片磨成4mm x 4mm大小、lmm厚(只磨除牙本质侧,牙骨质侧不磨)的根片,以240g/L的EDTA脱矿处理2min,将收集的根片高压后放入DMEM培养液中浸泡48h后待用。
1.2.4 富血小板血浆(PRP)的制备 采用GONSHOR[5]的方法。富血小板血浆的制作全过程严格无菌,取新鲜全血(已加入抗凝剂),经两次离心法提取PRP,第一次离心(1300 r/min)10min,吸取全部上清液及交界面以下1~2mm的红细胞至另一离心管,弃去下层红细胞,再次离心(2000 r/min)10min,可见管底部有白色沉淀,掺杂少许红细胞,上层液体清亮,缓缓吸出上层液体,留2~4mL液体与底部沉淀,将上层液体与沉淀用吸管吹打均匀,所得混合液即为PRP。将所取的PRP一部分收集于EP管,贮存在-20℃环境下备用。另一部分PRP与10%的氯化钙及牛凝血酶以体积比9:1混合,4℃冰箱过夜,待血凝块收缩后,低温下,再次离心(10000r/min)10min,吸取上清液于EP管,0.22μm微膜过滤后,贮存于-20℃环境下备用。
1.2.5 不同浓度PRP在不同时间内对hPDLFs在脱矿的病变牙根表面增殖的影响
1.2.5.1 实验分组 设对照组与实验组,对照组为含10%FBS的DMEM培养液,实验组分别为含10%PRP、15%PRP、20%PRP、30%PRP 的 DMEM 培养液,每组设5个复孔。
1.2.5.2 24h内不同浓度PRP对hPDLFs在脱矿的病变牙根表面增殖的影响 将脱矿处理的根片用双面胶固定在96孔板底部,放入超净台中紫外线光照2h。实验各组根片包被5μl PRP,自然干燥,紫外光照30min,取生长良好的第五代hPDLFs,更换为无血清的DMEM培养液中,CO2孵箱内标准环境下培养24h,使细胞相对同步化,用0.25%的胰蛋白酶消化3min左右,弃去消化液,加入含10%FBS的DMEM培养液3mL,反复吹打,制成单细胞悬液计数,调整细胞浓度为2×105,取100μL接种至已加入牙根片的96孔培养板,待细胞贴壁后弃上清液,按实验分组分别加入含不同浓度PRP培养液,标准环境下孵育24h后,每孔加20μl的CCK-8,继续孵育4h,用酶联免疫检测仪在450nm波长下检测各孔OD值,每组设5个复孔。
1.2.5.3 不同时间内PRP对hPDLFs在脱矿的病变牙根表面增殖的影响 同上方法取最佳浓度组,以含10%FBS的DMEM培养液为对照组,调整细胞浓度为1.5×104,每48小时更换培养液一次,观察1wk内人hPDLFs增殖的情况。每孔设5个复孔。
1.2.5.4 24h内PRP对hPDLFs ALP活性影响的测定 同1.2.5.2方法,取不同浓度的PRP培养细胞24h后,弃培养液,加入 100μL的 0.2%Triton X-100裂解细胞,再加入100μl标准pNPP底物液,37℃孵育30min,以NaOH终止反应;用酶联免疫检测仪在405nm波长下检测各孔及空白对照孔OD值。每孔设3个复孔;标准ALP为阳性对照,经系列稀释后得出标准曲线,计算ALP活性(U/mg蛋白)。
2 统计学处理
采用SPSS13.0软件对所有数据进行统计学分析,同一时间点的各组数据之间采用单因素方差分析(one-way analysis of variance,ANOVA),同一组的不同时间点之间采用配对t检验;P<0.05表示有统计学意义。
3 结果
3.1 hPDLFs的生物学特征 倒置显微镜下观察,原代细胞约7d从组织块周围游出,呈放射状生长。细胞呈长梭形,胞浆突2到4个,胞体丰满,胞浆均匀,胞核椭圆形(图1,图2)。免疫组化染色表明该细胞波形丝蛋白染色阳性,角蛋白染色阴性,证实为中胚层来源的细胞,加之取材部位,可以肯定所培养的细胞为hPDLFs。
3.2 24h不同浓度PRP对hPDLFs在脱矿的病变牙根表面增殖的影响结果见表1,24h时各浓度PRP组细胞量均高于对照组(P<0.05),其差异具有统计学意义;随着PRP浓度的增加,细胞增殖亦随之增加,当PRP浓度达到20%时,细胞增殖效应达到最佳,而随着PRP浓度的继续增加,细胞增殖效应呈下降趋势。
3.3 不同时间内20%PRP对hPDLFs在脱矿病变牙根表面增殖的影响 结果见表2,在同一时间点,20%PRP组的细胞量均高于对照组;20%PRP随着与细胞作用时间的增加,其促进细胞增殖的作用亦愈强,当20%PRP与细胞作用时间达6d时,其增殖效应达到最佳。
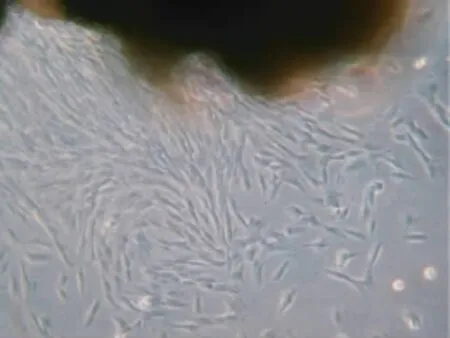
图1 原代细胞在组织块周围呈放射状生长×100

图2 第五代细胞细胞呈长梭形×100
3.4 24h内不同浓度PRP对hPDLFs ALP活性的影响 结果见表3,各种浓度的PRP组中人牙周膜成纤维细胞的碱性磷酸酶活性均高于对照组(P<0.05),且与PRP浓度成正比,其中以20%PRP组的hPDLFs碱性磷酸酶活性最高(P<0.05)。
表1 24h不同浓度PRP对hPDLFs在脱矿的病变牙根表面增殖的影响(s,n=5)

表1 24h不同浓度PRP对hPDLFs在脱矿的病变牙根表面增殖的影响(s,n=5)
*表示与对照组相比P<0.05,△表示实验组各组之间比较P<0.05
group(n=5)OD 值(s)10%FBS 0.4374±0.1492 10%PRP 0.5007±0.0638*△15%PRP 0.5504±0.0630*△20%PRP 0.6029±0.0706*△30%PRP 0.6002±0.2963*
表2 不同时间内20%PRP对hPDLFs在脱矿病变牙根表面增殖的影响(s,n=5)

表2 不同时间内20%PRP对hPDLFs在脱矿病变牙根表面增殖的影响(s,n=5)
注:同一时间点时,FBS与PRP比较,*表示P<0.05;PRP组在不同时间点与第6天比较,△表示P<0.05
细胞量10%FBS 20%PRP 1 0.2942±0.0258 0.39±0.0058△*2 0.3120±0.0447 0.44±0.0148△*3 0.3524±0.0230 0.47±0.0286△*4 0.4126±0.0336 0.52±0.0158△*5 0.4438±0.0319 0.57±0.0364△*6 0.4754±0.0610 0.62±0.0258*7 0.4616±0.0680 0.62±0.0594*时间(天)
表3 不同浓度PRP对hPDLFs ALP活性的影响(s,n=3)

表3 不同浓度PRP对hPDLFs ALP活性的影响(s,n=3)
注:与DMEM组比较,*表示P<0.05;各浓度PRP组与20%PRP组比较,△表示P<0.05
ALP活性DMEM 76.440±1.736 10%PRP 110.966±4.545*△15%PRP 136.560±1.759*△20%PRP 166.332±2.196*30%PRP 166.870±4.191*
4 讨论
研究表明,牙周病在通过有效治疗后,牙周膜成纤维细胞应首先附着于牙骨质表面,才能实现牙周组织的新生及牙周新附着的形成[3]。因此如何促进牙周膜成纤维细胞附着于病变牙根面已成为众多学者的研究热点,其中生长因子对牙周组织新附着的形成是目前关注的热点之一。
在牙周组织再生中,生长因子能促进牙周组织细胞的附着、增殖、趋化及细胞外基质的形成[6,7],Parkar[8]等的研究结果显示再生牙周组织中血小板衍化生长因子(PDGF)和转化生长因子(TGF-β)受体均有较强表达。已有的研究证实PDGF对迁移到愈合创面的细胞具有有丝分裂作用[9],PDGF趋化这些细胞到达创面后,进一步促使其分化、增殖,从而加速创伤的愈合。Cho[9]等的研究结果表明PDGF在牙周组织创口愈合早期可促使新分化的PDLFs沿牙根面迁移,这不仅能促进牙周组织的再生,还能避免牙根与牙槽骨粘连在一起,并可避免牙根吸收。Oates和Dennison等[10,11]研究了TGF-β对牙周膜成纤维细胞的影响,表明人牙周膜成纤维细胞的增殖与TGF-β呈剂量依赖性和时间依赖性。但是,实验研究中所应用的多是外源性生长因子,单一或两种生长因子,与体内实际情况相差较大,且外源性生长因子与机体的相容性尚不清楚,不同类型生长因子的最佳配伍及最适浓度都有待于进一步研究。
自体PRP是血液通过离心后获得的血小板浓缩物,它克服了免疫原性和传染疾病的可能性,其中含有较丰富的生长因子,有研究认为PRP中含有的生长因子浓度达到外周血血小板浓度的3倍以上[8],其中TGF-β和PDGF所占比例最大;PRP不但能促进牙周细胞在病变牙根表面的附着、增殖,而且还能促进牙周细胞的增殖和细胞外基质胶原的形成,更接近体内的实际情况[5]。
本实验观察不同浓度PRP在不同时间对hPDL Fs的影响,在同一时间内,在10%~20%的浓度范围内,PRP对hPDLFs在病变牙根表面的附着、增殖及对碱性磷酸酶活性的影响呈浓度依赖性,当PRP浓度为30%时,细胞增殖与附着有下降趋势,由此推测当PRP浓度为20%左右时,对hPDLFs在病变牙根表面的附着、增殖及对碱性磷酸酶活性的影响效果达到最佳。这与国内学者林敏魁[12]等研究结果基本一致;分析其可能原因为经PRP包被,PRP首先在牙根表面形成PRP膜,有利于细胞最初的募集和附着,从而更有利于PDLFs在病变牙根表面附着和增殖。在不同时间内,20%PRP对hPDLFs在病变牙根表面的附着与增殖呈时间依赖性,第6天达到最佳,第7天则细胞附着与增殖不明显(P>0.05),推测20%PRP作用于hPDLFs 6d,能促进牙周膜成纤维细胞在病变牙根表面附着,从而为促牙周再生的临床应用提供理论和实验依据。
[1]Lackler KP,Cochran DL,Hoang AM,et al.Development of an in vitro wound healing model for periodontal cells[J].J Periodontol,2000,71(2):226-237.
[2]Rincon JC,Haase HR,Bartold PM.Effect of Emdogain on human periodontal fibroblasts in an in vitro woundhealing model[J].J Periodont Res,2003,38(3):290-295.
[3]刘琪,victor marino,mark bartold.新型牙周再生细胞传递载体的体外建立[J].华西口腔医学杂志,2006,24(1):15-17.
[4]Kazuhiro O,Tomoyuki K,manaba M,et al.Platelet-Rich plasma contain high level of platelet-derived growth factor and transforming growth factor-β and modulates the proliferation of periodontally related cells in vitro[J].J Periodontol,2003,74:849-857.
[5]Gonshor A.Technique for producing platelet-rich plasma and platelet concentrate:background and process[J].Int J periodontics Restorative Dent,2002,22(6):547-555.
[6]Kazuhiro O,Tomoyuki K,manaba M,et al.Platelet-Rich plasma contain high level of platelet-derived growth factor and transforming growth factor–β and modulates the proliferation of periodontally related cells in vitro[J].J Periodontol,2003,74:849-857.
[7]刘琪,Victor M,Mark B.富血小板血浆和贫血小板血浆处理的生物降解膜对牙周韧带成纤维细胞影响的扫描电镜观察[J].牙体牙髓牙周病学杂志,2004,14(8):439-442.
[8]Parkar MH,Kuru L,Giouzeli M,et al.Expression of growth factor receptors in normal and regenerating human periodontal cells[J].Arch Oral Biol,2001,46(3):275-284.
[9]Cho MI,Lin WL,Genco RJ.Platelet-derived growth factormodulated guided tissue regenerative therapy[J].J P-eriodontol,1995,66(6):520-530.
[10]Oates TW,Rouse CA,Cochran DL.Mitogenic effects of growth factors on human periodontal ligament cells in vitro[J].J Periodontol,1993,64(2):142-148.
[11]Dennison DK,Vallone DR,Pinero GJ,et al.Differential effect of TGF-beta 1 and PDGF on proliferation of periodontal ligament cells and gingival fibroblasts[J].J P-eriodontol,1994,65(7):641-648.
[12]林敏魁.富血小板血浆用于牙周组织再生的研究[J].J Clin Stomatal,2003,11(19):11-12.

