Prousion 对氧自由基的清除作用
杨春宝 潘家祜*
1 江西省九江市中国人民解放军第171医院药剂科(332000)
2 上海市复旦大学药学院药理室(200032)
Prousion是一类产自日本的多孔状矿粉,经日本健康促进协会桥本政和博士研究发现具有一定的生物学作用。由桥本政和提供的Prousion-A、B、C (P-A、P-B、P-C)是经3种不同方法处理的这类矿粉。本研究分别采用化学和物理方法对其体外清除羟基自由基和超氧自由基的作用进行测定。
1 材料与方法
1.1 Prousion对羟基自由基(OH·)作用的测定
1.1.1 用脱氧核糖法检测Prousion对羟基自由基的影响[1,2]
Prousion(Prousion由日本桥本政和博士提供):用0.2 %羧甲基纤维素钠(CMC)配成不同浓度的混悬液:0.014、0.007、0.0035、0.00175g/mL。D-脱氧核糖(2'-Deoxy-D-Ribose),AMRESO.Co.Lot:0657;其余试剂均为分析纯试剂。其测定原理为:Fe3+- EDTA与抗坏血酸及H2O2产生·OH,使脱氧核糖降解,在酸性环境中,降解产物可与TBA 反应,形成粉红色物质,在 532nm 处进行比色测定。
1.1.2 用电子自旋共振(Electron Spin Resonance,ESR)直接测定Prousion 对·OH的清除作用[3]
ESR测定仪:ER 200D-SRC,Bruker company.SF = 9.81GHz,SP =20mW,MF = 100kHz,MA = 0.8G; 自旋捕集剂为DMPO,由复旦大学测试中心测定。
表1 Prousion对羟基自由基(·OH)的清除作用 (±s,n = 4)
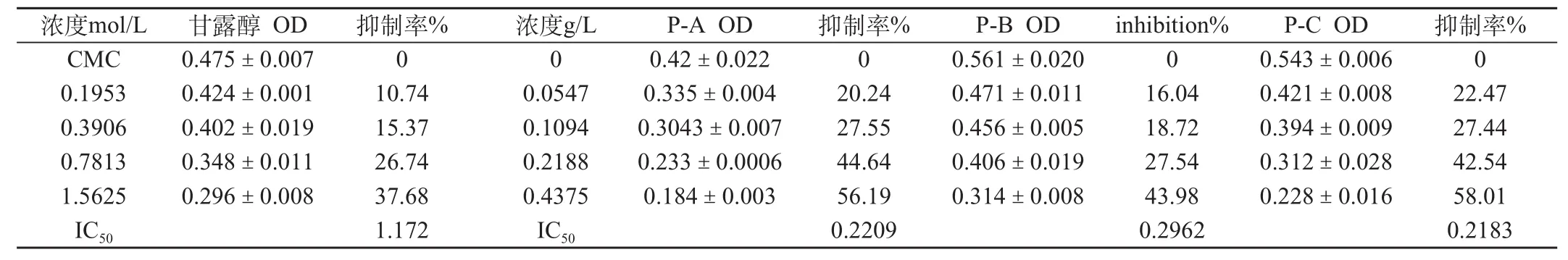
表1 Prousion对羟基自由基(·OH)的清除作用 (±s,n = 4)
浓度mol/L 甘露醇 OD 抑制率% 浓度g/L P-A OD 抑制率% P-B OD inhibition% P-C OD 抑制率%CMC 0.475±0.007 0 0 0.42±0.022 0 0.561±0.020 0 0.543±0.006 0 0.1953 0.424±0.001 10.74 0.0547 0.335±0.004 20.24 0.471±0.011 16.04 0.421±0.008 22.47 0.3906 0.402±0.019 15.37 0.1094 0.3043±0.007 27.55 0.456±0.005 18.72 0.394±0.009 27.44 0.7813 0.348±0.011 26.74 0.2188 0.233±0.0006 44.64 0.406±0.019 27.54 0.312±0.028 42.54 1.5625 0.296±0.008 37.68 0.4375 0.184±0.003 56.19 0.314±0.008 43.98 0.228±0.016 58.01 IC50 1.172 IC50 0.2209 0.2962 0.2183
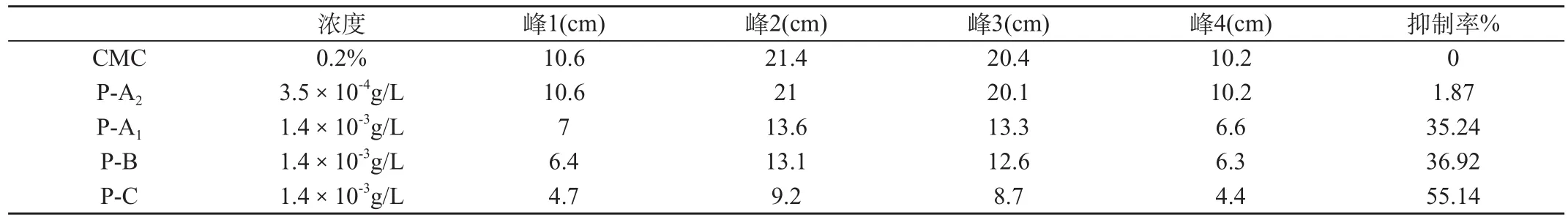
表2 ESR检测 Prousion 清除羟基自由基的作用
表3 Prousion对超氧自由基的清除作用 (±s,n = 4)

表3 Prousion对超氧自由基的清除作用 (±s,n = 4)
(g/L) P-A OD 抑制率% P-B OD 抑制率% P-C OD 抑制率%CMC 0.38±0.002 0 0.375±0.009 0 0.432±0.022 0 0.05645 0.38±0.003 0 0.363±0.005 3.2 0.424±0.005 1.85 0.1129 0.349±0.005 8.2 0.355±0.006 5.33 0.392±0.004 9.26 0.2258 0.29±0.010 23.68 0.329±0.010 12.27 0.345±0.004 20.14 0.4516 0.248±0.006 34.74 0.179±0.017 52.27 0.213±0.003 50.69 IC50 0.4025 0.3854 0.3626
1.2 Prousion对超氧自由基(O2·)作用的测定
1.2.1 用黄嘌呤氧化酶法[4]检测Prousion对超氧自由基的影响
黄嘌呤氧化酶(Xanthine Oxidase),Sigma,Lot: 9904;次黄嘌呤 Hypoxanthine,Sigma,Lot:9712;其余试剂均为分析纯试剂。其测定原理为:次黄嘌呤通过黄嘌呤氧化酶反应系统产生超氧阴离子自由基(O-2·),后者氧化羟胺形成亚硝酸盐,在显色剂-对氨基苯磺酸与萘乙二胺的作用下生成红色重氮化物,在550nm进行比色测定。
1.2.2 用电子自旋共振(Electron Spin Resonance,ESR)直接测定Prousion 对O2·的清除作用
ESR测定仪:ER 200D-SRC,Bruker company.SF = 9.81GHz,SP =20mW,MF = 100kHz,MA = 0.8G;由复旦大学测试中心测定。
1.3 数据处理
2 结 果
2.1 Prousion对羟基自由基(·OH)的清除作用
2.1.1 脱氧核糖法测定Prousion清除羟基自由基的作用,见表1。
上述结果表明,Prousion-A、B、C对羟基自由基(·OH)的IC50分别为0.2209、0.2962和0.2183 g/L,其作用强弱顺序为P-C>P-A>P-B。
2.1.2 ESR的测定结果,见表2和图1。
经ESR测定Prousion对羟基自由基(OH·)的清除作用的强弱顺序为P-C>P-B~P-A。本结果佐证了上述脱氧核糖法的测定结果。
2.2 Prousion对超氧自由基(O2·)的清除作用
2.2.1 黄嘌呤氧化酶法测定Prousion清除超氧自由基的作用,见表3。

图1 ESR检测 Prousion 清除.羟基自由基作用的图谱

图2 ESR检测 Prousion 清除.羟基自由基作用的图谱

表4 ESR检测 Prousion 清除超氧自由基的作用.
上述结果表明,Prousion-A、B、C对超氧自由基(O2·)的IC50分别为0.4025、0.3854和0.3626g/L,其作用强弱顺序为P-C>P-B>P-A。
2.2.2 ESR的测定结果,见表4和图2。
经ESR测定,Prousion对超氧自由基(O2·)的清除作用强弱顺序为P-C>P-B>P-A。本结果也证实了上述黄嘌呤氧化酶法的测定结果。
3 讨 论
为了解Prousion原料的理化性质,我们在复旦大学国家微分析中心采用XL30FEG扫描电镜和能谱分析仪对Prousion原料进行了观察与分析。结果表明:Prousion原料粉末有较好的细度,粒径≤5μm。所含的大多为常量元素,如C、O、Na、Al、Si、K、Ca、Fe等,其中含有一些多孔的微粉。
我们机体在代谢过程中因多种原因产生的氧自由基剧增会对机体细胞产生氧化应激损伤。这种氧化应激损伤以超氧阴离子自由基和羟基自由基为甚。它们也是肿瘤、心血管疾病等许多疾病以及衰老的重要原因。这类氧自由基的检测有多种方法[5-8]。
为探讨Prousion对氧自由基的清除作用,本研究分别采用化学和物理方法对危害较大的超氧自由基和羟基自由基进行检测,即分别采用黄嘌呤氧化酶法和D-脱氧核糖法检测Prousion对这两个氧自由基的清除作用,采用电子自旋共振(ESR)测定仪进行验证。检测结果不仅证明了Prousion对这两种氧自由基的清除作用,而且,通过化学测定,获得了Prousion清除作用IC50的重要参数,ESR测定又为这些重要参数提供了较为一致的佐证。
[1]Laughton MJ,Halliwell B,Evans PJ,et al.Antioxidantand pro-oxidant actions of the plant phenolics quercetin,gossypol and myricetin[J].Biochem Pharmacol,1989,38 (17): 2859-2865.
[2]Ko FN,Liao CH,Hsiung Y,et al.Antioxidant properties of demethyldiisoeugenol[J].Biochimicaet Biophysica Acta,1995,1258(2):145-152.
[3]Schweikert C,Liszkay A,Schopfer P.Polysaccharide degradation by Fenton reaction or peroxidase generated hydroxyl radicals in isolated plant cell walls[J].Phytochemistry,2002,61(1): 31–35.
[4]Oyanagui Y.Reevaluation of assay methods and establishment of kit for superoxide dismutase activity[J].Analytical Biochemistry,1984,142(2): 290-300.
[5]Togashi H,Shinzawa H,Matsuo T,et al.Analysis of hepatic oxidative stress status by electron spin resonance spectroscopy and imaging[J].Free Radical Biol Med,2000,28(6): 846-853.
[6]Sachdev S,Davies KJA.Production,detection,and adaptive responses to free radicals in exercise[J].Free Radical Biol Med,2008,44(2):215-223.
[7]杨芬,张瑞萍,贺玖明,再帕尔·阿不力孜.羟自由基的产生、捕集及检测方法[J].药学学报,2007,42(7): 692-697.
[8]郑晶泉.抗氧化剂抗氧化方法研究进展[J].国外医学.卫生学分册,2000,27(1):37-40.

