抗应激处理对肉牛引入后发病的影响
彭清洁,石 磊,毛存志,张雅莉,白智迪,胡长敏,邓立新,陈焕春,郭爱珍*
(1.华中农业大学农业微生物学国家重点实验室,湖北武汉430070;2.华中农业大学动物医学院,湖北武汉430070;3.湖北省武汉科前生物制品有限公司,湖北 武汉430070;4.河南农业大学,河南郑州 450002)
肉牛“易地育肥”即传统的肉牛产区饲养繁殖母牛并向其它地区销售架子牛供育肥用已成为我国肉牛生产的一种主要模式。我国南方有大量的荒山草坡及农作物秸杆,具有丰富的饲料资源,但由于南方本地缺少优质肉牛品种及饲养繁殖母牛利润低,育肥用的架子牛主要购自“中原肉牛带”、“北方肉牛带”与其它牧区。因此,“北牛南运”已成为“易地育肥”的重要组成部分。
然而,“北牛南运”后发生的疾病问题严重困扰着南方肉牛业的发展。肉牛引入后半月左右开始发生一种传染病,发病率可达80%,死亡率可高达40%以上。2008年首次鉴定这种病为牛支原体肺炎综合征[1,2],该病是发生于新引入肉牛、由牛支原体(mycoplasma bovis,M.bovis)引起的、以坏死性支气管肺炎为主要特征、继发或并发关节炎、腹泻、结膜炎等多种症状的一种传染性疾病。该病在国外育肥场普遍发生,称为慢性肺炎 多发性关节炎综合征(chronic pneumonia and polyarthritis syndrome,CPPS)[3,4]或牛支原体相关肺炎和多发性关节炎(mycoplasma bovis-associated pneumonia and polyarthritis)等[5,6]。
由于牛支原体肺炎综合征主要发生于新引入肉牛,推测长途运输导致的运输应激是该病发生的重要诱因。为了证实该推测,本研究对两批长途运输牛进行了不同的处理,第一批牛进行了牛支原体灭活疫苗免疫,第二批牛进行了盐酸氯丙嗪注射,全程跟踪运输过程,并在运达后继续临床跟踪1月以上。结果证实,启运前注射盐酸氯丙嗪可以降低牛引入后的发病率。
1 材料与方法
1.1 材料
盐酸氯丙嗪注射液(chlorpromazine hydrochloride injection)购自武汉,由天津药业焦作有限公司生产;牛支原体灭活疫苗由本实验室制备,用实验室分离鉴定的牛支原体进行液体培养,菌浓度108个/mL,0.5%甲醛灭活,加白油乳化而成。
1.2 试验方法
进行两批牛试验,第一批牛试验目的旨在观察启运前免疫在减少或阻止新引入肉牛发病中的作用,第二批牛旨在观察肌肉注射盐酸氯丙嗪在减少或阻止新引入肉牛发病中的作用。牛来自北方交易市场,购牛前对牛进行仔细观察与临床检查,挑选健康牛。侯选牛暂养在某临床观察点上,临床检查健康及连续3d观察无临床异常后决定购买。在此基础上选择试验牛,对牛群分组进行试验。所有牛只运输途中不提供水和任何食物。

表1 第一批试验牛分组及处理情况表
1.2.1 牛支原体灭活疫苗免疫后运输试验 第一批试验牛39头购自吉林省长春市某交易市场,品种为西门塔尔与本地牛的杂交,牛体重200 kg左右。分成两组(表1):即免疫组和对照组,其中免疫组23头,对照组16头。免疫组牛支原体灭活疫苗免疫剂量为2 mL/头,起运前7 d肌肉注射疫苗。免疫牛与对照牛随机装车。运输时间为36 h,运至河南省鄢陵县。
1.2.2 启运前盐酸氯丙嗪肌注后运输试验 第二批试验牛购自黑龙江省哈尔滨市某交易市场。品种为西门塔尔与本地牛的杂交。体重在250~400 kg,共60头。按体重范围分成三群,分别为250~300 kg、300~ 350 kg、350~400 kg,每群各 20头。各群均分为对照组与试验组,各10头。对照牛不做任何处理,试验牛启运前肌肉注射亚治疗剂量的氯丙嗪,按注射剂量分为A处理和B处理。A处理为肌肉注射氯丙嗪0.3 mg/kg,B处理为肌肉注射氯丙嗪0.6 mg/kg。具体分组及处理细节见表2。免疫牛与对照牛随机装车。运输时间为48小时,运至江西省新余县。
1.2.3 血清牛支原体抗体检测 以牛支原体重组蛋白GAPDH作为包被抗原的间接ELISA检测免疫牛的血清牛支原体抗体。按常规ELISA程序进行[7],简述如下:牛支原体重组GAPDH蛋白提纯至电泳纯,按100 ng/孔包被,待检血清200倍稀释,辣根过氧化物酶标记的羊抗牛二抗做5000倍稀释,DAB/H2O2显色,HF终止反应,以OD450值表示抗体水平。
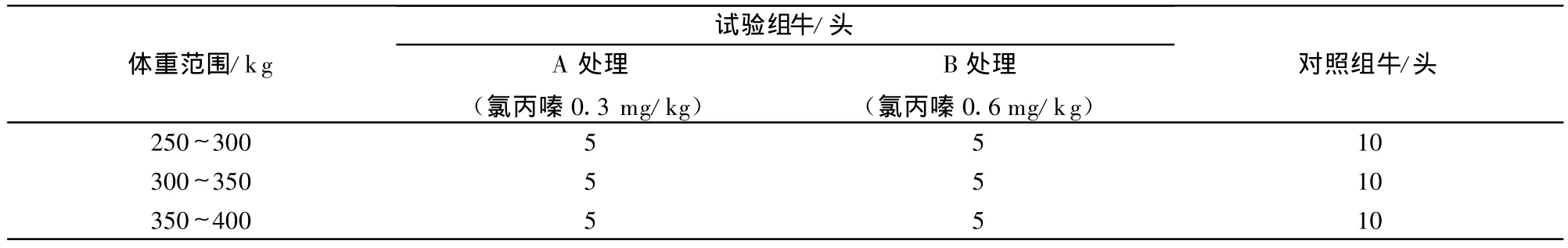
表2 第二批试验牛分组及处理情况表
1.2.4 牛群运抵牛场后的临床检查 牛运达目的场后,按逐渐增加粗、精饲料的方法饲喂。每日定时检测体温,观察临床变化,观察期为35 d,并作详细记录。
2 试验结果及分析
2.1 试验牛发病的整体情况
试验牛运达牛场后,进行了35 d的观察,发病症状基本类似。比较二批牛对照组46头牛的发病率,整体发病率为67%(31/46),其中第一批与第二批的发病率分别为75%(12/16)和63%(19/30)。发病症状主要表现为体温升高(39.5~41.5℃)、咳嗽、流鼻汁,继发拉稀,少数出现流泪、有眼分泌物和跛行(表3)。由于对发病牛进行了及时治疗,二批牛均未出现死亡。

表3 免疫组与对照组肉牛引入后的发病情况统计
牛运达牛场的发病时间存在批次差异,对照组第一批牛开始发病时间在到场后10~19 d间,第二批牛开始发病时间较早,在到场后6~14 d间发病(图1)。启运前对牛进行疫苗接种或肌肉注射盐酸氯丙嗪都使开始发病时间提前,第一批牛疫苗接种组的开始发病时间为到场后第6~15 d,开始发病时间较对照组提早了4 d;第二批牛肌肉注射盐酸氯丙嗪组的开始发病时间为到场后第3~7 d,开始发病时间较对照组提早了3 d(图1)。
2.2 牛支原体灭活疫苗免疫对肉牛引入后发病的影响
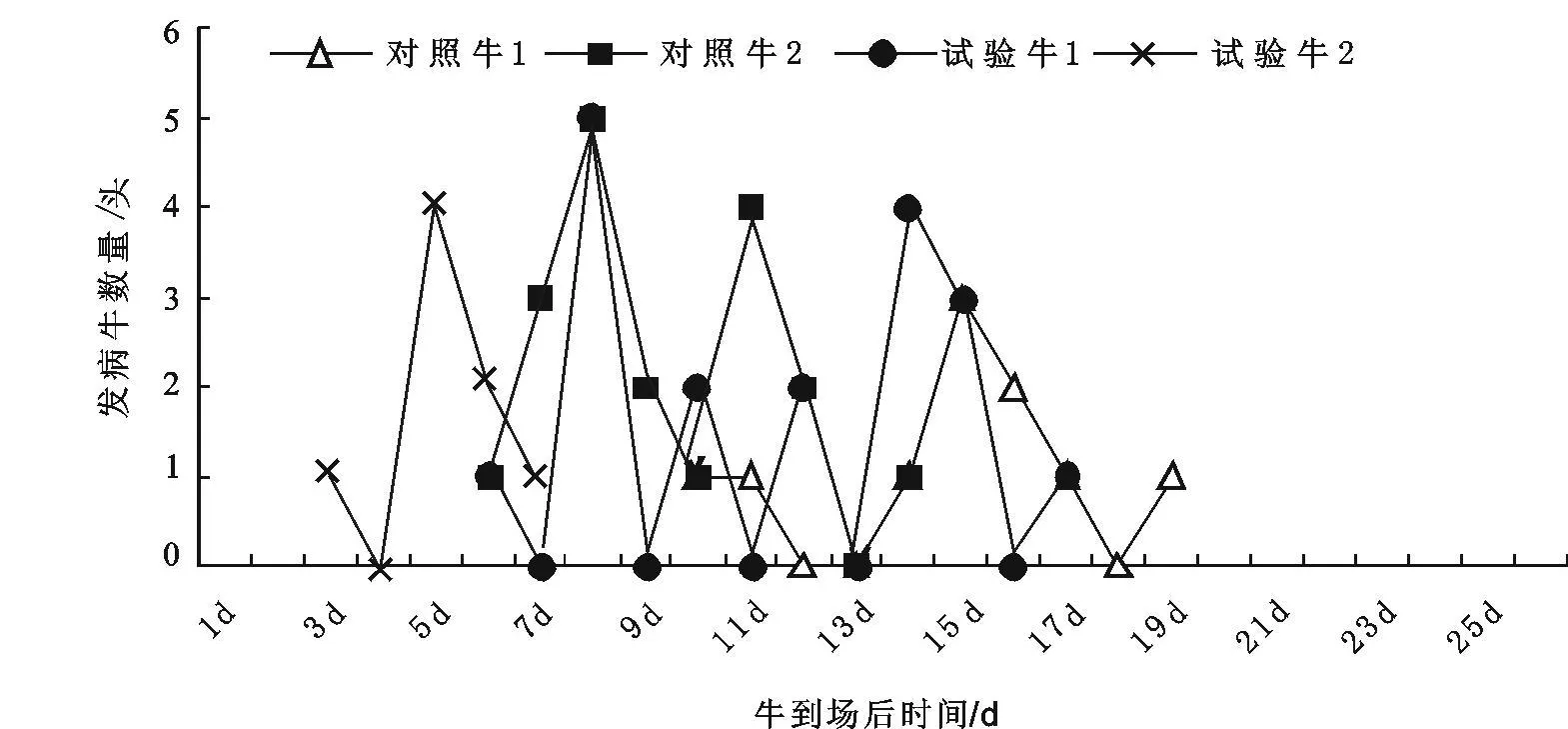
图1 不同处理组牛到牛场发病时间比较
比较免疫组与非免疫组,免疫组牛的发病情况较非免疫组严重,部分牛的发病时间提早至第6 d,发病牛比例增加,免疫组发病率为83%(19/23),而非免疫组发病率75%(12/16),说明启运前免疫不利于预防肉牛引入后发病,免疫应激对发病有促进作用。
用GAPDH间接ELISA检测免疫牛的血清牛支原体抗体水平,用OD450值表示,免疫前抗体水平为0.799±0.208,免疫后的抗体水平为 1.000±0.116,免疫前后抗体水平存在显著差异(P=0.002)(图 2)。

图2 免疫牛接种前及接种后15 d的牛支原体抗体水平(以OD450值表示)
2.3 盐酸氯丙嗪启运前注射对肉牛引入后发病的影响
盐酸氯丙嗪肌肉注射组(试验组)与对照组比,试验组的发病率为30%(9/30),而对照组的发病率高一倍,为63%(19/30),说明盐酸氯丙嗪亚治疗剂量肌肉注射对降低发病率有显著效果。比较盐酸氯丙嗪不同剂量组的发病率,A组按0.3 mg/kg用药, 而B 组按0.6 mg/kg 用药, 结果B 组的发病率为20%(3/15),而 A组的发病率为B组的 2倍,即40%(6/15);A组和B组发病率差异极显著(P<0.01),说明盐酸氯丙嗪降低发病率的效果具有剂量依赖性,高剂量效果更显著。比较不同体重组的发病率,对照组小体重组(250~300 kg)牛的发病率为90%(9/10),较其它两个高体重组高1.8倍,300~350 kg组和350~400 kg体重组的发病率均为50 %;统计分析显示, 小体重组(250 ~ 300 kg)牛的发病率较大体重组(300~350 kg)及(350~400 kg)牛发病率差异显著(P<0.05),说明小体重牛抵抗力较高体重组差(表4)。

表4 启运前肌注盐酸氯丙嗪后肉牛发病率比较
3 讨论
由于肉新引入后发病与长途运输环节密切相关,而运输应激错综复杂,包括饥、渴、运动、疲劳、冷、热、拥挤、噪声等多种应激原,能显著降低机体免疫力,健康威胁很大[9]。国内外的相关研究证实,这种发生于新引入肉牛、以呼吸道症状为主的综合征是由牛支原体引起的传染病[1~8]。在本研究中,我们通过启运前进行牛支原体灭活疫苗接种或注射盐酸盐酸氯丙嗪作为抗应激措施评价这两种处理方法对肉牛引入后发病的影响。
二批牛的对照牛发病率分别为75%和63%,平均67%,发病症状与流行病学与先前报道的牛支原体肺炎综合征一致,因此推测该研究中的发病情况是牛支原体肺炎综合征。由于这两批牛有专职技术员全程跟踪与及时治疗,未出现死亡现象。不同批次牛群发病率的差异可能与牛的个体体质差异、牛的来源和年龄、牛经牛贩子倒卖的环节多少与时间长短等因素有关。
接种组发病较对照组严重也说明了启运前接种导致的免疫应激能加重肉牛引入后发病。即使是检测发现血清抗体显著增加,但循环抗体未能阻止发病。即便是肌肉注射抗应激剂,对牛体也是一种新的应激原,注射组开始发病时间提前也支持该观点。因此,合理的免疫程序应是在养殖场做好疫苗注射,并证实体内诱导了确实的免疫反应后再考虑运输。
在目前没有疫苗与治疗效果不佳的情况下,我们再尝试通过减少应激除低肉牛引入后发病。盐酸氯丙嗪具有镇定作用,使用适当剂量能降低牛对应激原的敏感性,从而减少疾病的发生,因此被用作抗应激剂[10]。本研究证实,肌肉注射氯丙嗪能显著减少肉牛引入后疾病的发生率。兽药手册[11]推荐的牛治疗剂量是0.5~1.0 mg/kg.次,本研究使用了0.6 mg/kg和0.3 mg/kg两种亚治疗剂量,事先评价了该剂量对肉牛无不良影响,然后将该剂量用于试验牛,结果发现0.6 mg/kg比0.3 mg/kg效果更好,说明肉牛引入后发病确实与运输应激有关,尽量减少应激能有效降低发病率。
综上所述,认真挑选健康牛、启运前给予抗应激剂(肌注盐酸氯丙嗪)、运达目的场后加强护理(早期发现与治疗发病牛)能有效降低新引入肉牛的发病率与死亡率。
[1]石磊,龚 瑞,尹争艳,等.肉牛传染性牛支原体肺炎流行的初步诊断[J].华中农业大学学报,2008,27(4):572.
[2]石磊,龚 瑞,尹争艳,等.肉牛传染性牛支原体肺炎流行的诊断[J].华中农业大学学报,2008,27(5):629-633.
[3]Krysak D E.Chronic pneumonia and poly arthritis syndrome in a feedlot calf[J].Can Vet J.2006,47(10):1019-1022.
[4]Dyer N,Hansen-Lardy L,K rogh D,et al.An outbreak of chronic pneumonia and polyarthritis syndrome caused by Mycoplasma bovis in feedlot bison(Bison bison)[J].J Vet Diagn Invest,2008,20(3):369-371.
[5]Caswell J L,Archambault M.Mycoplasma bovis pneumonia in cattle[J].Anim Health Res Rev,2007,8(2):161-186.
[6]Gagea M I,Bateman K G,Shanahan R A,et al.Naturally occurring Mycoplasma bovis-associated pneumonia and polyarthritis in feedlot beef calves[J].J Vet Diagn Invest,2006,18(1):29-40.
[7]吴波,张书环,邓铨涛,等.四种牛分枝杆菌特异性蛋白融合表达及在牛结核病诊断中的临床应用[J].中国人兽共患病杂志,2007,23(9):41-44.
[8]胡长敏,石磊,龚 瑞,等.牛支原体病研究进展[J].动物医学进展,2009,30(8):73-77.
[9]Gupta S,Earley B,Crowe M A.Effect of 12-hour road transportation on phy siological,immunological and haematological parameters in bulls housed at different space allowances[J].Vet J.2007,173(3):605-616.
[10]吕建辉,蓝国文,高泽东.畜禽运输应激综合征的防治[J].中国畜牧兽医,2005,32(1):43-45.
[11]阎继业,邓旭明.畜禽药物手册[M].北京:金盾出版社.2001.392.

