肠型点状气单胞菌和鱼害粘球菌融合子的构建
钟蕾,肖克宇*,戴良英
(湖南农业大学 a. 动物科学技术学院;b.生物安全科学技术学院,湖南 长沙 410128)
草鱼(Ctenopharyngodon idellus)肠炎病、烂鳃病是对草鱼危害最大的细菌性疾病,目前主要依赖抗菌类药物进行治疗.烂鳃病菌苗和多联佐剂疫苗对草鱼肠炎病、烂鳃病的防治效果较好,但存在效果不稳定和制造成本高等问题.将微生物原生质体融合方法应用于动物致病微生物方面的研究[1-4]较多,这为发展细菌原生质体融合技术,研制细菌多联弱毒菌苗探索出了一条新的途径.笔者采用原生质体融合技术将草鱼烂鳃病和肠炎病的病原菌进行融合,选育遗传性稳定的融合子,旨在为制备病原菌融合疫苗提供依据.
1 材料与方法
1.1 材 料
(1)供试菌种.肠型点状产气单胞菌 58-20-9菌株,鱼害粘球菌 G4菌株,均由中国科学院水生生物研究所提供.
(2)培养基.完全培养基:蛋白胨 11%,牛肉膏0.5%,氯化钠0.5%,葡萄糖0.5%,pH值7.0~7.2,121 ℃灭菌20 min (固体培养基加琼脂2%).再生培养基:完全培养基中加入0.5 mol/L甘露醇,0.02 mol/L六水氯化镁,0.02 mol/L顺丁烯二酸,pH值 6.7,115 ℃灭菌 20 min (固体培养基加琼脂2%).双抗选择培养基:在再生培养基中加入庆大霉素3 000 IU/mL和红霉素50 IU/mL.
(3)主要试剂.EDTA溶液:0.1 mol/L乙二胺四乙酸钠,pH值8.0.SMM缓冲溶液:蔗糖0.5 mol/L,MgCl20.02 mol/L,顺丁烯二酸0.02 mol/L,pH值7.5,121 ℃灭菌20 min后备用.SMMD溶液:SMM缓冲液中加DNA酶5 μg/mL,即配即用.PEG溶液:在SMMD高渗液中加入40%的PEG6000,pH值7.0.新生磷酸钙溶液:K2HPO40.54 g,CaCl2H2O 29.4 g分别溶于100 mL水中,灭菌,使用时等体积混合,促进原生质体的融合.高渗美蓝染液:0.5 g美蓝溶解于100 mL 0.5 mol/L的蔗糖溶液中.
1.2 方 法
1.2.1 菌种培养
将原始菌种接种至斜面完全培养基,活化后立即转接至30 mL液体完全培养基,于28 ℃恒温培养24 h备用.
1.2.2 耐药性遗传标记选择及耐药菌株培育与稳定
耐药性遗传标记的选择参见文献[5].耐药菌株的进一步培育与稳定采用逐步提高药物浓度诱导培养法[6],将已耐受红霉素和庆大霉素的双亲菌株,在完全培养基和选择培养基上交替培养,提高其耐药性,并稳定至选择融合子的应用浓度.
1.2.3 生长曲线的绘制[7-8]
供试菌株分别在液体完全培养基中 28 ℃振荡培养,用分光光度计分别测定不同培养时间(1、2、3、4、5、6、7、8、9、10 h)的吸光度(OD600),以OD600值为纵坐标,以培养时间为横坐标,绘制两亲本菌株的生长曲线.
1.2.4 原生质体的制备、融合及再生
原生质体的制备、融合方法见文献[10].
融合子的检出:用影印法[10],将长出的菌落移植在含红霉素和庆大霉素的双抗选择培养基上,48 h后再次影印在双抗平板上,使融合株充分分离,在第2次双抗平板上长出的菌株,可初步认为是融合株.
原生质体形成率=(未经酶处理菌数-经酶处理后剩余菌数)/未经处理的总菌数.原生质体再生率=(再生培养基上总菌数-经酶处理后剩余菌数)/原生质体数.融合率=融合子数/平均两亲本再生原生质体数.
检出融合菌株后,在双抗选择培养基上用影印法连续传代12次,每代在28 ℃恒温箱培养2~3 d,最后长出的菌落可视为稳定的融合菌株.
1.2.5 亲本及融合菌株的DNA检测
按文献[11]方法提取亲本菌株和融合菌株的DNA,并测定其含量,取 1 000 bp DNA Ladder Marker及各DNA样10 μL 进行0.7%琼脂糖凝胶电泳检测,拍照.采用F检验法对DNA含量进行差异显著性检验,用新复极差法进行多重比较.
2 结果与分析
2.1 58-20-9菌株和G4菌株的对数生长期的选择
由图1可知,58-20-9菌株的对数生长中后期为5~6 h,G4菌株的对数生长中后期为6~7 h.
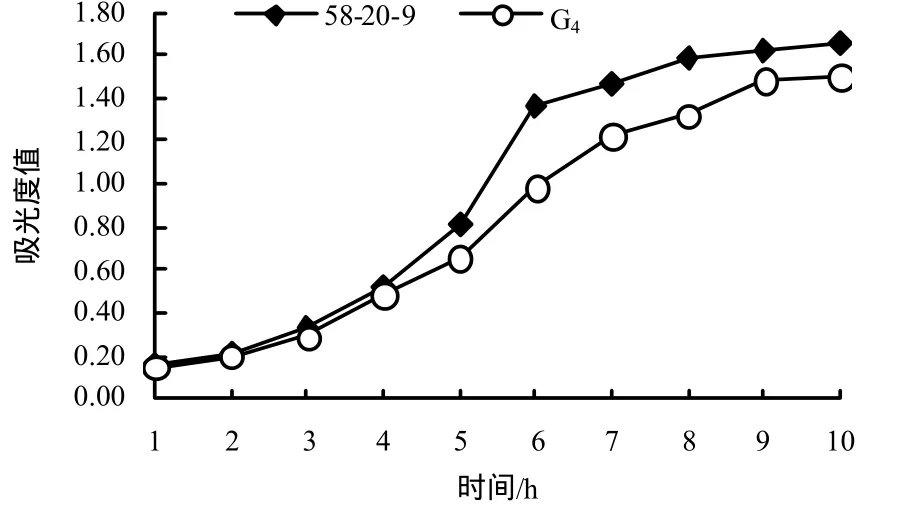
图1 58-20-9菌株与G4菌株生长曲线Fig.1 Curves describing the growth of strains 58-20-9 and G4
2.2 溶菌酶质量浓度和酶解时间对两亲株原生质体形成率和再生率的影响
从图2、图3可以看出,原生质体形成率随溶菌酶质量浓度增加而提高,但再生率呈下降趋势.同时,原生质体形成率随酶解时间延长而增加,再生率则下降,因此,将58-20-9菌株和G4菌株的酶解质量浓度确定为 4 mg/mL,酶解时间确定为 40 min.此时在较高的原生质体形成率下原生质体再生率也相对较高(图3).试验结果表明,58-20-9菌株的细胞壁比G4菌株的对溶菌酶更敏感.
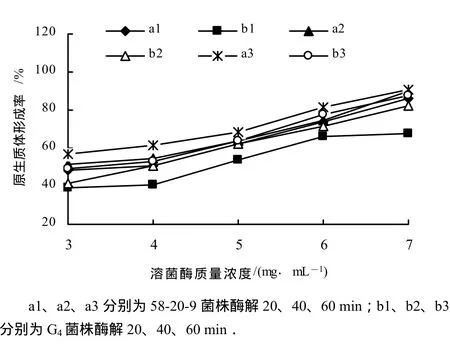
图2 溶菌酶质量浓度对原生质体形成率的影响Fig.2 The effect of concentration on formation rate of protoplast
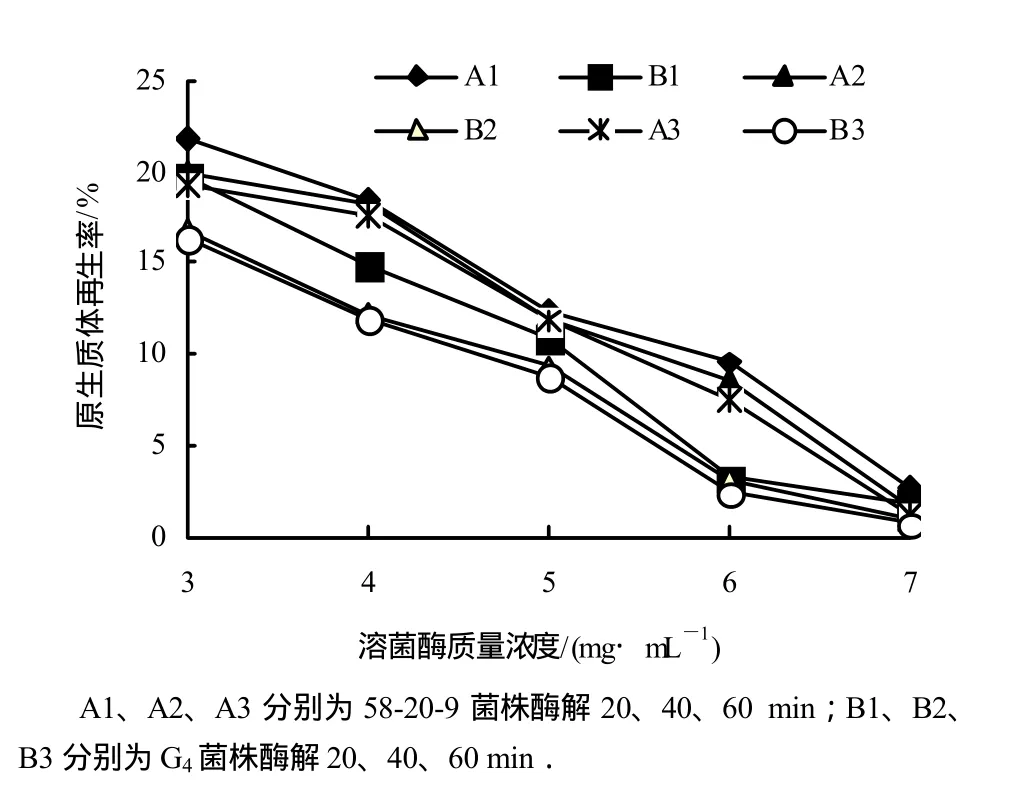
图3 溶菌酶质量浓度对原生质体再生率的影响Fig.3 The effect of concentration on protoplast regeneration rate
2.3 原生质体融合及融合子的检出
2.3.1 原生质体融合
经EDTA和溶菌酶脱壁后的58-20-9菌株和G4菌株的原生质体呈球状,与亲本菌的短杆状有明显区别.当两者的原生质体混合后,在40% PEG6000与新生磷酸钙液的促融下,在显微镜下可看到凝聚现象.当把出发菌株58-20-9和G4分别涂布在双抗选择培养基平板上,均不长出菌落.将融合的原生质体涂布在高渗再生培养基平板上,细胞壁恢复.48 h后待菌落长出再连续2次影印在含红霉素和庆大霉素的双抗选择培养基平板上,28 ℃恒温培养48 h后长出较小菌落,即为两亲株的原生质体融合体的再生菌.为了计算融合率,从高渗再生培养基上随机挑取5 000个菌落,用灭菌牙签点种于双抗选择平板上,培养48 h后于显微镜下观察,发现仅有 16个小菌落生长良好,视为融合子,融合率达4‰.
2.3.2 融合子稳定性鉴定
点种500个融合子菌落在双抗平板上,连续影印传代,随着传代次数的增加,能在双抗平板上生长的融合子数目逐渐减少,待传代12代时,仅有1个融合子菌落仍生长良好,且能稳定传代,说明此融合子遗传性稳定.因在试验中用DNAase排除了外源DNA的转化,说明此融合株是由两亲本菌株原生质体融合的结果,将该菌株定名为AM-l菌株.
2.4 亲本菌株及融合菌株的DNA含量
3次测量的亲本菌及融合菌株的 DNA含量见表1.由表1可知,OD260/OD280主要介于1.7~1.9,说明纯度可靠,融合菌株AM-l的DNA含量均高于58-20-9菌株和G4菌株的DNA含量,经检验,差异均达到了极显著水平(P<0.01).

表1 亲本菌株及融合菌株的DNA含量Table 1 The DNA contents of the syncretic and parents fungus strains μg/mL
亲本菌株与融合子DNA琼脂糖凝胶电泳结果见图 4.融合子 AM-l菌株离点样孔的距离明显小于任一亲本菌株离点样孔的距离,说明融合子DNA的相对分子质量比其亲本的要大,初步证实了以上DNA含量测定结果.
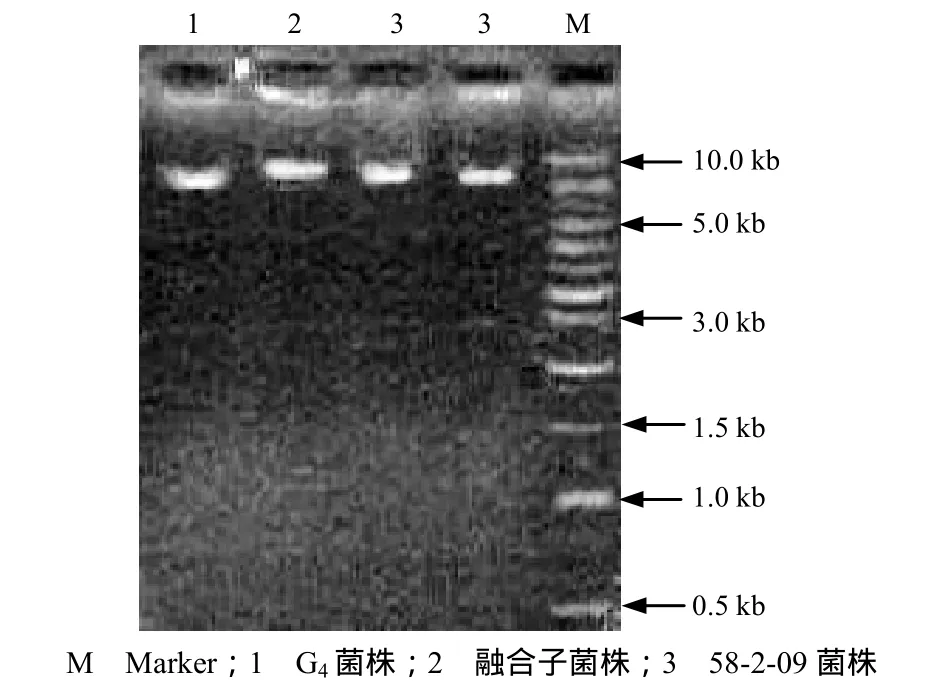
图4 菌株DNA琼脂糖凝胶电泳结果Fig.4 Electrophoresis of agrose gel of DNA
3 讨 论
细胞的生理状态对原生质体的形成及融合频率有较大影响.处于对数生长期的细菌细胞壁中肽聚糖的含量最低,细胞壁对酶的作用最敏感,在同等条件下原生质体制备率较高,但对数生长早期的细胞相对较为脆弱,受酶的过度作用会影响原生质体的再生率[12].鉴于此,本试验中两亲本原生质体的制备均选用对数生长中后期的菌液,即58-20-9菌株培养5~6 h,G4菌株培养6~7 h,这样不仅可获得较多菌体,而且原生质体的再生率也可得到保障.
在原生质体制备过程中,菌体的预处理、酶解浓度和时间、渗透压稳定剂是3个制约性的因素[13].笔者采用EDTA加溶菌酶处理,对溶菌酶的浓度和酶解时间进行了优选.试验证明,58-20-9菌株和G4菌株的酶解浓度为4 mg/mL,酶解时间为40 min,此时在较高的原生质体形成率下原生质体再生率也相对较高.在维持原生质体活力的条件下,一般以较低渗的介质有利于融合[12].笔者在原生质体制备中加入氯化镁、顺丁烯二酸、甘露醇等渗透压稳定剂,以防止原生质体破裂,同时也促进酶与底物的结合.2种原生质体等量混合后,加入PEG处理后原生质体仍呈球状.
原生质体融合后,融合子为抗性互补的双耐药菌株.笔者最初采用通常的直接法,即将融合后的原生质体直接涂布于双抗再生培养基上,但未得到融合子.后将融合后的原生质体先涂在不含药的再生培养基上培养48 h,再用影印法转到含红霉素和庆大霉素的双抗选择培养基上继续培养才得到融合株.究其原因,可能是双耐药融合子的检出需要有48 h的表型延迟期.Szxoboda[14]在研究小单胞菌原生质体融合时也发现表型延迟现象.出发菌的原生质体在双抗选择培养基上亦能生长,这一特殊选择主要是鉴别杂菌.杂菌在含2种抗生素的培养基上不能生长.若亲本不生长,融合子生长,则说明该融合子未继承原有特性.在原代融合平板上加入2种抗生素,可以保证生长的菌或者是形成杂合双倍体或单倍重组体的真正融合,因此,对这些菌连续传代 10次后仍不回复的可以认为是真正的融合子[15].对融合子及其亲本的DNA含量进行测定及琼脂糖凝胶电泳分析,证实了融合子的DNA含量高于任一亲本,其运动位置明显靠后,这也与刘玲等[16]的研究结果类似,但这些还不能完全从遗传学上阐明融合子的遗传规律,下一步在运用融合子开展规模化疫苗生产之前,仍有待于应用16srDNA等技术鉴定融合子AM-1菌株与亲本的异同,并对融合子携带的隐性或显性表达的遗传信息及其可能影响融合疫苗免疫效果的相关性状予以检测.
[1]刘录,沈秋英,孔继兰.跨界融合子处理含酚废水的实验研究[J].环境保护科学,2003,29(4):17-19,23.
[2]Yu Jianxiu,Pang Yi,Tang Mujin,et al.Highly toxic and broad spectrum insecticidal bacillus thuringiensis engineered by using the transport and protoplast fusion[J].Current Microbiology,2001,43(2):112-119.
[3]Richird H,Balt Z.Genetic recombination by protoplast fusion in streptomyces[J].Journal of Industrial Microbiology & Biotechnology,2001,22(45):460-471.
[4]周德明.原生质体融合构建高效降解工程菌的研究[J].中南林学院学报,2001,21(2):42-46.
[5]钟蕾,肖克宇,周梦姣.肠型点状气单胞菌与鱼害粘球菌原生质体融合的耐药性遗传标记的选择[J].湖南农业大学学报:自然科学版,2002,28(2):150-152.
[6]王兴龙,刘玉斌,冯来坤.多杀性巴氏杆菌X73株与P1059株原生质体融合株的构建[J].中国兽医学报,1994,14(2):177-180.
[7]韩文瑜,何昭阳,刘玉斌.病原细菌检验技术[M].长春:吉林科学技术出版社,1992:38-66,196-229,448-449.
[8]范秀容,沈萍.微生物学实验[M].北京:高等教育出版社,1987:8-29,114-117.
[9]陈驹声,王大琛,赵大健.微生物工程[M].北京:化学工业出版社,1987:23-33.
[10]林炜铁.酵母细胞原生质体融合技术的研究[J].华南理工大学学报:自然科学版,1991,3(1):1-8.
[11]李永明,赵玉琪.实用分子生物学方法手册[K].北京:科学出版社,1999:21-23.
[12]谭周进,肖启明,肖克宇.微生物菌种选育中的原生质体融合技术[J].生物技术,2003,13(1):35-36.
[13]Kao K N,Michayluk M R.Fusion of plant protoplasttechniques[C]//Bajaj VP S.Biotechnology in Agriculture and Frestry.Berlin:Springer- Vezlag,1989:277-288.
[14]Szxoboda.Study of protoplast fution of Micromonspora echinospor[J].Surgery,1978(84):224-227.
[15]金玉娟,刘自镕,任建平.芽孢杆菌和欧文氏菌的原生质体融合的研究[J].微生物学杂志,2002,22(3):10-11.
[16]刘玲,连芙菲,刘长江.康宁木霉和白腐真菌原生质体融合子生物学特性的研究[J].沈阳农业大学学报,2007,38(2):186-189.

