巴音布鲁克不同建植期人工草地土壤生物学特性研究
尹伟,胡玉昆,柳妍妍,公延明,张伟,刘伟,阿德列提·艾列吾塔力甫
(1.中国科学院新疆生态与地理研究所,新疆 乌鲁木齐830011;2.中国科学院研究生院,北京100039;3.新疆伊犁新源县畜牧兽医局,新疆 伊犁835800)
土壤是地球陆地生态系统的基础,而土壤微生物是陆地生态系统中最活跃的成分,担负着分解动植物残体的重要使命,推动着生态系统的能量流动和物质循环[1]。微生物数量多,土壤生物活性强,有效养分供给充足,可作为评价土壤肥力的重要指标之一[2],土壤养分含量直接影响植物的生长。土壤酶来源于土壤中动植物和微生物的分泌物及其残体的分解物,参与多种生物化学过程和物质循环,并直接参与土壤营养元素的有效化过程。因此,土壤酶活性可以客观的反映土壤肥力状况[3]。
巴音布鲁克草原位于开都河源流区,拥有高寒草甸、高寒草原化草甸、高寒草甸化草原、高寒草原、山地灌丛草甸和沼泽化高寒草甸等草地类型,这些草地类型不仅是该地区畜牧业发展的物质基础,同时在涵养水源、保持水土等方面起着重要作用,也对整个塔里木河流域的生态安全和新疆的经济发展起到举足轻重的作用。然而由于自然条件和经营管理问题,巴音布鲁克草原退化极其严重,退化草场占可利用草场的49.2%[4],早在20世纪80年代初就在该地区建立了人工草地,并在退化地区采取补播、施肥等措施进行恢复。在其他地区,有关土壤、林分以及不同退化阶段的草地养分、微生物和酶活性已有报道[5-13],而对开都河源区高寒草地生态系统的研究只局限于土壤理化性质以及物种多样性,对土壤微生物和酶活性的研究甚少[14],特别是对于不同建植期高寒人工草地土壤微生物的变化情况以及与植被、土壤环境的关系并不清楚,给认识开都河源区生态系统各组分在全球或区域性生态环境演变过程中的功能和动态带来了困难。因此,本研究通过对开都河源区不同建植期高寒草地的土壤微生物和土壤酶活性特征进行初步的研究,以期探讨高寒地区不同建植期土壤生物学特性变化特点,为高寒草地生态系统分解者亚系统功能的维持、退化草地的恢复和重建以及人工草地的建植和稳定性提供土壤生物学方面的参考依据。
1 材料与方法
1.1 研究区概况
试验地设在位于天山中段大尤尔都斯盆地西部的巴音布鲁克高寒草原,地处E 82°27′~86°17′,N 42°18′~43°34′,海拔2 340~4 618 m,年平均气温-4.8℃,1月最低气温可达-48℃,7月最高气温30.5℃,年平均风速2.7 m/s,年平均降水量276.2 mm,年蒸发量高达1 022.9~1 247.5 mm,全年积雪日达150~180 d,无绝对无霜期,属典型的高寒气候,土壤为亚高山高寒草原土。紫花针茅(Stipapurpurea)+羊茅(Festucaovina)草原是研究区域内典型的高寒草原类型,分布在海拔2 460~2 760 m,群落种类组成简单,分属7科12属,一般7~10种,群落总盖度约50%。人工草地为松土混播垂穗披碱草(Elymusnutans)和老芒麦(Elymussibiricus),播种量为75 kg/hm2,比例为1∶1。
1.2 样地设置
在巴音布鲁克草原生态站附近,选择以同一海拔的1987,1992,1999和2003年建植的多年生垂穗披碱草和老芒麦为试验地,以典型的天然草原(0 a)作为对照,样地面积为10 m×10 m,其生境基本情况见表1。样地选择植物生长均匀、微地形差异较小、集中连片分布的群落,分别取样。调查时间在植物生长期(2007年6,7,8,9月)样地内按对角线法做1 m×1 m的小样方,重复5次,样方调查分别记录植物种类组成、高度及盖度。另外,6-9月每月月底在研究地采用剖面法和5点混合法分别采集0~20和20~40 cm土壤样品,各样品过2和1 mm土壤筛以除去动植物残体和根系石块,混合均匀并用四分法取舍,一部分鲜样风干进行土壤理化性质的测定,另一部分贮藏于4℃的冰箱内,进行微生物数量的测定。
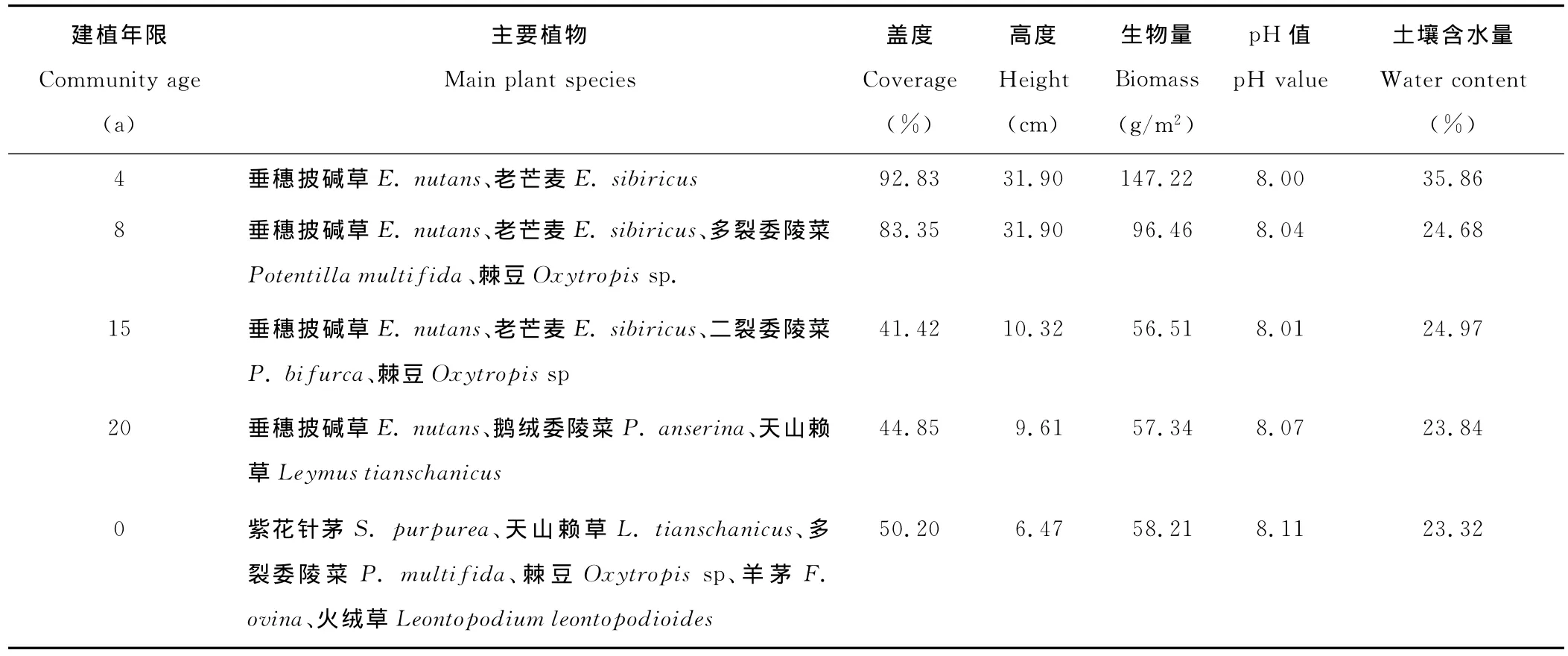
表1 巴音布鲁克地区不同建植期人工草地概况Table 1 Plot characteristics of different cultivated periods in Bayanbulak region
1.3 研究方法
土壤微生物的分离及计数:细菌培养采用牛肉膏蛋白胨培养基,放线菌培养采用改良高氏一号培养基,真菌培养采用马丁-孟加拉红培养基,表面涂抹法平板接种[15]。在无菌室里,称取鲜土样5 g,放入装有无菌水的加玻璃珠三角瓶中(以充满瓶底为宜),振荡10 min使土样充分打散,用1 m L移液枪准确吸取土壤溶液1 m L,依次稀释为每m L 10-1,10-2,10-3,10-4土壤悬液,再用100μL的移液枪准确吸取0.2 m L不同浓度土样溶液接种到培养皿,每种菌分别接种3个不同稀释度悬液,其中细菌为每m L 10-2~10-4悬液,真菌每m L 10-1~10-3悬液,放线菌每m L 10-2~10-4悬液,每一个稀释度3个重复。接种后,用无菌玻璃棒涂布均匀于琼脂表面。接种了土壤悬液的培养皿,平放于桌上20~30 min,使菌液渗透入培养基内,然后倒置于25~28℃恒温箱中培养一定时间:细菌2~3 d,真菌5~7 d,放线菌7~10 d。选取每皿15~150个的1个稀释度统计菌落数,按下列公式计算每g干土中的菌数。
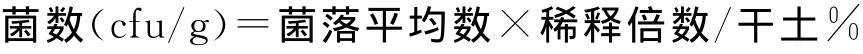
土壤酶活性的测定[3]:过氧化氢酶采用高锰酸钾滴定法,脲酶采用靛酚比色法测定,每月每层重复3次。
土壤理化性质的测定[16]:含水量采用铝盒烘干法(105℃,8 h),p H 值采用p H 计雷磁PHS-3C(土∶水=1∶5),电导率采用电导率仪DDS-307A(土∶水=1∶5)进行测定,有机质采用重铬酸钾-硫酸氧化法,全氮采用重铬酸钾-硫酸硝化法,全磷采用氢氧化钠碱熔-钼锑抗比色法,速效氮采用蒸馏法,速效磷采用碳酸氢钠法,速效钾采用火焰光度法。含水量测定为6-9月,每月每层重复3次,其余每个指标在7月进行测定,每层重复3次。
数据处理利用DPS 7.05、Microsoft Office Excel 2003、Sigmaplot统计软件。
2 结果与分析
2.1 不同建植期土壤微生物类群数量
2.1.1 不同建植期土壤微生物类群数量空间层次动态 对巴音布鲁克高寒地区5种不同建植期土壤细菌、真菌和放线菌数量的空间层次分步进行测定(表2),不同建植期细菌类群数量比较顺序为:4 a>8 a>0 a>15 a>20 a;放线菌最大值出现在0 a,8 a次之,20,4和15 a依次降低,表现出天然草原土壤放线菌数量大于人工草地的规律;真菌类群在4 a时达到最大值,以后20,15,8和0 a依次降低,表现出人工草地大于天然草原的趋势。同时,不论是相同建植期还是不同建植期,细菌、真菌、放线菌三大类群数量均表现出细菌>放线菌>真菌的规律。同一建植期不同空间层次草地土壤三大类微生物数量变化较大,一般0~20 cm的数量为20~40 cm的0.21~34.7倍。除15 a真菌数量随土层深度的加深而增加外,其他建植期细菌、真菌及放线菌数量随土层的加深而逐渐减少,表明微生物类群具有表聚性,这主要是由于土壤表层枯落物的分解、转化进入土壤,形成较厚的腐殖质表层,有机质含量高,土壤中的大部分营养元素多集中于表层,并且该地区植物根系多集中于0~20 cm,根系分泌的可溶性糖类、蛋白质等刺激微生物的生长[17]。同时,土壤表层温度和通气状况有利于微生物的生存与繁衍,而20~40 cm土层水热、营养源状况均比上层较差,故其下层三大类群数量不如上层土壤微生物类群数量多。
0~40 cm土层微生物总数中细菌占68.03%~90.55%(表2),故微生物总数比较顺序与细菌一样,即在4 a时达到最大值,8 a草地土壤微生物数量大于天然草原(0 a),以后随着建植期的增长而逐渐降低。造成这种现象的原因主要是建植初期生境资源丰富,建群种生长良好,土壤质量趋于良性化,随着建植期的增长,地上植被出现多种退化指示植物,植被盖度、地上生物量、土壤含水量均较建植初期有所下降,腐殖质含量降低,故细菌和真菌数量降低。由于细菌可产生胞外代谢物,如多糖,脂类和蛋白质,起到胶结作用以稳定团聚体[18]。因此,细菌数量的多少在某种程度上可以反映土壤质量的变化。4 a细菌数量是20 a的3.89倍(表2)。结合在植被调查时15和20 a人工草地均有退化指示植物的出现,如天山赖草、委陵菜、棘豆等,从侧面反映出该样地群落已发生退化,这与该样地细菌数量较少相吻合。
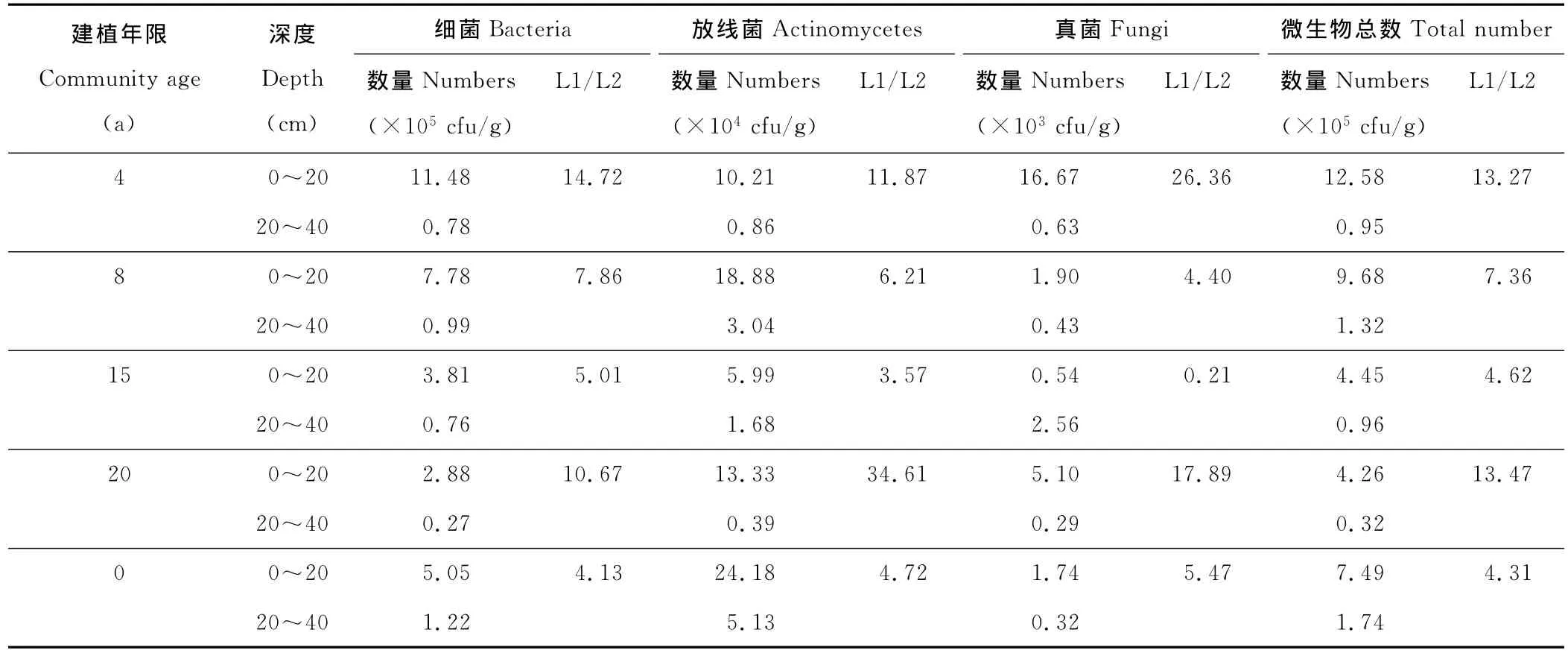
表2 不同建植期土壤微生物类群数量的空间层次分布Table 2 Spatial scales distribution of soil microorganism numbers in different cultivated periods grassland
2.1.2 不同建植期土壤微生物类群数量月份动态 5种建植期的土壤微生物三大类群在6-9月4个月中,表现出相同的月份变化规律,即均在8月达到最大值,9月最低(图1)。原因可能在于细菌喜好湿润,能耐受低氧水平,研究区的降水主要集中在7-8月,此期间植物生长迅速,根系活动旺盛,气温上升,8月气温达到最高,有利于细菌的生长和繁殖,进入8月中旬后牧草开始枯黄,气温开始降低,同时出现降雪天气,自此进入冬季,植物生长处于休眠状态,根系活动迟缓,土壤含水量较低,细菌生长受到抑制。由于细菌数量占微生物总数量的68.03%~90.55%,对微生物总数的贡献率最大,故微生物总数变化顺序与细菌变化一致。
不同月份之间放线菌数量变化明显,且水热条件良好的7-8月差异性显著(图1B)。6-8月随着环境条件(水、肥、气、热)的改变,放线菌数量逐渐增多,并在8月达到最大值,进入9月数量因为温度、植被等自然环境的改变而迅速降低。
土壤中真菌数量为103cfu/g,小于细菌和放线菌数量,在偏酸性土壤中数量较多,是降解各种有机物的重要类群,对不利环境的忍耐力较强。不同建植期的真菌月份数量变化规律相同,在水热条件较好的8月均达到最大值(图1C)。
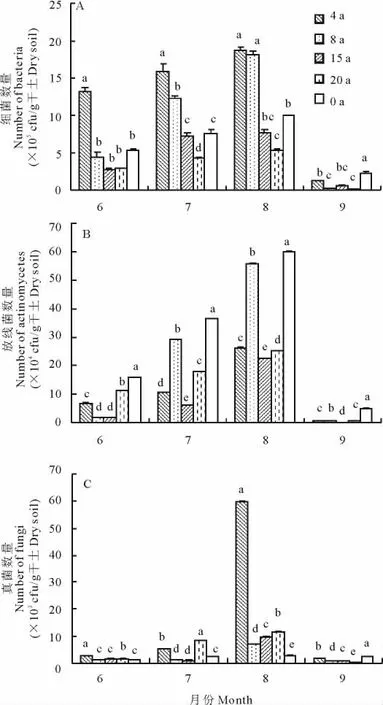
图1 不同建植期土壤微生物的月动态变化Fig.1 Dynamic of microbe numbers of different cultivated periods from June to September
2.2 不同建植期土壤酶活性的空间层次动态
土壤酶是表征土壤中物质、能量代谢旺盛程度和土壤质量水平的一个重要生物指标[19]。过氧化氢酶能促进水解过氧化氢,并能氧化土壤中的有机质,其活性与土壤的微生物数量有关,也与植物根系有关,可以用来表征土壤生化活性和腐殖质化强度[3]。0~40 cm土壤过氧化氢酶活性大小比较为:4 a>8 a>0 a>15 a>20 a,建植人工草地前,尽管草地植被盖度、地上生物量较大,但由于研究区处于高寒地带,土壤冻结期长、通透性差,对土壤微生物繁殖和活动的抑制作用较为强烈,不利于土壤酶活性的提高,同时致使土壤有机质形成受阻,大量有机残体累积于土中,造成天然草原土壤过氧化氢酶活性较低,采取松土等措施建植人工草地后,随着土壤通透性能的显著改善,尚存的有机残体为土壤微生物提供了足够的营养物质来源,使土壤性质得到明显改善[20],进而改善并提高了土壤微生物数量及其代谢过程,从而使土壤酶数量和活性显著增加。建植4,8 a人工草地0~20 cm土壤过氧化氢酶活性虽然不及天然草原高,但是0~40 cm土层显著高于天然草原(P<0.05),15 a人工草地各土层较天然草原相应降低1.65%,6.78%和3.72%,建植20 a时0~40 cm较天然草原降低6.86%,反映出土壤环境也较建植初期发生改变。
脲酶是土壤中最为活跃的水解酶之一,因其对土壤有机质中碳—氮键(CO-NH)的水解作用而在土壤氮循环中具有重要作用,其活性的提高有利于稳定性较高的土壤有机氮向有效氮的转化[21]。与天然草原(0 a)相比,建植4 a不同土层(0~20,20~40 cm)脲酶活性分别增加46.4%,20.5%,表明天然草原在经开垦建植为人工草地初期土壤脲酶活性显著增加,在建植8 a时仍大于天然草原,之后随着建植期的增加,植被组成也慢慢发生变化,土壤脲酶活性显著下降,表现出对植被环境变化的敏感性。不同建植期草地0~20 cm脲酶活性与20~40 cm的呈现相似的特点,均表现出建植初期脲酶活性比较大(分别为4和8 a),以后0,20,15 a依次降低。本研究中不同建植期脲酶活性排列顺序与土壤微生物总数变化规律大致相同,均在4 a取得最大值,8 a时仍大于天然草原,以后随着建植年限的增加,逐渐呈减小的趋势,并低于天然草原。
另外,5种建植期的土壤过氧化氢酶和脲酶活性均呈现出随土层的加深而递减的趋势(图2),这主要是因为土壤表层聚集着大量的枯枝落叶,有机质含量高,有着较好的水热条件和通气状况,有利于土壤微生物的生长代谢,呼吸强度加大,从而使表层积聚了较高的土壤酶活性。随着土层的加深,土壤孔隙度减小,有机质含量也急剧下降,地下生物量随之减少,土壤温度的降低及土壤水分的减少使得土壤微生物代谢产酶能力下降,故呈现出土壤酶活性随着土壤剖面加深而降低的趋势。
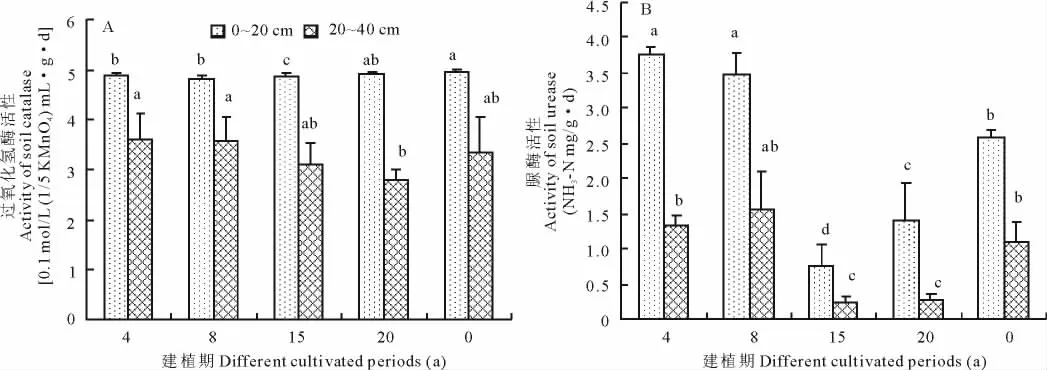
图2 不同建植期土壤酶活性空间层次动态Fig.2 Space dynamic states of soil enzyme activities in different cultivated periods grassland
2.3 相关分析
2.3.1 微生物数量与土壤环境因子的相关分析 细菌与速效氮呈极显著负相关,与p H值、脲酶活性等呈负相关,与电导率、过氧化氢酶活性等呈正相关(表3);真菌与全磷呈显著负相关,与过氧化氢酶活性呈极显著负相关,与p H值、脲酶呈极显著正相关;放线菌与有机质呈极显著正相关,与p H值、电导率等呈负相关,与速效磷、速效钾、全氮等监测指标呈正相关;微生物总数与速效氮呈极显著负相关,与电导率、全氮等呈正相关,与p H值、脲酶活性等呈负相关,但均不显著。
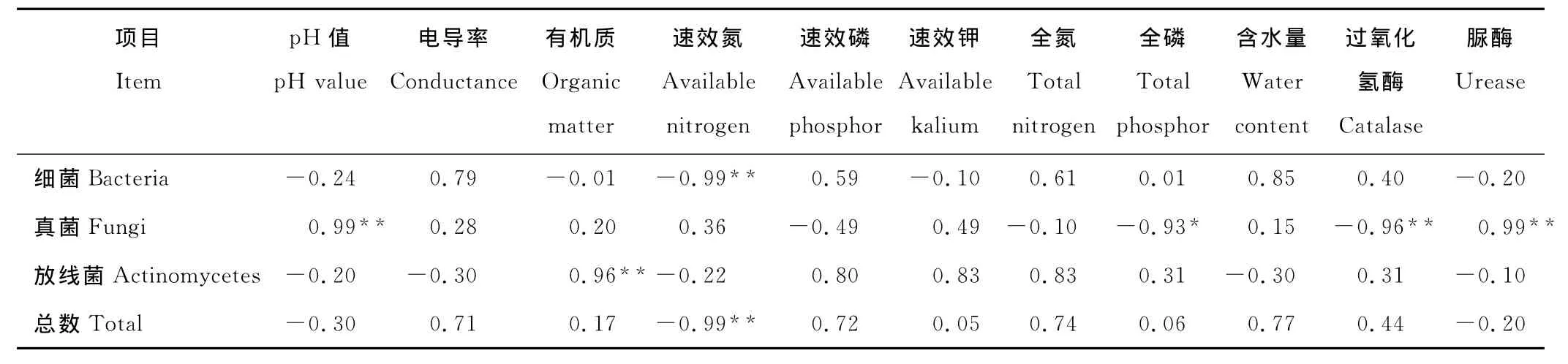
表3 微生物数量与土壤因子的相关系数Table 3 Correlation coefficients on the relationship between microorganism number and soil properties
为了更好的说明土壤微生物数量与环境因子之间的关系,采用逐步回归拟合土壤微生物总量与土壤诸多环境因子的数学模型:Y1=30.48-0.17X1+1.19X2。式中:Y1,土壤微生物总数量;X1,速效氮;X2,脲酶活性。速效氮、脲酶活性对微生物总数的偏相关系数分别为-0.998 2,0.870 0,绝对值依次递减,且与速效氮达到极显著水平。土壤微生物总数与脲酶活性的相关系数仅为-0.200 0,但偏相关系数却达到0.870 0,和速效氮一同成为影响微生物总数的重要因子,说明仅仅依靠简单相关系数来判断相关性具有一定的局限性。
2.3.2 土壤酶活性与环境因子的相关分析 土壤脲酶活性与有机质、电导率呈显著正相关,与全磷呈显著负相关,与p H值、速效氮呈负相关,与含水量、速效磷等呈正相关,但均不显著;土壤过氧化氢酶活性与全磷呈显著正相关,与p H值、速效氮、速效磷呈正相关,但不显著,与含水量、电导率、有机质等呈负相关,且不显著(表4)。
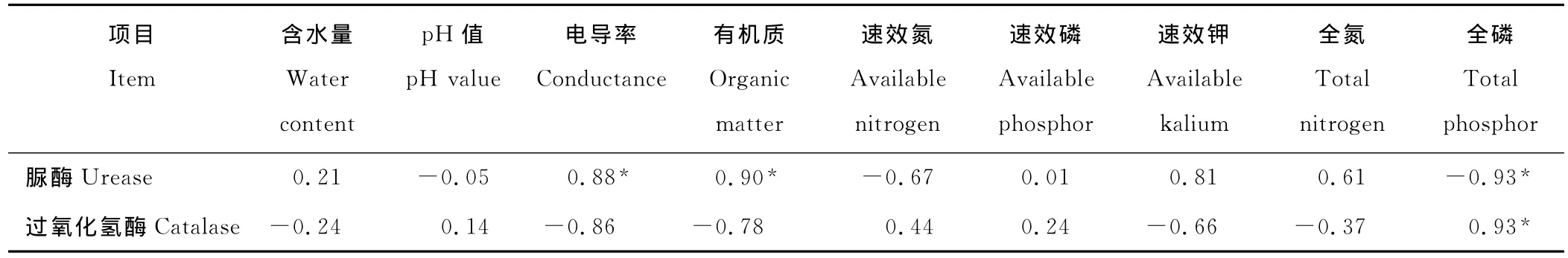
表4 土壤酶活性与土壤环境因子的相关系数Table 4 Correlation coefficients on the relationship between soil enzyme activities and soil properties
土壤脲酶活性的多元线性回归方程为:Y2=2.541+0.084A1-0.545A2。式中:Y2,脲酶活性;A1,土壤有机质;A2,全磷。土壤全磷、有机质对脲酶活性的偏相关系数依次为-0.985 3,0.973 0,与全磷有关的回归系数也最大,说明全磷和有机质是影响土壤脲酶活性的重要因子。与前面提到的脲酶活性和有机质呈显著正相关,与全磷呈显著负相关的结论一致。
土壤过氧化氢酶活性的多元线性回归方程为:Y3=-15.361+2.207B1+0.185B2。式中:Y3,过氧化氢酶活性;B1,p H 值;B2,全磷。全磷、p H 值对土壤过氧化氢酶活性的偏相关系数依次为0.999 4,0.995 7,其绝对值依次减小,与p H值的相关系数仅为0.140 0,但偏相关系数却达到0.995 7,回归系数也达到最大值,即全磷和p H值是影响土壤过氧化氢酶活性的主要土壤因子。
3 讨论
研究表明,在0~40 cm土层中,细菌对微生物总数的贡献率最大,故微生物总数比较顺序与细菌相同,即在建植初期,微生物总数呈增长趋势,在4 a达到最大值,以后随着建植期的增长,微生物数量逐渐降低。顾峰雪等[22]对不同建植期的人工植被类型进行了研究,认为植物种植时间越长,微生物数量越多,与本研究结果有所差异,造成差异的原因除了研究尺度的差异外,还与植物种类、研究区域自然环境状况有关。另外,本研究中15 a真菌数量随土层深度的加深而增加,可能受人为干扰活动(放牧等)的影响[23,24],但是具体原因有待于进一步的研究探讨。
土壤微生物数量与分布受各种生态因素的综合影响,生态环境的地理区域差异是主导因素[25,26]。巴音布鲁克草原与海北站海拔相差不大,但本研究与海北站[27]相比,细菌等三大微生物类群数量比海北站减少1~2个数量等级,这主要是研究区年均温-4.8℃比海北站的-1.7℃更低,年均降水量276.2 mm比海北站的580 mm少很多,即水热状况不良造成了该地区细菌、真菌、放线菌三大微生物类群总体相对较少。另外,随着建植期的增长,草地植物优势种地位逐渐降低,且伴有退化指示植物的少量分布,其化感作用对其他植物甚至草地微生物也有影响[28]。研究表明在本研究区0~20 cm土层微生物类群数量大于20~40 cm,即土壤微生物具有表聚性,与多数研究结果一致[29]。
土壤酶活性不仅受土壤理化性质的影响,同时,土壤微生物的种类和数量在某种程度上对土壤酶活性的变化也有影响[30]。不同建植期土壤脲酶活性大小顺序:4 a>8 a>0 a>20 a>15 a,过氧化氢酶活性大小顺序:4 a>8 a>0 a>15 a>20 a,与土壤微生物总数总体变化规律大体一致,即4 a取得最大值,以后随着建植期的增长,逐渐降低,但在建植后期脲酶活性与微生物总数变化稍有差别,即在15 a脲酶活性小于20 a,而15 a微生物总数却大于20 a,具体原因还有待于进一步的研究探讨。同时,土壤过氧化氢酶和脲酶活性均有随土层的增加而逐渐降低的特点,这与他人[31,32]的研究结果一致。另外,结合地上植被调查看,15,20 a植被群落较建植初期已发生退化,根据不同建植期土壤微生物数量以及土壤酶活性的变化,故土壤退化滞后于植被退化,也表明土壤微生物和土壤酶活性对土壤环境有高度的敏感性,因此,土壤微生物数量和土壤酶活性可作为评价草地退化的指标之一。
建植期不同,土壤肥力状况以及植被也会有所改变。与其他样地相比,4 a人工草地有机质积累较多,营养源丰富,同时该样地土壤含水量也较为丰富,因此该样地微生物数量最多,土壤脲酶活性和过氧化氢酶活性也最大。无论是土壤状况还是地上植被变化调查,都从侧面反映人工草地在建植初期对于草地恢复起着重要作用,但随着建植期的增长,群落植被、土壤开始发生退化,此时应采取多种恢复措施组合(休牧、围栏、划区轮牧等)以保证草地的可持续利用。
现有研究资料表明,草地植被、土壤中某个生态因子的改变都会引起微生物生态系统的改变,进而导致整个草地生态系统的改变。因此,建议在草地的管理利用中,不仅要注意地上植被的开发利用,更要注意土壤的变化,不仅是土壤理化性质的变化,还有微生物系统的变化,为草地的可持续利用提供参考依据。
[1]张萍,郭辉军,刀志灵,等.高黎贡山土壤微生物的数量和多样性[J].生物多样性,1999,7(4):297-302.
[2]焦如珍,杨承栋.杉木人工林不同发育阶段林下植被、土壤微生物、酶活性及养分的变化[J].林业科学研究,1997,10(4):373-379.
[3]关松萌.土壤酶及其研究方法[M].北京:农业出版社,1986:62-133,274-297.
[4]巴音布鲁克草原实验站.巴音布鲁克草场类型特点、草场退化及其合理利用和改良研究工作报告[J].干旱区研究,1989,6(2):1-5.
[5]王少昆,赵学勇,左小安,等.科尔沁沙地植物萌动期不同类型沙丘土壤微生物区系特征[J].中国沙漠,2008,28(4):696-700.
[6]赵有翼,蔡立群,王静,等.不同保护性耕作措施对三种土壤微生物氮素类群数量及其分布的影响[J].草业学报,2009,18(4):125-130.
[7]王海英,宫渊波,陈林武.嘉陵江上游不同植被恢复模式下土壤微生物及土壤酶活性的研究[J].水土保持学报,2008,22(3):172-177.
[8]荣丽,李贤伟,朱天辉,等.光皮桦细根与扁穗牛鞭草草根分解的土壤微生物数量及优势类群[J].草业学报,2009,18(4):117-124.
[9]侯彦会,周学辉,焦婷,等.甘肃永昌县放牧草地土壤脲酶活性与土壤肥力的关系初探[J].草业学报,2009,18(4):111-116.
[10]尚占环,丁玲玲,龙瑞军,等.江河源区退化高寒草地土壤微生物与地上植被及土壤环境的关系[J].草业学报,2007,16(2):34-40.
[11]Insam H,Mitchell C C,Dormaar J F.Relationship of soil microbial and activity with fertilization practice and crop yield of three Ultisols[J].Soil Biology and Biochemistry,1991,24:873-876.
[12]姚拓,龙瑞军.天祝高寒草地不同扰动生境土壤三大类微生物数量动态研究[J].草业学报,2006,15(2):93-99.
[13]张崇邦,杨靖春,管致锦,等.羊草草原土壤微生物的分布及其与土壤因子间的关系[J].植物生态学报,1995,19(4):368-374.
[14]曹叶飞,方光新,蒋平安,等.长期围栏封育对巴音布鲁克山地草原土壤微生物的影响[J].新疆农业科学,2008,45(2):342-346.
[15]许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[16]南京农业大学.土壤农化分析(第二版)[M].北京:科学出版社,1996.
[17]吴彩霞,傅华.根系分泌物的作用及影响因素[J].草业科学,2009,26(9):24-29.
[18]李新荣,贾玉奎,龙利群,等.干旱半干旱地区土壤微生物结皮的生态学意义及若干研究进展[J].中国沙漠,2001,21(4):4-11.
[19]薛冬,姚槐应,黄昌勇.植茶年龄对茶园土壤微生物特性及酶活性的影响[J].水土保持学报,2005,19(2):84-87.
[20]韩永伟,韩建国,王堃,等.利用年限对农牧交错带退耕还草地土壤化学性质的影响[J].草业科学,2005,22(3):50-53.
[21]彭岳林,钱成,蔡晓布,等.西藏不同退化高寒草地土壤酶的活性[J].山地学报,2007,25(3):344-350.
[22]顾峰雪,文启凯,潘伯荣,等.塔克拉玛干沙漠腹地人工植被下土壤微生物的初步研究[J].生物多样性,2000,8(3):297-303.
[23]高志英,韩兴国,汪诗平.放牧对草地土壤的影响[J].生态学报,2004,24(4):790-797.
[24]李凤霞,张德罡,姚拓.燕麦根际促生菌特性研究[M].草业学报,2005,14(1):58-62.
[25]Stephan A,Meyer A H,Schmid B.Plant diversity affect s culturable soil bacteria in experimental grassland communities[J].Journal of Ecology,2000,22:988-998.
[26]钟文辉,蔡祖聪.土壤微生物多样性研究方法[J].应用生态学报,2004,15(5):899-904.
[27]王启兰,曹广民,王长庭.高寒草甸不同植被土壤微生物数量及微生物生物量的特征[J].生态学杂志,2007,26(7):1002-1008.
[28]张宝深,白雪芳,甄润德.生化他感作用与高寒草甸人工草场自然退化现象的研究[J].生态学报,1989,9(2):115-120.
[29]Nehl D B,Allen S J,Brown J F.Deleterious rhizo sphere bacteria:An integrating perspective[J].Applied Soil Ecology,1996,5:1-20.
[30]冯万章,周万海,龙瑞军,等.江河源区不同建植期土壤养分及微生物量磷和磷酸酶活性研究[J].草业学报,2007,16(6):1-6.
[31]齐文娟,龙瑞军,冯万章,等.江河源区不同建植年限人工草地土壤微生物及酶活性研究[J].水土保持学报,2007,21(4):145-149.
[32]朱丽,郭继勋,鲁萍,等.松嫩羊草草甸羊草、碱茅群落土壤酶活性比较研究[J].草业学报,2002,11(4):28-34.

