干旱荒漠区草地植物群落地上生物量时空分布对地下水的响应
李卫红,周洪华,杨晓明,丁辉
(1.中国科学院新疆生态与地理研究所 中国科学院绿洲生态与荒漠环境重点实验室,新疆 乌鲁木齐830011;2.新疆石油学院,新疆 乌鲁木齐830000;3.新疆维吾尔自治区水利厅防汛抗旱总指挥部办公室,新疆 乌鲁木齐830000)
生物量是反映群落或生态系统功能强弱的重要指标[1,2]。地上生物量的动态变化还直接影响到植物群落的生产力及其分解过程,对碳循环有重要影响作用[3,4]。因此,自国际生物学计划(IBP)实行以来,生态系统生物量和生产力一直是生态学中的重要研究方向[5]。近年来,国内学者对生物量的研究给予了高度的关注,就森林[6-8]、草原[9-12]、湿地[13-15]等生态系统或群落的生物量分布及格局进行详细的研究,同时对不同环境胁迫和干扰条件下,如不同土地利用方式[16]、土壤水分[17-19]、海拔[20,21]、供氮水平[22,23]、土壤养分[24,25],土壤盐分[18,26]、地下水埋深[27]以及不同干扰程度[28]下的生物量变化规律均进行了相应的研究。但关于草地植物群落的地上生物量时空分布及其与地下水关系的研究涉及较少,对于物种多样性与群落地上生物量的探讨也尚需进一步加强,尤其是在干旱半干旱区。在干旱半干旱区,水分是影响植物生长发育的最关键因素。干旱胁迫不仅会使植物萎蔫,而且还会减弱植物的生理功能和抗病能力[29,30]。在干旱区,降水稀少,植物生存所依赖的唯一水源是地下水,在一定程度上,地下水埋深的深浅决定着植物种群的发育和群落的演替。因此,分析干旱区地下水埋深与植物群落生物量空间分布的关系,探讨植物种群生长发育的适宜地下水位,对促进干旱区植物恢复有着重要的现实意义。
另外,自20世纪50年代群落稳定性概念提出以来,生态学家们就其概念和理论不断地进行着深入的研究和激烈的争论。迄今为止,其争论的最大焦点在于“是多样性还是物种组成差异对群落稳定性起作用”[31]。而关于群落稳定性的研究大多集中在草地、森林、湿地等群落[31-34],那么在干旱区植物群落中,究竟是支持“物种多样性-稳定性”假说还是更符合“种间差异-稳定性”假说,这个问题尚需进一步探讨。因此,深入研究不同地下水埋深下植物生产力与物种多样性关系,可以为物种多样性-稳定性和种间差异-稳定性假说在干旱区的适宜性奠定理论基础。本研究以我国典型干旱荒漠区-塔里木河下游草地植物群落为例,分析群落地上生物量时空分布差异及其对地下水埋深及水质的响应,揭示干旱荒漠区草地植物生长发育的合理水位和水质,探讨物种多样性与群落地上生物量关系,为丰富多样性-稳定性假说、促进干旱荒漠区生态环境恢复和重建提供理论依据。
1 材料与方法
1.1 研究区概况
塔里木河下游指从恰拉水库始至台特玛湖的区域,它位于新疆东南部两大沙漠之间,西依我国第一大沙漠——塔克拉玛干沙漠,东连库鲁克沙漠,属大陆性暖温带、干旱沙漠性气候,生态环境极为脆弱。此区气候干燥,多风沙天气,平均年降水量17.4~42.0 mm之间,平均年蒸发量高达2 500~3 000 mm,是我国极端干旱的地区之一。由于降水稀少,浅层地下水是维系塔里木河下游植物生长发育的主要水源,地下水的埋深和分布决定着植物群落的分布和发育。
1.2 资料采集与研究方法
自2000年生态输水工程实施以来,沿塔里木河下游河道建立了9个监测断面(图1),每个断面布设有地下水观测井和植物样地。由于塔里木河下游常年断流,各断面植物群落结构和组成简单,物种单一,大多是柽柳(Tamarixaustromongolica)为代表的灌木群落,9个断面中仅阿克顿断面为典型的草地群落,因此本研究选取阿克顿断面为受试断面。此断面距大西海子水库约10 km,地下水埋深相对较浅,植物群落主要是以芦苇为主要优势种群的芦苇(Phragmitescommunis)-花花柴(Kareliniacaspica)-罗布麻(Apocynumvenetum)草本群落。在距河道中心50 m、临近阿克墩断面地下水观测井处,沿垂直河道平行布设3条长200 m的固定植被样带,样带间距50 m,每条样带上每隔10 m布设1个1 m×1 m的植被调查样方,共布设样方63个(图1)。于2005-2008年,连续4年选取植物生长旺季(8月)分别调查样方中物种数、个体数、高度、冠幅等指标,然后用剪刀将样方内所有草本的地上部分剪下,称重。取3条样带的平均地上生物量作为草地植物群落的地上生物量值。同期用电导法测定地下水埋深,并采集水样,密封送检。检测指标包括矿化度、p H值、总碱度、总硬度、电导率以及CO32-、HCO3-、Cl-、SO42-、Ca2+、Mg2+、K+、Na+。检测方法为:矿化度采用重量法,p H 值采用PHS-2C型数字式酸度计测定,总碱度及CO32-、HCO3-采用双指示剂滴定法,总硬度、SO42-、Ca2+、Mg2+采用EDTA容量法,电导率采用DDS-307型电导率仪测定,Cl-采用硝酸银滴定法,K+、Na+采用火焰光度法[35]。
1.3 数据分析
在统计样方植物物种数、高度、盖度和密度的基础上,计算各物种的重要值。重要值=(相对盖度+相对密度+相对高度)/3,在重要值的基础上,计算物种多样性指数。
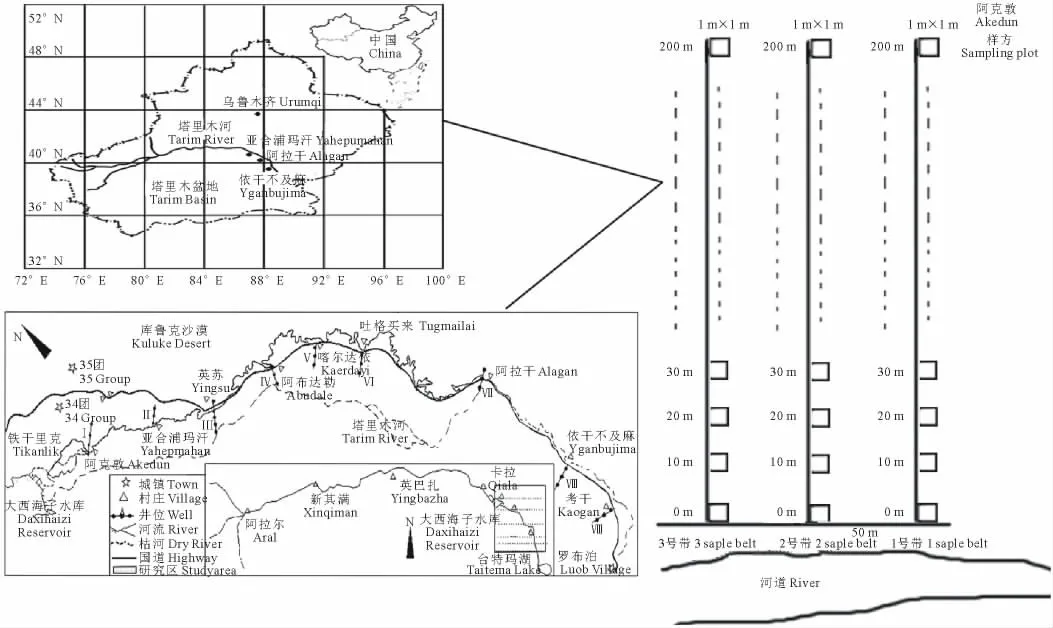
图1 研究区示意图Fig.1 Sketch map of the study area

式中,n为物种数,pi为物种i的重要值。本研究所有数据分析与处理用Excel和SPSS 13.0软件,作图采用Sigma Plot 9.0软件。
2 结果与分析
2.1 草地植物群落地上生物量的时间变化
塔里木河下游草地植物群落的物种较少,种群主要有芦苇、花花柴、甘草(Glycyrrhizainflata)、罗布麻和苦豆子(Sophoraalopecuroides),其中芦苇是主要的建群种,平均密度数达56.80株/m2,占总平均密度的92.06%,在群落中占绝对优势;花花柴、甘草和罗布麻零星分布,平均密度为4.02%,为伴生种;苦豆子为偶见种,平均密度仅为0.88%。随时间变化草地植物群落的地上生物量呈现明显的峰谷形变化(图2)。2005年草地群落地上生物量为348.40 g/m2,2006年草地群落地上生物量较2005年下降了19.43 g/m2,2007年草地群落地上生物量迅速上升,高达741.75 g/m2,2008年草地群落地上生物量降至最低,为243.65 g/m2。独立样本T检验表明,2005和2006年群落地上生物量没有显著差异(P>0.05),2007年群落地上生物量与2005,2006和2008年群落地上生物量均有显著差异(P<0.05),2008年群落地上生物量与2005,2006和2007年群落地上生物量之间也有显著差异(P<0.05)。草地植物群落的Simpson指数、Shannon-Wiener指数、群落平均高度、密度和盖度都随时间呈现出与地上生物量一致的变化趋势(图3,4)。SPSS 13.0软件的K-S检验表明,样方中草本植物的地上生物量、个体数、高度、冠幅均呈正态分布,为此,利用Bivariate Correlations分析发现(表1),地上生物量与Simpson指数、Shannon-Wiener指数呈显著正相关(P<0.05),与群落物种数、高度、密度和盖度关系不显著(P>0.05,表2)。进一步以地上生物量(y)为因变量,Simpson指数(x1)、Shannon-Wiener指数(x2)分别为自变量进行回归分析,结果表明,草地植物群落的地上生物量与Simpson指数、Shannon-Wiener指数的关系符合一元一次线性方程:

由此说明,在典型干旱荒漠区-塔里木河下游草地植物群落地上生物量与群落物种多样性呈显著正线性关系,即生产力随多样性的增加而增加,但物种组成(物种丰富度)对干旱区草地植物群落乃至生态系统的生产力影响并不大。
2.2 草地植物群落地上生物量的空间变化
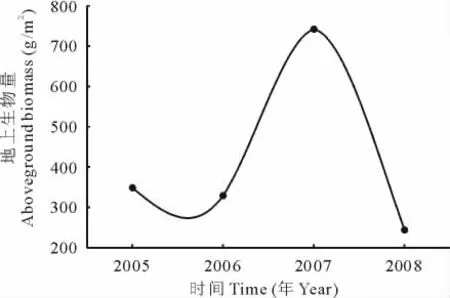
图2 草地植物群落地上生物量的年际变化Fig.2 Annual variation of aboveground biomass of grassland plant communities
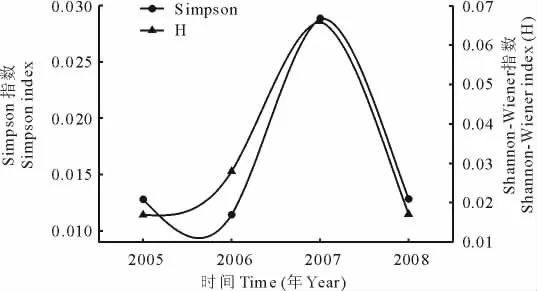
图3 草地植物群落多样性指数的年际变化Fig.3 Annual variation of diversity indices of grassland plant communities
塔里木河下游草地植物群落地上生物量随垂直河道距离的变化呈现出明显的空间差异。从地上生物量变化趋势可看出(图5),垂直于河道距离越近的草地植物群落地上生物量越高,随着垂直河道距离的增加,地上生物量显著减少。其中,2005,2006和2008年地上生物量随垂直河道距离增加下降幅度较大,2007年下降幅度相对较小。进一步利用SPSS 13.0软件将各年63个样方地上生物量与垂直河道距离进行曲线拟合,结果表明,地上生物量与距河道距离呈显著的线性相关,其定量方程分别见表2,拟合方程的相关系数均达到0.9以上,拟合方程可信度较高,能较好的模拟出草地群落地上生物量与垂直河道距离之间的变化关系,即随着垂直河道距离的增加,草地群落地上生物量呈显著线性下降。
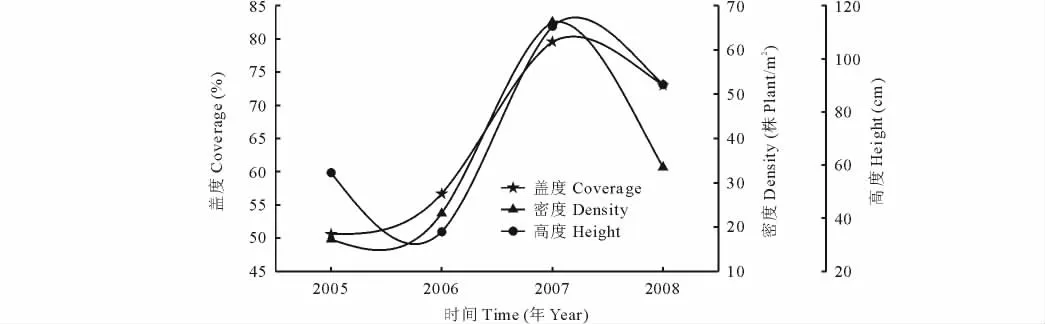
图4 草地植物群落盖度、密度和高度的年际变化Fig.4 Annual variation of coverage,density and height of grassland plant communities
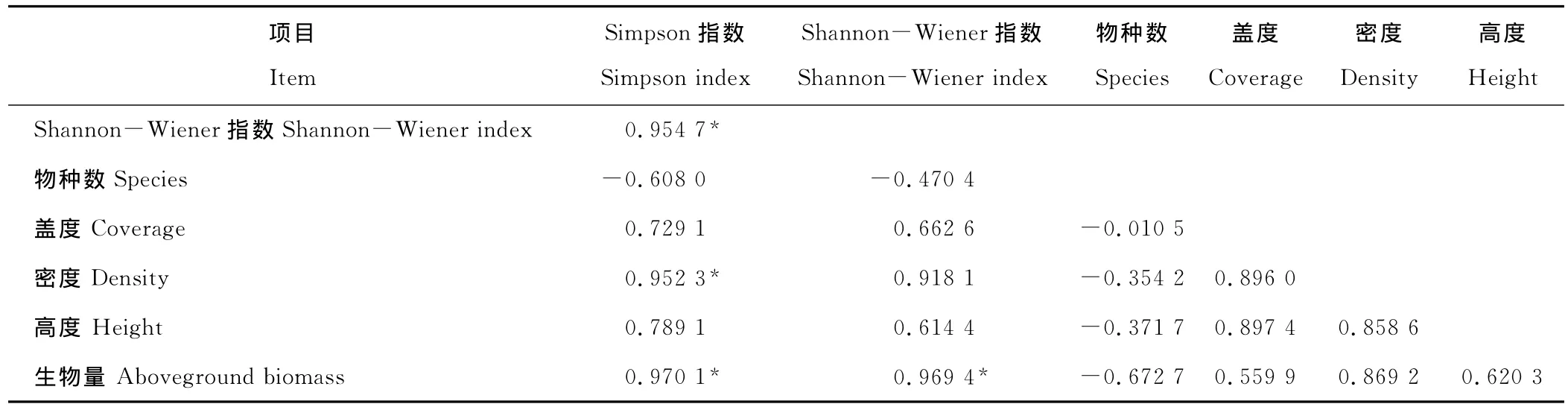
表1 草地植物群落地上生物量与物种多样性指数和物种组成数量特征的相关性分析Table 1 Correlation analysis between aboveground biomass and diversity indices and quantitative characteristics of species composition
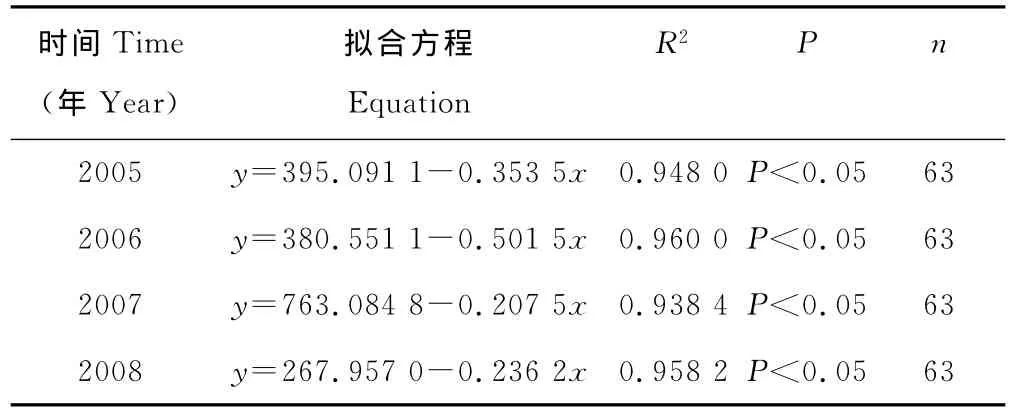
表2 草地植物群落地上生物量与垂直河道距离的定量关系Table 2 Relationship between aboveground biomass and vertical distance from river in the grassland plant communities
2.3 地上生物量对地下水埋深的响应
塔里木河下游草地植物群落地下水埋深年际变化表明(图6),地下水埋深在2007年最浅,在2008年最深,且2005年地下水埋深较2006年浅,这与群落地上生物量的变化趋势正好相反。这表明,在干旱荒漠区,地下水埋深和地上生物量呈显著负相关(表3),随着地下水埋深的加深,草地植物群落地上生物量逐渐减少,其定量关系满足指数方程:y=696.69x-0.765(图7)。单因素方差分析表明(表3),当地下水埋深为2.60 m时,草地植物群落地上生物量显著高于地下水埋深2.82,3.01和3.46 m生境下的地上生物量,地下水埋深2.82和3.01 m的群落地上生物量没有显著差异,但两者均显著高于地下水埋深3.46 m的群落地上生物量。方差分析结果还表明(表3),地下水埋深与物种多样性指数和种群高度、盖度和密度密切相关。地下水埋深2.6 m的群落物种多样性、种群高度、密度和盖度均显著高于地下水埋深2.82,3.01和3.46 m,且地下水埋深2.82和3.01 m的群落物种多样性、种群高度、密度和盖度均显著高于地下水埋深3.46 m,但地下水埋深2.82和3.01 m的群落物种多样性和种群高度、密度和盖度之间没有显著差异。结合草地植物群落地上生物量的空间分布状况可知,当地下水埋深在2.6 m内时,地上生物量受河道距离增加的影响最小。这表明,地下水埋深显著影响干旱荒漠区的草地植物群落地上生物量,地下水埋深小于2.6 m时群落地上生物量最高、种群生长发育最好,地下水埋深大于3.0 m后群落地上生物量急剧下降,植物生长发育显著受到抑制。
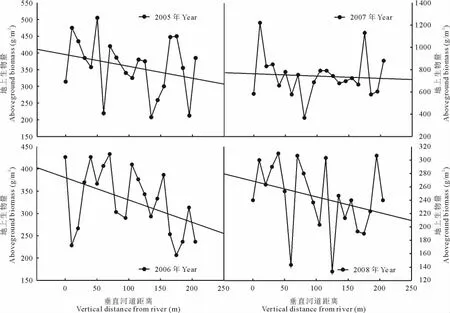
图5 草地植物群落地上生物量随垂直河道距离的变化Fig.5 Changes in aboveground biomass in grassland plant communities along the vertical distance from river
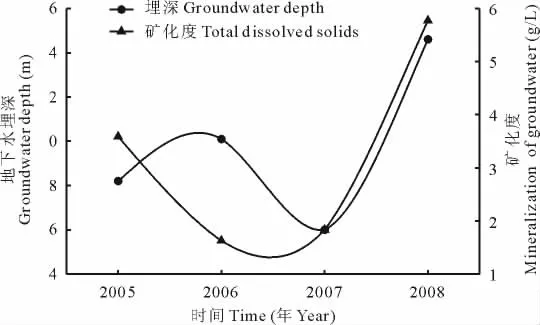
图6 研究区地下水埋深和矿化度年际变化Fig.6 Annual variation of groundwater depth and mineralization in the study area
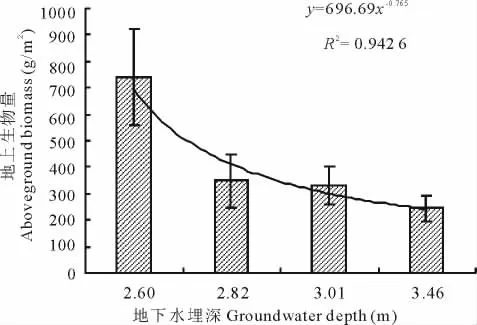
图7 草地植物群落地上生物量与地下水埋深关系Fig.7 Relationship between groundwater depth and aboveground biomass in the grassland plant communities
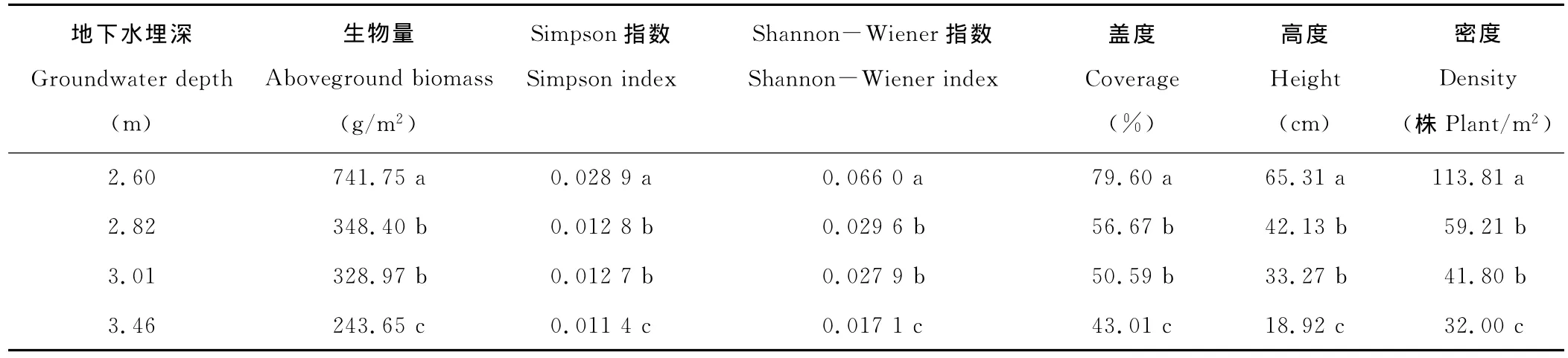
表3 不同地下水埋深下草地植物群落特征Table 3 Plant communities’characteristics at different groundwater depths
2.4 地上生物量对地下水水质的响应
地下水矿化度的年际变化较大(图6),变化幅度为1.630~5.772 g/L,且地下水矿化度随地下水埋深的增加而升高,当地下水埋深3.46 m时矿化度高达5.772 g/L,显著高于地下水埋深小于3.0 m时的矿化度(P<0.05)。相关分析表明,地下水矿化度与草地植物群落地上生物量呈显著负相关(表4,图8)。当地下水矿化度在1.630 g/L时,草地植物群落地上生物量达328.97 g/m2,当矿化度升高到1.835 g/L时,地上生物量增加到741.75 g/m2,矿化度继续升高至3.590 g/L时,地上生物量开始减少,为348.40 g/m2,当矿化度持续升高为5.772 g/L时,地上生物量开始显著下降。
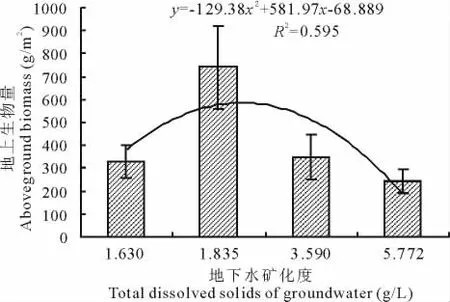
图8 草地植物群落地上生物量与地下水矿化度的关系Fig.8 Relationship between mineralization of groundwater and aboveground biomass in the grassland plant communities
地下水化学特征指标与草地植物群落地上生物量的相关分析结果表明(表4),地下水的Cl-和Mg2+含量与地上生物量呈显著负相关,而p H值和其他离子含量与地上生物量关系不显著,且地下水矿化度与Cl-和Mg2+呈极显著正相关。这表明塔里木河下游以芦苇为优势种群的草地植物群落对地下水中的Mg-Cl盐含量最为敏感。
3 讨论与结论
物种多样性与生态系统功能的关系是众多生态学家的关注焦点。早在1872年,Darwin经试验发现,群落的生物多样性是由共生物种的生态位分化产生的,由于能够更有效地利用资源,更高的植物物种多样性会有更高的初级生产力。他指出如果在一块土地上仅播种一个草种,同时在另一块相像的土地上播种若干不同属的草种,那么在后一块土地上就比在前一块土地上能够生长更多的植物,收获更大重量的干草[36]。然而,两者之间的关系形式以及隐藏在形式背后的机理到目前仍未有定论[32-34,37]。过去几十年,有关两者关系的模型层出不穷,结果却千差万别。一些模型表明多样性随生产力的增加而增加,另一些模型表明多样性随生产力的增加而减少,更多的则是先增加后减少(单峰),甚至还有先减少后增加(U形)[38-41]。Waide等[39]对近200种关系进行统计,其中30%呈单峰关系,26%呈正线性关系,12%呈负线性关系,32%关系不明显。这些研究中大多数都集中在湿地、草原和森林生态系统,对于干旱荒漠区生态系统生产力与生物多样性的相关性研究报道较少。本研究结果发现,典型干旱荒漠区-塔里木河下游以芦苇为主要优势种群的草地植物群落存在明显的时空分布差异。在时间上,群落地上生物量和物种多样性指数以及群落高度、密度和盖度呈峰谷形变化,2007年地上生物量显著高于其他年份,而2008年地上生物量显著低于其他年份;在空间上,草地植物群落地上生物量随垂直河道距离的增加逐渐减少,二者呈显著线性相关。群落的地上生物量与群落物种多样性呈显著正线性关系,即生产力随多样性的增加而增加。这表明在干旱荒漠区草地植物群落物种多样性可以通过影响群落生产力进而影响着生态系统的稳定。物种多样性指数的计算基础是物种重要值,即各物种相对高度、相对密度和相对盖度之和,然而,物种的密度、高度、盖度对群落生产力的影响并不显著(表1),这表明在干旱荒漠区,单一的群落种类组成因素,如物种丰富度等,对干旱区草地植物群落乃至生态系统的生产力影响并不大,影响群落和生态系统生产力的是通过构成群落种类组成的数量特征的共同作用。
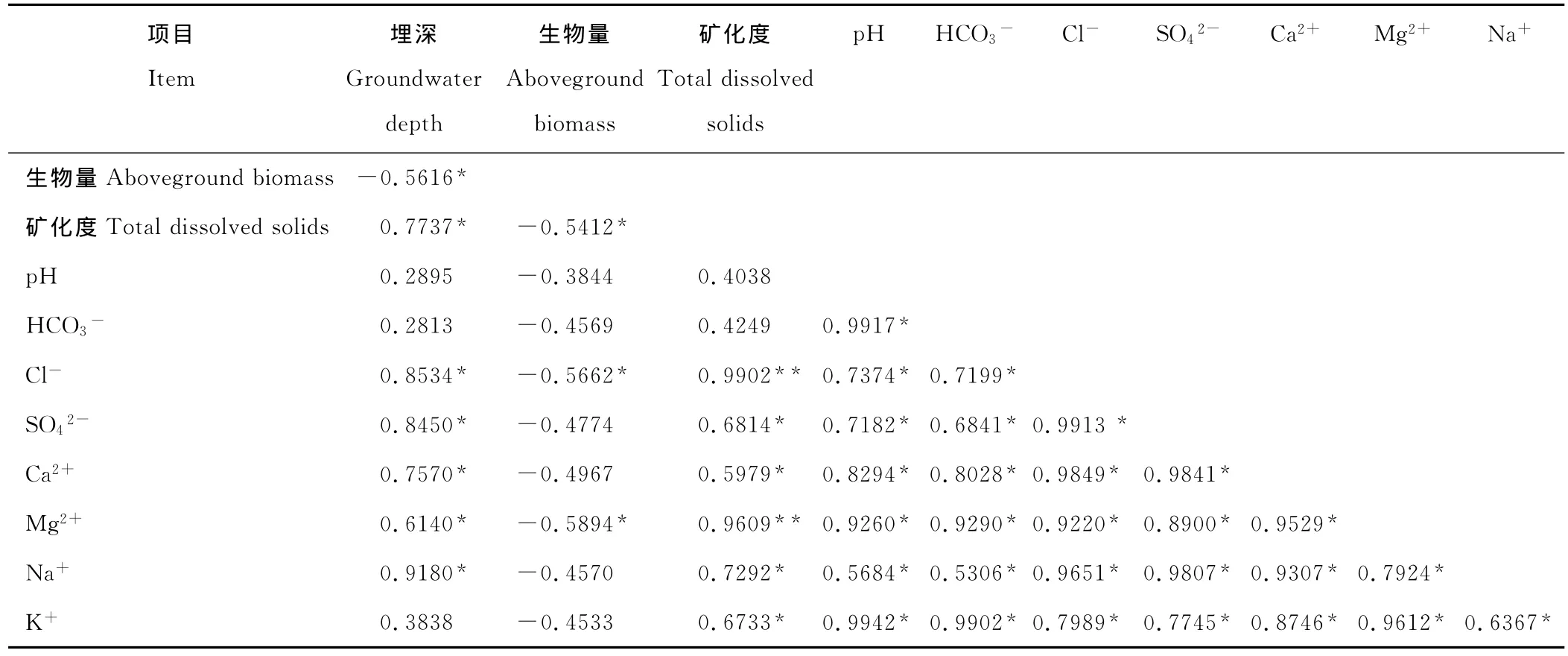
表4 草地植物群落地上生物量与地下水埋深和化学组成的相关性分析Table 4 Correlation analysis between groundwater depth,chemical composition of groundwater and aboveground biomass in the grassland plant communities
环境梯度直接影响草地群落生物量的形成[10,42],范永刚等[10]发现灌溉有助于提高巴音布鲁克高寒草地植物群落的高度、盖度、生物量和物种多样性。王长庭等[11]研究认为,青藏高原高寒草甸群落生产力除受物种多样性、功能群内物种密度和均匀度的影响外,同时也受外部环境资源的影响。郑晓翾等[16]指出,温度和降水是影响呼伦贝尔草原物种丰富度和生物量的主要环境因子。在干旱荒漠区,水是植物生长发育最关键的因素,由于地表水的严重匮乏,地下水埋深和水质成为了植物发育的主要限制因素。目前,关于干旱区植物组成、物种多样性与地下水埋深关系的研究有很多,然而,就草地群落生物量与地下水关系的研究还有待加强。赵文智等[43]对河西荒漠绿洲区芦苇种群构建生物量与地下水埋深关系分析发现,地下水埋深小于0.5 m时,芦苇地下生物量高,地下水埋深1.5 m时,芦苇地上生物量高,且随着地下水埋深的增加,垂直根茎生物量对芦苇种群地上生物量的影响加强,同时,他指出芦苇垂直根茎的最大水位提升高为4 m。对典型干旱荒漠区-塔里木河下游菜地群落地上生物量对地下水埋深的响应研究发现,群落地上生物量的时空差异是由地下水埋深和水质差异引起的。地下水埋深的变化与地上生物量的年际变化和空间分布有很好的吻合性,地下水埋深2.60 m时,草地群落地上生物量最高、种群生长发育最好,生物量空间分布较均匀,其地上生物量、物种多样性、种群高度、密度和盖度均显著高于地下水埋深2.82,3.01和3.46 m,地下水埋深大于3.00 m后群落地上生物量、物种多样性、种群高度、密度和盖度迅速下降,且随距河道距离的增加降低加剧,植物生长发育显著受到抑制。
矿化度表征地下水盐分含量,矿化度的高低直接影响土壤的发育和植被的演替[15,44]。矿化度随地下水埋深的加深而升高,当地下水埋深小于3.0 m时,地下水矿化度较低,而当地下水埋深大于3.0 m时,矿化度显著提高。这可能与生态输水工程的实施有关。20世纪70年代塔里木河下游断流后,地下水埋深持续下降,为挽救荒漠河岸林,2000年国家启动了生态应急输水工程,当大西海子水库向下游大量泄水后,河道两岸地下水埋深变浅,由于输送的低矿化度地表水(基本在1.5 g/L左右)的稀释作用,地下水矿化度逐渐下降,潜水通过土壤毛细管和植被根系向表土输送的盐分相应减少,土壤表土积盐含量降低,盐分胁迫程度降低,进而引起群落植被正向演替和生物量增加,相反,当地表水下泄量较少时,地下水补给量少,矿化度较高,地下水通过潜水蒸发和植被根系吸水等过程将盐分带入土壤表层,导致土壤表层积盐,引起植被退化和生物量下降。由此可见,要保持干旱荒漠区草地植物群落地上生物量较高,地下水埋深必须维持在3 m以内。这与陈敏等[29]通过研究不同生境下植物叶片脯氨酸、可溶性糖含量变化和郝兴明等[30]通过分析植物多样性指数和地下水埋深关系得出的结论是基本一致的,所以本研究的结论是可信服的,因此,本研究可以为塔里木河下游植物群落的合理地下水埋深研究提供一种新方法。
干旱区植物多为耐旱抗盐物种,它们可通过聚盐、泌盐等抗盐生理特性生长在含盐量很高的土壤中,如柽柳可生长在盐分含量为32 g/L的土壤中[44],芦苇在矿化度1.1 g/L,总碱度560~580 mg/L左右的环境下仍然生长茂盛[45]。本研究分析表明,当地下水矿化度在1.630 g/L时,塔里木河下游草地植物群落地上生物量可高达328.97 g/m2,当矿化度升高至5.772 g/L时,地上生物量呈现出显著下降趋势,群落植物生长发育显著受到抑制。这表明,以芦苇为优势种群的塔里木河下游草地植物群落的耐盐上限是5 g/L左右,同时,地下水矿化度与Cl-和Mg2+呈极显著正相关,Cl-和Mg2+含量也与地上生物量呈显著负相关,这表明塔里木河下游以芦苇为优势种群的草地植物群落对地下水中的Mg-Cl盐含量最为敏感。这是因为,轻度盐化草甸芦苇的叶肉细胞和重度盐化草甸芦苇的泡状细胞内Mg2+含量较沼泽和沙丘芦苇的高,而高Mg2+含量的泡状细胞能够调节植物蒸腾[46],从而调整芦苇的抗逆性以适应生境。
[1]Chapin III F S,Matson P A,Mooney H A.Principles of Terrestrial Ecosystem Ecology[M].New York:Springer-Verlag,2002.
[2]Krassilov V A.Terrestrial Paleoecology and Global Change[M].Bulgaria:Pensoft Publishers,2003:286-292.
[3]Apps M J,Price D T.Forest Ecosystems,Forest Management and Global Carbon Cycle[M].Berlin:Springerverlag,1996.
[4]Chave J,Condit R,Lao S,etal.Spatial and temporal variation of biomass in a tropical forest:Results from a large census plot in Panama[J].Joumal of Ecology,2003,91:240-252.
[5]方精云,刘国华,徐嵩龄.我国森林植被的生物量和净生产量[J].生态学报,1996,16(5):479-508.
[6]张国斌,刘世荣,张远东,等.岷江上游亚高山林区老龄林地上生物量动态变化[J].生态学报,2008,28(7):3176-3184.
[7]韩忠明,韩梅,李晓璐,等.刺五加种群构件生物量预测的研究[J].安徽农业科学,2008,36(30):13215-13216.
[8]马元丹,江洪,余树全,等.桫椤生态系统生物量与生产力[J].植物生态学报,2008,32(6):1294-1300.
[9]郑晓翾,靳甜甜,木丽芬,等.呼伦贝尔草原物种多样性与生物量、环境因子的关系[J].中国草地学报,2008,30(6):74-81.
[10]范永刚,胡玉昆,李凯辉,等.不同干扰对高寒草原群落物种多样性和生物量的影响[J].干旱区研究,2008,25(4):531-536.
[11]王长庭,曹广民,王启兰,等.青藏高原高寒草甸植物群落物种组成和生物量沿环境梯度的变化[J].中国科学(C辑:生命科学),2007,37(5):585-592.
[12]张宝田,穆春生,金成吉,等.松嫩草地2种胡枝子地上生物量动态及其种间比较[J].草业学报,2006,15(3):36-41.
[13]郭雪莲,吕宪国,戴国华.三江平原不同水位梯度湿地地上生物量动态特征[J].生态环境,2008,17(5):1739-1742.
[14]徐惠风,刘兴土,陈景文.长白山区沟谷沼泽湿地乌拉苔草(Carexmeyeriana)地上生物量与土壤有机质和氮素相关性分析[J].农业环境科学学报,2007,26(1):356-359.
[15]杨桂山,施雅风,张深.江苏滨海潮滩湿地对潮位变化的生态响应[J].地理学报,2002,57(3):325-332.
[16]郑晓翾,王瑞东,靳甜甜,等.呼伦贝尔草原不同草地利用方式下生物多样性与生物量的关系[J].生态学报,2008,28(11):5392-5400.
[17]刘国利,何树斌,杨惠敏.紫花苜蓿水分利用效率对水分胁迫的响应及其机理[J].草业学报,2009,18(3):207-213.
[18]苏丹,孙国峰,张金政,等.水分胁迫对费菜和长药八宝生长及生物量分配的影响[J].园艺学报,2007,34(5):1317-1320.
[19]王丽,胡金明,宋长春,等.水分梯度对三江平原典型湿地植物小叶章地上生物量的影响[J].草业学报,2008,17(4):19-25.
[20]贺海波,李彦.干旱、盐胁迫条件下两种盐生植物生物量分配对策的研究[J].干旱区研究,2008,25(2):242-247.
[21]何丹,李向林,万里强,等.施用尿素当年对退化天然草地物种地上生物量和重要值的影响[J].草地学报,2009,18(3):154-158.
[22]李凯辉,胡玉昆,王鑫,等.不同海拔梯度高寒草地地上生物量与环境因子关系[J].应用生态学报,2007,18(9):2019-2024.
[23]施建军,马玉寿,董全民,等.“黑土型”退化草地人工植被施肥试验研究[J].草业学报,2007,16(2):25-31.
[24]王忠强,吴良欢,刘婷婷,等.供氮水平对爬山虎(ParthenocissustricuspidataPlanch)生物量及养分分配的影响[J].生态学报,2007,27(8):3435-3441.
[25]张铜会,赵哈林,李玉霖.科尔沁沙地灌溉与施肥对退化草地生产力的影响[J].草业学报,2008,17(1):36-42.
[26]张淑敏,于飞海,董鸣.土壤养分水平影响绢毛匍匐委陵菜匍匐茎生物量投资[J].植物生态学报,2007,31(4):652-657.
[27]赵相山,张承烈.河西走廊芦苇在不同盐渍生境中RuBP羧化酶的比较研究[J].应用生态学报,1994,5(2):152-155.
[28]呼格吉勒图,杨劫,宝音陶格涛,等.不同干扰对典型草原群落物种多样性和生物量的影响[J].草业学报,2009,18(3):6-11.
[29]陈敏,陈亚宁,李卫红,等.塔里木河中游地区3种植物的抗旱机理研究[J].西北植物学报,2007,27(4):747-754.
[30]郝兴明,李卫红,陈亚宁.新疆塔里木河下游荒漠河岸(林)植被合理生态水位[J].植物生态学报,2008,32(4):838-847.
[31]Kaiser J.Rift over biodiversity divides ecologists[J].Science,2000,289:1282-1283.
[32]贺金生,方精云,马克平,等.生物多样性与生态系统生产力:为什么野外观测和受控实验结果不一致?[J].植物生态学报,2003,27(6):835-843.
[33]杜丽,戈峰.生物多样性与生态系统功能的关系研究进展[J].中国生态农业学报,2004,12(2):19-22.
[34]张全国,张大勇.生物多样性与生态系统功能:进展与争论[J].生物多样性,2002,10(1):49-60.
[35]中国科学院南京土壤研究所.土壤理化分析[M].上海:上海科学技术出版社,1983.
[36]袁素芬,陈亚宁,李卫红,等.新疆塔里木河下游灌丛地上生物量及其空间分布[J].生态学报,2006,26(6):1818-1824.
[37]达尔文.物种起源(第6版)[M].周建人,叶笃庄,方宗熙,译.北京:商务印书馆,1995:127-128.
[38]West N E.Biodiversity of rangelands[J].Range Management,1993,46:2-13.
[39]Waide R B,Willing M R,Steiner C F,etal.The relationship between productivity and species richness[J].Annual Review of Ecology and Systematics,1999,30:257-300.
[40]Mittelbach G G,Steiner C F,Scheiner S M,etal.What is the observed relationship between species richness and productivity?[J].Ecology,2001,82:2381-2396.
[41]Guo Q F,Berry W I.Species richness and biomass:Dissection of the hump-shaped relationships[J].Ecology,1998,79:2555-2559.
[42]Gross K L,Willig M R,Gough L,etal.Patterns of species density and productivity at different spatial scales in herbaceous plant communities[J].Oikos,2000,89:417-427.
[43]赵文智,常学礼,李启森,等.荒漠绿洲区芦苇种群构件生物量与地下水埋深关系[J].生态学报,2003,23(6):1138-1146.
[44]Zhao W Z,Chang X L,Li Q S,etal.Relationship between structural component biomass of reed population and ground water depth in desert oasis[J].Acta Ecologica Sinica,2003,23(6):1138-1146.
[45]李取生,邓伟,钱贞国.松嫩平原西部盐沼的形成与演化[J].地理科学,2000,20(4):362-367.
[46]Zheng W J,Chen G C,Zhang C L,etal.Physiological adaptation of habitat by ion distribution in the leaves of four ecotypes of reed(Phragmitesaustralis)[J].Acta Botanica Sinica,2002,44(1):82-87.

