复杂盐碱对黄顶菊种子萌发和幼苗生长的影响及机理初探
冯建永,庞民好,张金林,刘颖超
(河北农业大学植物保护学院,河北 保定071000)
黄顶菊(Flaveriabidentis)是近年来新发现的一种外来入侵植物,属于菊科堆心菊族黄菊属[1]。作为外来入侵生物,黄顶菊具有繁殖率高,扩展蔓延速度快,对引入地适应性强等特点,自从2001年在衡水湖首次发现,在很短的时间内度过了适应期,依靠其繁殖优势和扩张能力,大量繁殖迅速生长,很快挤入了生态系统,占据重要生态位,扰乱生态系统原有的食物链条和系统内的物流和能流秩序,对我国的生态安全造成了严重的威胁。2007年黄顶菊已列为我国的对外检疫对象。
黄顶菊具有广泛的适应性和极强的生命力,根据黄顶菊原产地及其传播入侵区域的生态环境条件,可以判定黄顶菊在我国的适宜生长区域远远不仅局限于目前已知道的天津、河北等地,我国的华北、华中、华东、华南及沿海地区都有可能成为黄顶菊入侵的重点区域[2]。因为入侵时间不很长,目前国内对于黄顶菊的研究主要集中在形态特征、生物学特性、生理特征[2]、入侵途径[3]、传播及对生态环境的影响[4]、化感作用[5]、药剂防治[6]等方面;国外Moran Lemir[7]研究了黄顶菊基本概况和其生物防治的可能性。介绍了黄顶菊作为杂草在阿根廷的分布和蔓延。研究了黄顶菊的形态学,分类学,繁殖特性以及抑制种子萌发的因素。Guglielmone等[8,9]对黄顶菊的次生代谢产物黄酮硫酸盐对血小板的凝集作用、抗凝血效果和作用机制进行了研究。还有大量的研究集中在黄顶菊体内C4重要光合酶[10,11]、C4途径演化[12,13]等方面。黄顶菊种子产量大,其入侵和传播主要通过种子进行,而种子的萌发对种群个体的繁殖、种群的扩展及抵御不良环境有着重要意义[14]。文献报道黄顶菊是一种喜光、喜湿、嗜盐的植物,喜生于富含矿物质及盐分的生境[2],王贵启等[15]研究了光照、温度、土壤含水量和空气相对湿度对黄顶菊种子萌发的影响,任艳萍等[16]从温度、光照、NaCl胁迫及浸种等方面对黄顶菊种子萌发特性进行了探讨。但关于复杂盐碱条件对黄顶菊生长的影响及其耐盐机理国内尚无研究报道。鉴于黄顶菊目前的发生分布主要集中在河北省及与河北省相邻的天津、河南、山东等个别地区,本研究将2种中性盐NaCl、Na2SO4及2种碱性盐Na2CO3、Na HCO3按不同比例混合,模拟出24种与河北省天然盐碱生态条件基本一致的复杂盐碱条件,对黄顶菊种子进行处理,旨在探讨复杂盐碱条件对黄顶菊种子萌发和幼苗生长的影响,同时测定了黄顶菊幼苗受到复杂盐碱胁迫后叶片叶绿素、丙二醛含量及抗氧化酶活性的变化,对其耐盐碱机理进行了初步探讨。从黄顶菊对盐碱胁迫的反应机制方面探讨其生态适应性和入侵机制,为黄顶菊资源利用和控制其蔓延提供理论依据。
1 材料与方法
1.1 供试材料
黄顶菊种子采自河北省衡水湖。
1.2 处理溶液配制
盐溶液的配制参照杨春武等[17]的方法并加以改进,将2种中性盐 NaCl、Na2SO4及2种碱性盐Na2CO3、Na HCO3按不同比例混合,模拟出河北省主要的4种盐碱地成分组成[18,19]。按碱度由大到小的顺序分成A、B、C和D 4个处理组。每组设6个浓度处理。其总盐浓度依次为50,100,150,200,250和300 mmol/L。分别以各浓度标识。如A50即表示A组内盐浓度为50 mmol/L的处理,依次类推,总计为24种处理,各处理的盐分组成比例见表1,所涉及的主要胁迫因素及其强度见表2。

表1 各处理所含盐分及其摩尔比Table 1 Salt composition and its molar ratio of various treatments
1.3 种子处理
挑选饱满的黄顶菊种子,用0.1%的高锰酸钾溶液浸泡消毒,蒸馏水反复冲洗干净后供试验用。将24种处理液分别加到铺有双层滤纸的培养皿(d=9 cm)中,直至滤纸饱和,每个培养皿中均匀放入100粒黄顶菊种子。每个处理4次重复。将培养皿置于光照培养箱中进行培养,控制温度为(30±1)℃,光照为14 h(2 500 lx)/10 h(黑暗)交替。试验期间,用相对应的盐溶液来补充水分,始终保持滤纸湿润而无明水,每天统计各处理的种子发芽数。处理后第10天计算各处理的发芽率和发芽指数,测量幼苗的高度和根长。发芽结束后,将未萌动的种子用蒸馏水冲洗干净后,移入蒸馏水中,在同样的温度和光照条件下使之继续萌发,10 d后统计发芽率。

式中,n为萌发处理后第10天的萌发种子粒数,N为供试种子数。Gt为在t天的种子发芽数,Dt为相对应的种子发芽天数。
1.4 致胁变因素分析
各处理溶液的盐度及Cl-、SO42-、HCO3-、CO32-等离子的浓度根据处理液的实际浓度及比例算出。处理液的p H值,用数字p H计测定。用盐酸滴定法测定各处理液的缓冲量,即用滴定法使1 L处理液的p H值降至与对照相等时所需H+的mmol数[20]。用DPS v7.55版统计软件进行数据的统计学分析。
1.5 黄顶菊对盐碱胁迫的生理反应
在室内种植黄顶菊,待幼苗长至六叶一心期,分别用150 mmol/L的NaCl、复杂盐碱A组合(简称“A”)和复杂盐碱D组合(简称“D”)处理黄顶菊,在处理后12,24,48,72和96 h取样,进行黄顶菊叶片生理指标的测定,测定时各样品重复4次,以清水处理为对照。采用相对电导率法[21]测定细胞膜透性;叶绿素含量的测定参照王晶等[22]的方法;硫代巴比妥酸法[23]测定丙二醛含量;酶液提取参照 Asish等[24]的方法;氮蓝四唑光化还原法[22]测定超氧化物歧化酶活性;愈创木酚法[22]测定过氧化物酶活性;过氧化氢酶活性参照宋凤鸣等[25]的方法测定。
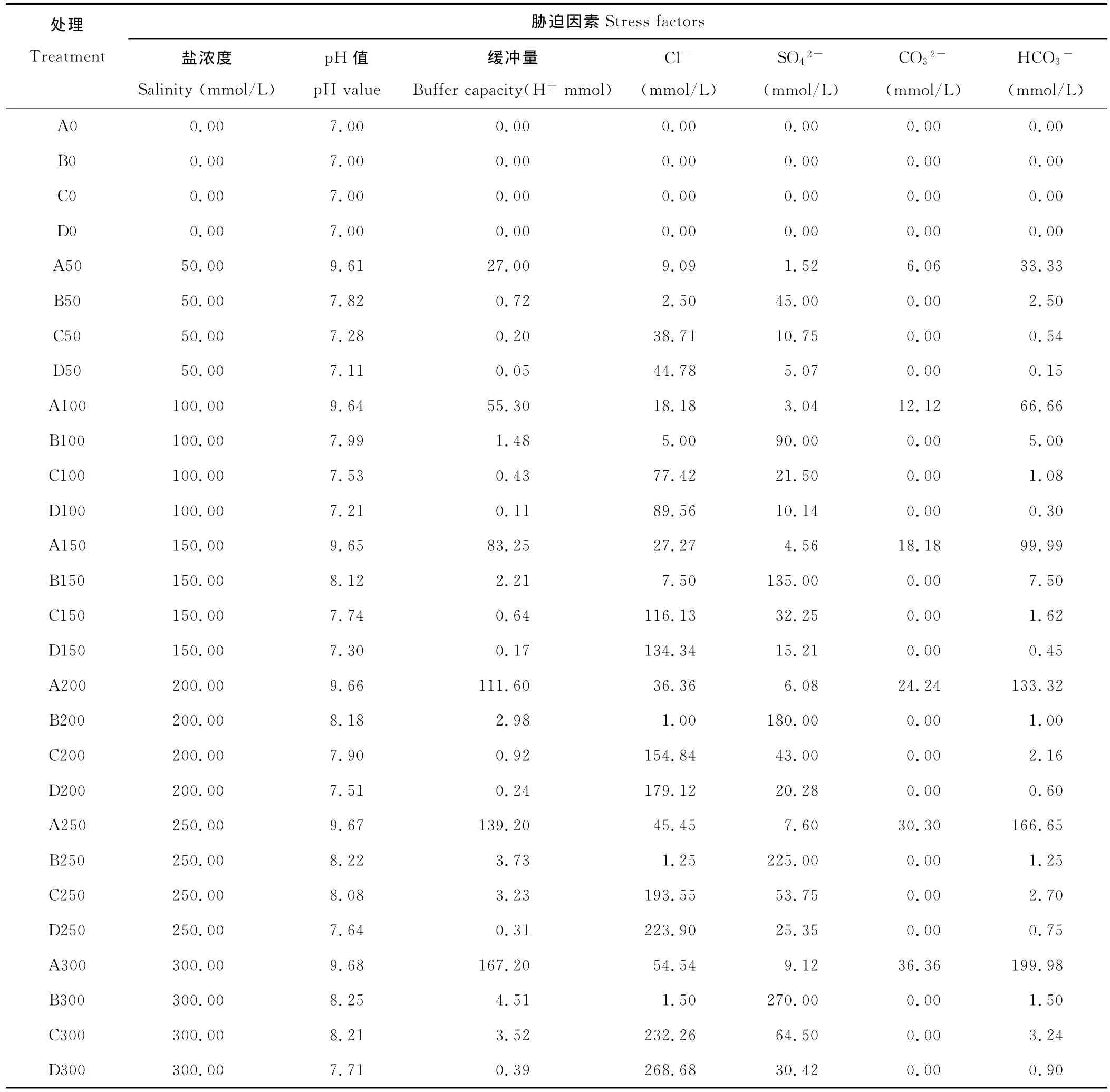
表2 各处理的胁迫因素数据Table 2 Data of stress factors for various treatments
2 结果与分析
2.1 混合盐碱条件对黄顶菊种子萌发和幼苗生长的影响
2.1.1 混合盐碱条件对黄顶菊种子萌发的影响 盐浓度与A、B、C、D 4组的发芽率和发芽指数均表现为负效应,随着盐浓度的增加,各组的发芽率和发芽指数均呈下降趋势,当盐浓度达到300 mmol/L时各处理组的黄顶菊种子均不能萌发;盐溶液碱性越强,发芽率和发芽指数下降幅度越大,如盐浓度在100 mmol/L时,A处理的发芽率、发芽指数分别为50.24%和6.13,当盐浓度达到150 mmol/L时,与盐浓度为100 mmol/L相比A处理的发芽率、发芽指数分别下降了51.11%和70.31%;随着A、B、C、D各处理碱性的增强,终止黄顶菊萌发的盐浓度也有所降低,如A处理的盐浓度在200 mmol/L时黄顶菊已经停止萌发,而B处理的盐浓度在200 mmol/L时仍有近40%的黄顶菊能够萌发,当盐浓度在250 mmol/L时黄顶菊则停止萌发(图1)。
2.1.2 混合盐碱条件对黄顶菊幼苗生长的影响 混合盐碱条件对黄顶菊幼苗生长的影响显示(图2),除D50处理的黄顶菊根长稍大于对照处理外,盐浓度与A、B、C、D 4组处理的根长和茎高均表现为负效应。在相同盐浓度的处理下,随着盐溶液碱性的降低各处理的根长和茎高均呈增大趋势,如盐浓度在100 mmol/L时A、B、C、D各处理的茎高分别为1.72,3.99,5.47和7.72 mm,差异达到显著水平。
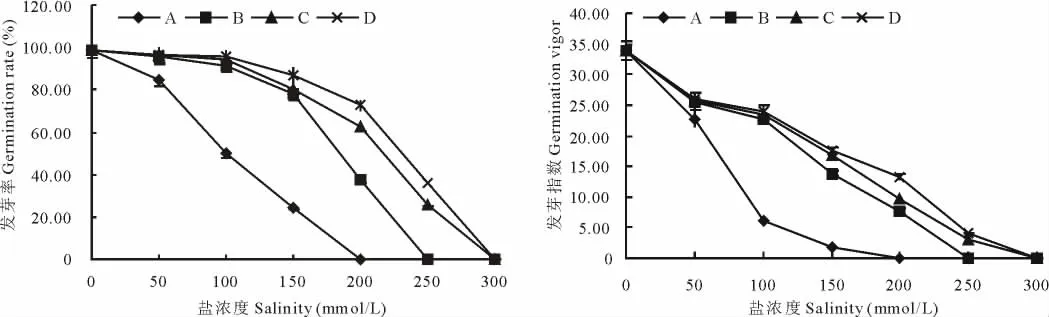
图1 盐浓度对黄顶菊种子萌发的影响Fig.1 Effects of salinity on the germination of F.bidentis
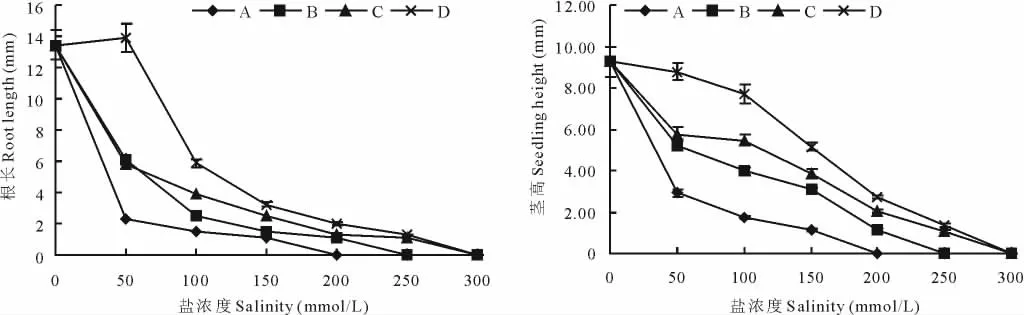
图2 盐浓度对黄顶菊幼苗生长的影响Fig.2 Effects of salinity on the seedling growth of F.bidentis
2.2 解除盐碱胁迫后黄顶菊种子的发芽率
解除盐碱胁迫后,未萌发的黄顶菊种子仍能继续萌发(图3)。恢复发芽率随着处理前盐浓度的升高而增加,当盐浓度<150 mmol/L时,B、C、D各处理的恢复发芽率差异不显著,但显著低于A处理,当盐浓度>150 mmol/L时,B处理的恢复发芽率迅速升高,显著高于C、D处理,当处理前盐浓度为300 mmol/L时,各处理的恢复发芽率无明显差异,均高于50%;在恢复萌发的过程中,C、D处理的萌发率差异不显著。
2.3 各胁迫因素与黄顶菊种子萌发和幼苗生长的各指标的统计学分析
2.3.1 各胁迫因素与黄顶菊种子萌发和幼苗生长的各指标的相关性分析 黄顶菊的发芽率、发芽指数、根长、茎高与各胁迫因素均表现为负相关(表3)。盐浓度、p H值、缓冲量、CO32-、HCO3-与发芽率相关均达极显著水平(P<0.01),SO42-与发芽率相关达显著水平(P<0.05),只有Cl-与发芽率相关不显著。发芽指数与盐浓度、p H值、缓冲量相关达极显著水平(P<0.01),与Cl-、SO42-、CO32-、HCO3-相关达显著水平(P<0.05)。茎高与盐浓度、p H值相关达极显著水平(P<0.01),与缓冲量、SO42-、CO32-、HCO3-相关达显著水平(P<0.05),与Cl-相关不显著。根长与盐浓度、p H值相关达极显著水平(P<0.01),与Cl-、SO42-相关达显著水平(P<0.05),与缓冲量、CO32-、HCO3-相关不显著。在7个胁迫因素中,盐浓度和p H值与发芽率、发芽指数、茎高、根长之间相关均达极显著水平(P<0.01),其相关系数明显大于其他5个胁迫因素。可见盐浓度和p H值对黄顶菊种子萌发和幼苗生长的影响明显大于缓冲量、Cl-、SO42-、CO32-、HCO3-等胁迫因素。同时,盐浓度与黄顶菊各测定指标的相关系数均大于p H值与黄顶菊各测定指标的相关系数。
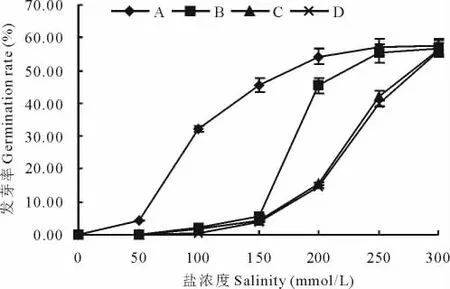
图3 解除盐碱胁迫后黄顶菊种子的发芽率Fig.3 The germination rate of F.bidentis released from salt and alkali stress
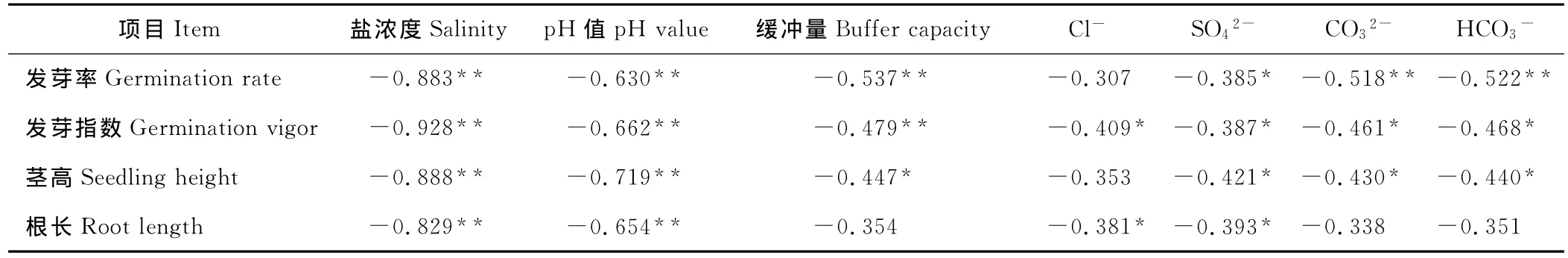
表3 各胁迫因素与黄顶菊各测定指标的相关系数Table 3 Correlation coefficients between the stress factors and index of F.bidentis
2.3.2 方差分析 处理组即本实验设计的碱性盐比例不同的A、B、C、D 4组,以碱性盐比例即处理组代表碱胁迫强度,以每一处理组的总盐浓度即盐度代表其盐胁迫强度,分别对黄顶菊发芽率、发芽指数、根长、茎高与盐、碱胁迫之间的关系进行双因素方差分析(表4)。表中F=方差(MS)/误差(error),F值越大差异越大。黄顶菊发芽率、发芽指数、根长、茎高的双因素方差分析结果均表现为盐浓度的F值远大于处理组的F值,即盐胁迫对黄顶菊种子萌发和幼苗生长的影响远大于碱胁迫。
2.4 黄顶菊对盐碱胁迫的生理反应
2.4.1 盐碱胁迫对黄顶菊叶片膜透性的影响 在盐胁迫处理12 h后,3种不同盐比例胁迫处理的相对电导率均显著大于对照处理(图4),表明在盐胁迫过程中黄顶菊的细胞膜遭到了破坏,细胞内含物外渗,使外渗液的电导度增大。而且随着胁迫时间的延长,不同盐胁迫处理的相对电导率逐渐增大,如在单盐NaCl胁迫处理后12,24,48,72,96 h的相对电导率分别为37.37%,40.37%,45.23%,56.24%,59.21%。不同盐比例胁迫处理相同时间,随着处理碱度的增加相对电导率逐渐增加,如在胁迫处理后72 h,单盐NaCl、复杂盐碱D组合、复杂盐碱A组合的相对电导率分别为56.24%,57.89%,68.24%,分别比同时期对照增加了162.19%,169.88%,218.14%,但单盐NaCl处理与复杂盐碱D组合对黄顶菊叶片膜透性的影响差异不显著。由此推测盐碱胁迫均可增强黄顶菊的细胞膜透性,且碱胁迫的影响大于盐胁迫。
2.4.2 盐碱胁迫对黄顶菊叶片叶绿素含量的影响 随着胁迫时间的延长,3种不同盐比例胁迫处理对黄顶菊叶片叶绿素的破坏率增大,如在复杂盐碱D组合胁迫处理黄顶菊12,24,48,72,96 h后,其叶绿素相对破坏率分别为1.83%,4.60%,9.19%,10.26%,12.24%。不同盐比例胁迫处理在相同胁迫时间下对叶绿素的相对破坏率随着处理碱度的增加逐渐增加,如在胁迫处理后48 h单盐NaCl、复杂盐碱D组合、复杂盐碱A组合处理对黄顶菊叶片的相对破坏率分别为8.51%,9.19%,10.71%(图5)。
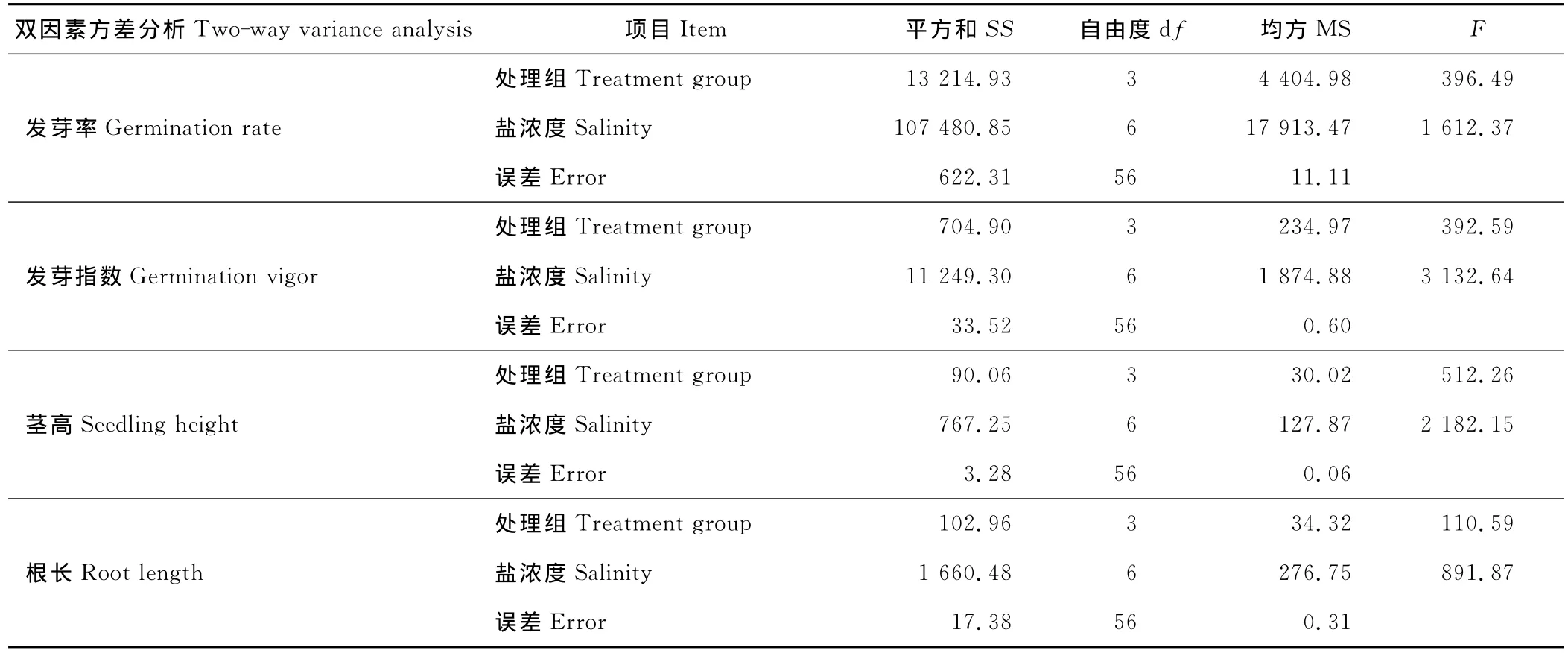
表4 双因素方差分析结果Table 4 Result of two-way variance analysis(ANOVA)
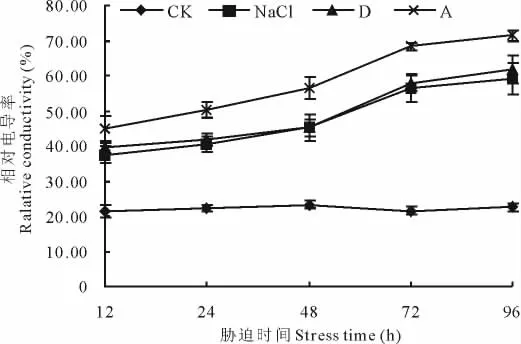
图4 盐胁迫对黄顶菊叶片膜透性的影响Fig.4 Effect of salt stress on electrolyte leakage of F.bidentis in leaves
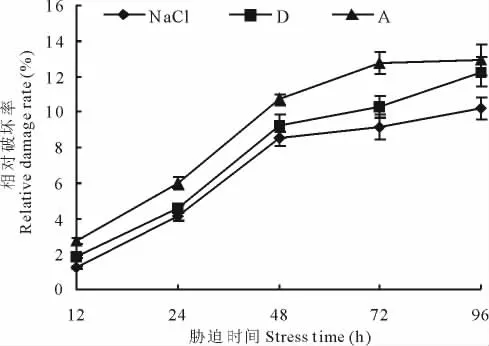
图5 盐碱胁迫对黄顶菊叶片叶绿素含量的影响Fig.5 Effect of saline-alkali stress on chlorophyll of F.bidentis in leaves
2.4.3 盐碱胁迫对黄顶菊叶片丙二醛含量的影响 在盐碱胁迫处理24 h内,各处理的丙二醛含量差异不显著,在处理后48 h内,单盐NaCl胁迫处理丙二醛含量与对照差异不显著。随着胁迫时间的延长各处理丙二醛含量逐渐增加(图6)。如在处理后96 h,单盐NaCl、复杂盐碱D组合、复杂盐碱A组合处理的丙二醛含量分别比对照处理高35.80%,51.14%,59.22%。不同盐比例胁迫处理在相同胁迫时间下丙二醛含量也不同,随着处理碱度的增加丙二醛的含量逐渐增加,如在胁迫处理后96 h,单盐NaCl、复杂盐碱D组合、复杂盐碱A组合处理的丙二醛含量分别为787.64,876.56,923.45μmol/g。由此可知,随着盐碱胁迫处理的时间延长,碱度的增加,对黄顶菊叶片的伤害程度越大。
2.4.4 盐碱胁迫对黄顶菊叶片抗氧化酶活性的影响 盐碱胁迫处理后12 h内,SOD(图7)的活性与对照相比没有显著差异,胁迫处理24 h后活性达到最高水平,显著大于对照处理,如胁迫处理后24 h,单盐NaCl、复杂盐碱D组合、复杂盐碱A组合的SOD活性分别比对照处理高10.6%,26.8%和41.0%,24 h后二者活性逐渐降低,处理后96 h,酶活性低于对照处理。在相同的盐胁迫浓度下,不同盐比例胁迫处理随着处理碱度的增加,SOD活性增强,如胁迫处理后24 h,A处理SOD活性显著大于D处理,但盐碱处理48 h后,A处理与D处理SOD活性差异不显著,但显著高于单盐NaCl及对照处理。
盐碱胁迫处理12 h内,POD活性与对照相比没有显著差异(图8)。盐碱胁迫处理12 h后,POD活性逐渐升高,24 h达到最高,显著高于对照处理,随着处理时间的延长,POD活性呈降低趋势,盐碱胁迫处理96 h后,单盐NaCl、复杂盐碱D组合、复杂盐碱A组合处理POD酶活性显著低于对照处理。
盐碱胁迫处理后,包括对照在内的所有处理CAT活性随着时间的延长均呈上升趋势。但其相对酶活性(各处理酶活性与相同时间对照酶活性的比值)之间差异不显著(图9)。
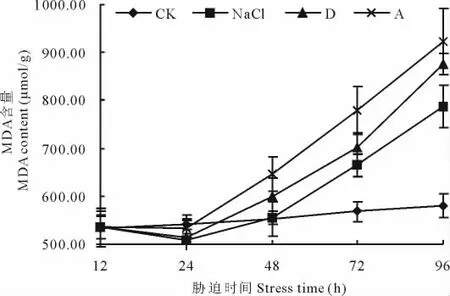
图6 盐碱胁迫对黄顶菊叶片丙二醛含量的影响Fig.6 Effect of saline-alkali stress on MDA of F.bidentis in leaves
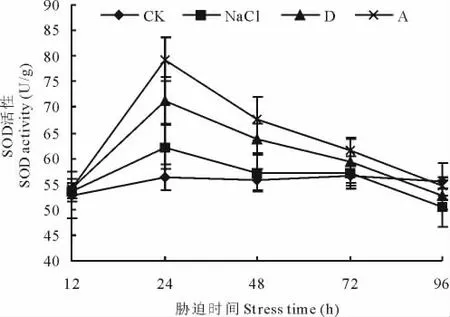
图7 盐碱胁迫对黄顶菊叶片超氧化物歧化酶活性的影响Fig.7 Effect of saline-alkali stress on SOD of F.bidentis in leaves
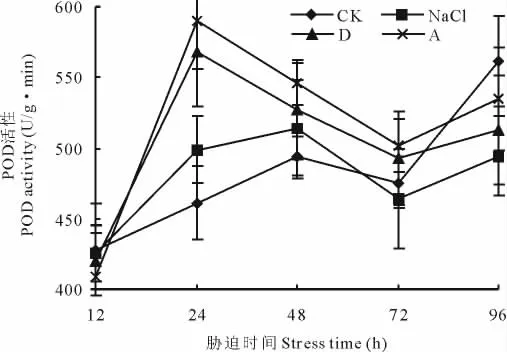
图8 盐碱胁迫对黄顶菊叶片过氧化物酶的影响Fig.8 Effect of saline-alkali stress on POD of F.bidentis in leaves
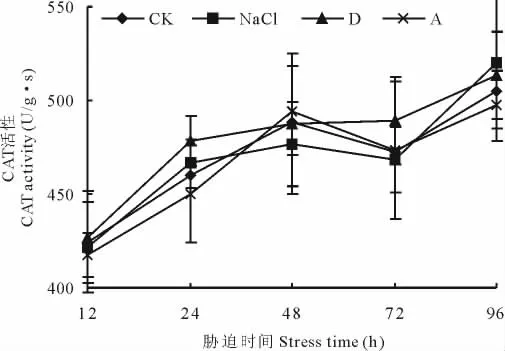
图9 盐碱胁迫对黄顶菊叶片过氧化氢酶的影响Fig.9 Effect of saline-alkali stress on CAT of F.bidentis in leaves
3 讨论
本实验用天然盐碱地普遍存在的4种致害盐分按河北省盐碱地的盐分组成特点进行混合,模拟出24种可以代表河北省各种盐碱地的胁迫条件处理黄顶菊种子。结果表明,盐、碱胁迫对黄顶菊种子萌发和幼苗生长的影响均表现为负相关。统计学分析结果表明在诸多胁迫因素中盐度为主导因素,其对黄顶菊种子萌发和幼苗生长的影响明显大于其他因素。
盐胁迫是通过离子毒害及渗透胁迫来影响植物[26-28]。在种子萌动阶段与环境的物质交流以吸水为主,所以,在黄顶菊种子萌动阶段,以渗透胁迫为主。随着盐度胁迫的增强,黄顶菊种子周围水势下降,细胞内外水势差也随之变小,种子吸水困难,由于吸水不足,种子难以萌发。将未萌动的种子用蒸馏水冲洗干净复萌后发现,黄顶菊种子仍能继续萌发,而且未萌发种子的发芽率随盐浓度的增加而升高,其中以A300处理的恢复发芽率最高为57.36%,充分说明黄顶菊种子在低水势情况下能保持种子活力,处于临时休眠状态,暂不萌发,到生长水势适宜时再萌发、生长,完成生活周期。这很有可能是黄顶菊耐盐碱的一种机制,也可能是黄顶菊对引入地适应性强的一种机制。
叶绿素是对盐胁迫最敏感的细胞器,是重要的光合作用物质,叶绿素代谢是一个动态平衡过程,盐碱胁迫下,植物细胞色素系统遭到破坏,导致叶绿素含量降低[29]。
正常生长条件下,植物体内活性氧的产生和清除之间保持着一种动态平衡,当植物遭受胁迫时,这种平衡就被破坏,首先影响的是生物膜。往往发生膜脂过氧化作用,丙二醛是膜脂过氧化作用的最终分解产物,其含量可以反映植物遭受逆境伤害的程度。在盐碱胁迫下,植物体内活性氧产生与清除的动态平衡被打破,造成活性氧的积累,而SOD、POD、CAT是植物体内活性氧清除系统中的3种重要抗氧化酶,能有效阻止活性氧在植物体内的积累。黄顶菊在遭受盐碱胁迫时,虽然叶片细胞膜和叶绿素受到了不同程度的破坏,在盐碱胁迫处理24 h内,各处理的丙二醛含量差异不显著,推测在胁迫发生时,植物本身可以通过自身的机制加以调节,使其细胞膜的破坏降到最小,随着胁迫时间的延长,细胞膜受到严重破坏,丙二醛的含量逐渐增加。其主要的原因可能是混合盐碱胁迫下,虽然酶系统的功能加强,但其调节能力有限,因而体内还是积累了过剩的氧自由基,这些氧自由基又引起膜的过氧化,产生了大量的MDA,使MDA含量上升[30]。但是在胁迫初期黄顶菊叶片体内的SOD活性随着碱浓度的提高而增加,24 h之后逐渐下降,96 h后其活性便低于对照处理。因为植物在遭受逆境胁迫时,产生的氧自由基数量增多,为了抵抗逆境对植物造成的伤害,超氧化物歧化酶的活性增加,以便清除氧自由基,减少膜脂过氧化,并随着时间的推移逐渐消耗SOD,使其酶活性降低[31]。POD的活性盐碱胁迫24 h内与对照相比显著增加,随后呈下降趋势,72 h后又开始上升,但仍低于对照处理,在短期盐碱胁迫时能及时清除叶片中积累的活性氧,暂时维持活性氧产生与清除的动态平衡,说明POD活性是逐渐适应环境而变化的[32]。由此推测,SOD和POD是清除盐碱胁迫初期黄顶菊叶片中积累的活性氧的主要抗氧化酶。随着胁迫时间的延长二者的活性逐渐降低,表明SOD和POD对盐碱胁迫比较敏感,其酶结构极易遭受破坏。致使在胁迫处理后期黄顶菊叶片中的丙二醛逐渐累积。这有可能是黄顶菊耐盐碱的另一种机制。
综上所述,在盐碱胁迫下黄顶菊体内氧自由基大量产生,导致丙二醛含量的升高,其抗氧化酶系统中,SOD、POD协同作用,维持了植物体内活性氧的产生和清除之间的动态平衡。植物的抗逆反应是一个涉及到众多基因,受多途径调控的复杂过程,有关黄顶菊在盐碱胁迫下SOD、POD活性诱导的分子机理尚需进一步深入研究。
[1]芦站根,崔兴国,蒋文静.衡水湖黄顶菊的入侵情况的初步调查研究[J].衡水学院学报,2006,8(1):69-71.
[2]高贤明,郑云翔,唐廷贵,等.外来植物黄顶菊的入侵警报及防控对策[J].生物多样性,2004,12(2):274-279.
[3]郭成亮,胡文多,朱敏峰,等.有害杂草黄顶菊在河北衡水的入侵途径调查[J].植物检疫,2007,21(3):187-188.
[4]郑云翔,郑博颖.黄顶菊的传播及对生态环境的影响[J].杂草科学,2007,(2):30-31.
[5]许文超,徐娇,陶哺,等.外来入侵植物黄顶菊的化感作用初步研究[J].河北农业大学学报,2007,30(6):63-67.
[6]李香菊,王贵启,张朝贤,等.外来植物黄顶菊的分布、特征特性及化学防除[J].杂草科学,2006,(4):58-61.
[7]Moran Lemir A H.Biology ofPhaedonconsimilisStal(Coleoptera:Chrysomelidae)and the effect of its attack onFlaveriabidentis(L.)O.K.(Compositae)in Tucuman and Santiago del Estero(Argentina)[J].Revista de Investigacion,1983,1(3):103-115.
[8]Guglielmone H A,Agnese A M,Montoya S C N,etal.Anticoagulant effect and action mechanism of sulphated flavonoids fromFlaveriabidentis[J].Thrombosis Research,2002,105(2):183-188.
[9]Guglielmone H A,Agnese A M,Nunez-Montoya S C,etal.Inhibitory effects of sulphated flavonoids isolated fromFlaveria bidentison platelet aggregation[J].Thrombosis Research,2005,115(6):495-502.
[10]Sasha G T,Sandra K T,Nicole Vella,etal.TheFlaveriabidentisβ-Carbonic anhydrase gene family encodes cytosolic and chloroplastic isoforms demonstrating distinct organ-specific expression patterns[J].Plant Physiology,2007,144(6):1316-1327.
[11]Furumoto T,Izui K,Quinn V,etal.Phosphorylation of phosphoenolpyruvate carboxylase is not essential for high photosynthetic rates in the C-4 speciesFlaveriabidentis[J].Plant Physiology,2008,144(4):1936-1945.
[12]Maurice S B K,Russell K M,Robert O L,etal.Photosynthetic characteristics of C3-C4intermediateFlaveriaspecies:I.Leaf anatomy,photosynthetic responses to O2and CO2,and activities of key enzymes in the C3and C4pathways[J].Plant Physiology,1983,71:944-948.
[13]Engelmann S,Wiludda C,Burscheidt J,etal.The gene for the P-subunit of glycine decarboxylase from the C-4 speciesFlaveriatrinervia:Analysis of transcriptional control in transgenicFlaveriabidentis(C-4)andArabidopsis(C-3)[J].Plant Physiology,2008,146(4):1773-1785.
[14]杨逢建,张衷华,王文杰,等.八种菊科外来植物种子形态与生理生化特征的差异[J].生态学报,2007,27(2):442-449.
[15]王贵启,苏立军,王建平.黄顶菊种子萌发特性研究[J].河北农业科学,2008,12(4):39-40.
[16]任艳萍,古松,江莎,等.温度、光照和盐分对外来植物黄顶菊种子萌发的影响[J].云南植物研究,2008,30(4):477-484.
[17]杨春武,贾娜尔·阿汗,石德成,等.复杂盐碱条件对星星草种子萌发的影响[J].草业学报,2006,15(5):45-51.
[18]龚子同.中国土壤系统分类:理论·方法·实践[M].北京:科学出版社,1999.
[19]丁鼎治.河北土种志[M].河北:河北科学技术出版社,1992.
[20]石德成,盛艳敏,赵可夫.复杂盐碱条件对向日葵胁迫作用主导因素的实验确定[J].作物学报,2002,28(4):461-467.
[21]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:258-263.
[22]王晶,敖红,张杰,等.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003:52-53.
[23]姜述君,强胜,朱云枝.画眉草弯孢毒菌除草活性化合物的分离鉴定及其生物活性测定[J].植物保护学报,2006,33(3):313-318.
[24]Asish K P,Anath B D,Prasanna M.Defense potentials to NaCl in a mangrove.BruguieraParuiflora:Differential changes of isoforms of some antioxidative enzymes[J].Journal of Plant Physiology,2004,161(12):531-542.
[25]宋凤鸣,葛秀春,郑重.活性氧基膜脂过氧化与棉花对枯萎病抗性的关系[J].植物病理学报,2001,31(2):110-116.
[26]段德玉,刘小京,李存桢,等.N素营养对NaCl胁迫下盐地碱蓬幼苗生长及渗透调节物质变化的影响[J].草业学报,2005,14(1):63-68.
[27]李品芳,杨志成.NaCl胁迫下高羊茅生长及K+、Na+吸收与运输的动态变化[J].草业学报,2005,14(4):58-64.
[28]Bayuelo-Jiménez J S,Craig R,Lynch J P.Salinity tolerance ofPhaseolusspecies during germination and early seedling growth[J].Crop Science,2002,42:1584-1594.
[29]贾文庆,刘会超.NaCl胁迫对白三叶一些生理特性的影响[J].草业科学,2009,26(8):187-189.
[30]张远冰,刘爱荣,方蓉.外源一氧化氮对镉胁迫下黑麦草生长和抗氧化酶活性的影响[J].草业学报,2008,17(4):57-64.
[31]张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
[32]张新虎,何静,沈惠敏.苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探[J].草业学报,2008,17(6):99-104.

