刚地弓形虫细胞培养上清对人结肠癌细胞sw480增殖与凋亡的影响
高 剑,叶 彬,武卫华
刚地弓形虫(Toxoplasma gonadii)是一种广泛存在于人和动物的专性细胞内寄生原虫,虫体侵入细胞后均可诱导细胞凋亡和坏死,其中细胞坏死主要是虫荷增殖到一定程度胀破胞膜所致,而对宿主细胞的凋亡则依赖于分泌某些特殊物质。弓形虫速殖子与宿主细胞相互作用的研究一直受到关注,但大多数探索建立于动物细胞〔1〕和组织模型〔2〕基础并以更深入挖掘弓形虫致细胞病变效应为初衷,以更好地防治弓形虫病为目的。对于弓形虫杀伤肿瘤细胞的生物活性探索尚少,迄今为止只有弓形虫诱导人白血病细胞K562凋亡的报道〔3〕。弓形虫侵入细胞后,宿主细胞的归宿与虫株毒力和感染强度,以及细胞种类均有关系,对吞噬性细胞以致其坏死为主,对非吞噬性细胞则以诱导其凋亡为主〔4〕。感染了弓形虫的宿主细胞,可抵御多种诱导物引发的细胞凋亡,此种现象可能与弓形虫维持宿主细胞存活保证自身虫荷增殖有关,涉及多种机制〔5-11〕,且经弓形虫感染的细胞可分泌某些活性物质于培养基中,从而诱导未遭受感染的“旁观者”细胞凋亡〔12〕。据国内外学者报导,刚地弓形虫国际标准强毒株RH株速殖子具有细胞寄生广谱,感染速度快,细胞病变明显等特点,且其培养上清亦有一定诱导细胞凋亡的效力〔12-13〕,本文以人结肠癌细胞sw480细胞系为体外研究对象,建立人结肠癌细胞sw480细胞系与弓形虫速殖子体外共培养模型并提取培养上清,初步探索这种培养共上清对sw480细胞增殖和死亡方式的影响,以期从弓形虫感染肿瘤细胞过程中发现能杀伤肿瘤细胞的活性成分。
1 材料与方法
1.1 实验材料
1.1.1 虫株及细胞 弓形虫RH株由山西医科大学寄生虫学教研室提供;人结肠癌sw480细胞、人宫颈癌Hela细胞分别由重庆医科大学病理生理学教研室和生化与分子生物学教研室提供。
1.1.2 试剂及仪器 Ckk-8细胞生长检测试剂盒购自日本株氏会社同仁化学研究所,DMEM、PRMI-1640培养基为美国Gibco公司产品,胎牛血清为杭州四季青产品,细胞凋亡ANNEXIN-V-FITC染色试剂盒为美国Bipec产品,Hochest33258细胞凋亡染色试剂盒、DNA ladder试剂盒为南京凯基生物有限公司产品,琼脂糖、100 bp DNA标志物为天根生物工程有限公司产品,其他试剂均为国产分析纯。细胞培养和检测仪器均由重庆医科大学分子与肿瘤研究中心和生命科学院提供。
1.2 方法
1.2.1 弓形虫速殖子悬液的制备 收集人宫颈癌细胞Hela细胞系体外培养(DMEM培养基,4%胎牛血清,100U/mL氨苄青霉素,100U/mL硫酸链霉素)3~5d的弓形虫细胞混合悬液,3 000r/min离心10min去上清,以胰酶消化法结合Ficoll-Urografin密度梯度离心法〔14〕纯化虫体并以PRMI-1640培养基,4%胎牛血清,100U/mL氨苄青霉素,100U/ml硫酸链霉素制备成速殖子悬液。
1.2.2 弓形虫速殖子和sw480细胞共培养模型的建立及共培养上清的收集 人结肠癌sw480细胞以PRMI-1640培养液中加入10%胎牛血清,100U/ml氨苄青霉素,100U/ml硫酸链霉素为培养基环境,置37℃的5%CO2培养箱常规传代培养。收集传代72h后的细胞制成1×106/mL细胞悬液,接种至50 mL培养瓶,足量培养基培养24 h后,换液并分别接种不同浓度(2×106/mL、4×106/mL、8×106/mL、16×106/mL)的弓形虫速殖子悬液各1mL,并添加新鲜培养基至3mL/瓶。将所建立模型分别命名为A、B、C、D组。
常规培养上述各组模型72 h,将培养液以2 500 r/min离心 10 min,收集所得上清液,以直径为0.22 μ m的无菌滤器过滤,将滤液分装至1.5mL无菌EP管中,-20℃冻存,用前以 37℃水浴迅速融化。
1.2.3 吉氏染色观察弓形虫速殖子在sw480细胞内的寄生 将常规培养的sw480细胞以5×104/mL接种于24孔细胞培养板中,每孔1 mL,24h后吸弃培养液接种入1×106/孔弓形虫速殖子悬液,倒置显微镜下观察细胞生长状况,48 h后以细胞刮匙收集孔中细胞,1 500 r/min,离心10 min涂片,常规吉氏染色,油镜观察并拍照。
1.2.4 Ckk-8比色法观察sw480细胞抑制率 取对数生长期密度为5×104/mL的sw480细胞,接种于3个96孔培养板上,100μL/孔。常规培养过夜,吸弃培养基,分别加入制备好的A、B、C、D各模型组共培养上清(50μL/孔),并以新鲜培养基添补至100μL/孔,每组设5个复孔。对照组加入等体积新鲜培养液,分别培养12 h、24 h、48 h。实验终止前2h每孔加入ckk-8试剂10μL,培养结束时以酶标仪检测吸光度(A450值),按公式计算sw480细胞抑制率。重复操作3次。

1.2.5 流式细胞仪测细胞凋亡与坏死率 取对数生长期sw480细胞(密度为2×106/瓶)接种于 5个50 mL培养瓶中,常规培养过夜,取其中4瓶作为实验组分别加入上述4种模型的共上清液3 mL,以新鲜培养基添补至终体积6 mL,对照组加入6 mL新鲜培养基。分别培养24 h、48 h、72 h后,细胞刮匙收集细胞,制备单细胞悬液,调细胞浓度为106/mL,取细 胞悬液 25μL 加 入 500μL 的 Binding Buffer悬浮细胞,加入 5μL Annexin-v-FITC 混匀后,加入5μL PI混匀,室温避光反应10 min后进行FACScan检测。
1.2.6 琼脂糖凝胶电泳分析凋亡细胞DNA片段化 按照1.2.5的方法收集sw480细胞,按照凯基细胞凋亡 DNAladder试剂盒说明操作。所提取DNA以TE buffer充分溶解,1.5%琼脂糖凝胶电泳60 min,紫外透射仪观察并拍照。
1.2.7 荧光显微镜观察 sw480细胞凋亡 按照1.2.5的方法制备细胞悬液,收集5×105个细胞(作用时间为48h),4℃PBS洗2遍,1 000 r/min离心5 min,4%多聚甲醛℃固定10 min,1 000 r/min离心10min,所得沉淀以50~ 100μL PB S 重悬,涂片,自然晾干,Hochest33258染料1∶10稀释成工作液浓度,50~100μL常温避光染色10 min,水冲洗晾干,340 nm紫外光激发荧光显微镜观察。
1.2.8 凋亡与坏死细胞透射电镜样品制备与观察按照1.2.5的方法制备细胞悬液,离心收集细胞,迅速以4℃预冷的2.5%戊二醛固定细胞2 h以上,再用锇酸进行双重固定。经梯度乙醇脱水,环氧树脂包埋,超薄切片。醋酸铀、柠檬酸铅双重染色后,透射电镜下观察并照相。
1.3 统计分析 所有数据均采用 SPSS13.0统计软件进行分析。
2 结 果
2.1 弓形虫RH株速殖子与人结肠癌sw480细胞体外共培养模型 以24孔板常规培养 sw480细胞,传代过夜后添加RH株速殖子悬液并继续培养,倒置显微镜下观察可见3~5d细胞病变明显,贴壁细胞成批脱落,并呈圆球状悬浮于培养孔中,细胞刮匙搜集孔底和孔中细胞离心涂片吉氏染色并观察发现典型弓形虫寄生现象(图1),证明弓形虫 RH株速殖子可在sw480细胞中寄生,体外共培养模型建立条件成熟。

图1 吉氏染色观察弓形虫RH株速殖子在sw480细胞内寄生并增殖Fig.1 The parasitism and proliferation in sw480 cells of Toxoplasma gondii tachyzoites(Giemsa staining,×1000)
2.2 共培养上清对sw480细胞增殖的抑制作用将上述A、B、C、D四个模型组提取的弓形虫速殖子与sw480共培养上清分别作用于sw480细胞12h、24 h、48 h,cck-8法检测细胞A(450)值并计算抑制率,结果发现12h各实验组与对照组相比对细胞的生长抑制均不明显,原培养模型中虫数较低的A、B、C 3组所得共上清甚至表现出促进sw480生长的作用,24 h后各模型组共上清对sw480细胞的生长均有不同程度的抑制作用,且随着作用时间的增加,sw480细胞抑制率也增加,其中以C组模型共上清(虫/细胞为8∶1组)对细胞的增殖抑制作用尤为明显,48h细胞增殖抑制率可达44.55%。各实验组抑制率与对照组比较(表1),差异显著(P<0.05)。

表1 共培养上清作用后的sw480细胞抑制率Table 1 Inhabitation ratio of proliferation of sw480cell treated with different models of supernatant
2.3 流式细胞仪检测细胞凋亡情况 各共培养模型组培养上清分别作用 sw480细胞24、48、72 h,流式细胞仪检测结果如表2,结果显示24 h后相对于对照组,各实验组细胞早期凋亡率和晚期凋亡与坏死共同率已有明显增加,作用48h时各实验组早期凋亡率均达到最大值,其中D模型组(虫/细胞=16:1)达到最大早期凋亡率11.54%,48h后各实验组细胞晚期凋亡和坏死率明显增加,早期凋亡率开始减少。处理72h的C模型组(虫/细胞=8∶1)上清致细胞总死亡率可达46.11%,杀伤效果在各实验组中最为明显。
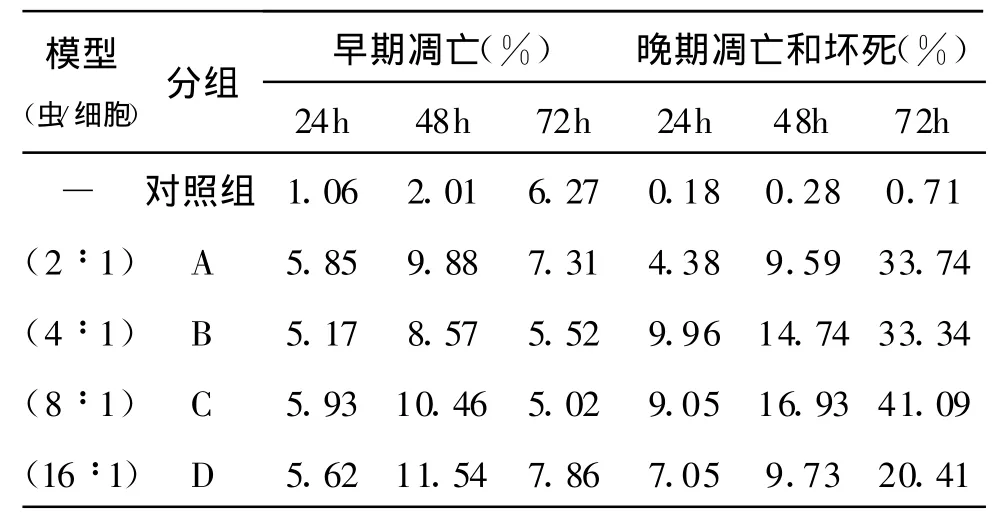
表2 不同模型组培养共上清作用sw480细胞不同时间后细胞凋亡率和坏死率Table 2 Effect of culture supernatant of Toxoplasma on apoptosis and necrosis of sw480 cell at different models and different time points.
2.4 细胞DNA琼脂糖凝胶电泳结果不同培养模型的弓形虫速殖子与sw480细胞培养共上清孵育sw480细胞72 h,其DNA电泳均出现了相差约200 bp的DNA梯形条带(图2),此为凋亡细胞特有,且只有样品中晚期凋亡细胞达30%作用方可见明显的DNA梯状条带,进一步表明经培养上清处理72 h后,sw480细胞确实发生细胞凋亡,且由前述流式细胞术分选出的晚期凋亡和坏死细胞群落中,多是由凋亡细胞产生的继发性坏死,晚期凋亡细胞占主要分选成分。

图2 sw480细胞DNA凝胶电泳图谱Fig.2 Agarose gel electrophoresis of sw480 DNA
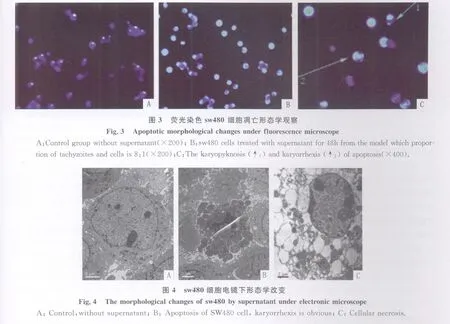
2.5 荧光显微镜观察细胞形态 选择各模型共培养上清作用 48h细胞后置荧光显微镜下观察(图3),可见实验组中凋亡细胞因核染色质聚集对hochest33258染料吸收较强而发出强而亮的蓝色荧光,且可看到核固缩,胞核碎裂等典型细胞凋亡特征。而对照组正常sw480细胞只发出微弱均匀的淡蓝色荧光,坏死细胞不着色,故可证明实验组视野下细胞群落多为凋亡细胞。
2.6 透射电镜观察细胞形态取以虫/细胞为8∶1的RH株速殖子与sw480细胞共培养上清作用48h后的sw480细胞常规制备透射电镜样品做镜下观察(图4),可见正常sw480细胞呈不规则椭圆形或多角形,核较大,核仁明显;坏死细胞轮廓不清,胞膜完整性破坏,胞质呈空泡状改变;凋亡细胞呈现典型的核染色质固缩,核块状化碎裂,但胞膜尚完整。
3 讨 论
凋亡和坏死是细胞死亡的两大形式,所有肿瘤体外药敏试验的研究探索,大多是围绕抑制肿瘤细胞增殖、杀伤肿瘤细胞和诱导肿瘤细胞凋亡这三个方向开展的。在开发抗肿瘤新药的过程中,各种干预物质对肿瘤细胞生长特性的影响研究是后续一系列生物药理活性和临床应用研究工作的基石。刚地弓形虫作为细胞内寄生性原虫物种,其与肿瘤细胞之间的相互作用能够为研发抗肿瘤新药开辟一个新的视点。
以往的研究工作中,大多以动物模型和病理组织作为研究材料来进一步探索弓形虫的致病机理,研究虽然已经深入到细胞层面,但更多探索的是弓形虫对正常细胞的致害效应。而弓形虫对肿瘤细胞的杀伤效应研究鲜少。考虑到弓形虫体内寄生时可控性和观察检测上的难度,以具有致细胞凋亡作用的弓形虫培养上清作为干预手段,则从药物可控性和虫种培养利用上,较直接利用弓形虫速殖子虫株具有更加安全、经济的意义。
细胞培养和昆明小鼠腹腔接种是目前国内外实验室培养弓形虫最常用的方法〔15〕,而任何一种弓形虫速殖子的纯化方法都不能达到100%的纯化率〔16〕。考虑到体外细胞研究必需避免污染和细胞杂交等情况的发生,本研究选择以作为研究对象的人结肠癌细胞sw480担当饲养细胞株来培养弓形虫速殖子并制备上清,一方面为弓形虫的细胞培养途径探索到了新的饲养细胞株种,同时避免了后续研究的各种混淆因素。
本研究采用Ckk-8细胞生长测定方法,较国内普遍采用的MTT细胞生长测定法更为灵敏且重复性好,可确证此种培养共上清对sw480细胞增殖的抑制作用。在对细胞死亡方式的检测中,单一技术和检测方法说服力差且假阳性高,故而需采用多种检测方法分别从细胞凋亡率,细胞凋亡时期,细胞凋亡形态,凋亡细胞核苷酸片段化等层面对此培养上清的凋亡诱导效应进行严谨检测。其中Annexin-v-FITC双染法结合流式细胞技术不仅能精确计算细胞凋亡率,且可分选出早期凋亡细胞与晚期凋亡细胞,已成为国内外广泛采用的较精确的细胞凋亡检测手段〔17〕。凋亡最突出的生化特征是内源性Ca+/Mg+依赖性核酸内切酶的活化在小体连接区切割DNA双链,使DNA降解成200 bp或其整数倍的寡核苷酸片段。细胞DNA琼脂糖凝胶电泳分析可进一步确证凋亡细胞的存在。在细胞形态学检测上,透射电镜可清晰显示凋亡细胞的核固缩核碎裂现象以及坏死细胞的膜空泡状和胞膜破裂改变,但电镜视野单一,必须结合光镜视野以确定凋亡细胞群落的存在,Hochest33258荧光染料作为常用的DNA特异性染料,可清楚显示出凋亡细胞核染色质的凝集、边缘化特征,且可避免坏死细胞对观察视野的混淆。
本研究通过一系列检测手段已确证弓形虫速殖子与sw480细胞的共培养上清不仅能够抑制体外sw480细胞的增殖,还可诱导其凋亡和坏死。其影响sw480细胞增殖和存活的机制尚不可知,推测与感染细胞释放于培养基中的某些活性成分有关。国内外〔12,18〕均报导由弓形虫速殖子诱导的细胞凋亡与一氧化氮(NO)介导的细胞凋亡有关,但不知此种机制是否同样参与共上清诱导肿瘤细胞凋亡的过程中,故计划下一步先检测弓形虫感染肿瘤细胞过程中一氧化氮(NO)量的变化,再通过对NO介导的细胞凋亡机制的研究,深入挖掘培养共上清诱导细胞凋亡和坏死的机制,并分析此共上清中的活性成分,从而为弓形虫速殖子与人肿瘤细胞培养共上清的抑瘤作用,提供更详尽深入的科学依据。
本研究中还观察到弓形虫速殖子与宿主细胞相互作用的另一个现象有待进一步研究。即虫/细胞为8∶1的共培养模型所得上清,对细胞增殖抑制和促细胞凋亡与坏死效力表现均较虫/细胞为16∶1的共培养模型所得上清突出。推测共培养模型所得上清杀伤肿瘤细胞的效力与培养模型中虫荷与细胞数目的比例有关,只有虫荷与细胞比例合适,虫感染细胞的空间合适,所得上清发挥抑制细胞增殖和杀伤细胞的效力方可达明显效果。
〔1〕孟晓丽,殷国荣,刘红丽,等.RH株弓形虫速殖子体外入侵大鼠肠上皮细胞与增殖的动态观察〔J〕.中国寄生虫学与寄生虫病杂志,2009,27(1):39-42.
〔2〕殷国荣,韩剑峰,刘红丽,等.经口感染弓形虫诱导的小鼠肠道粘膜T细胞亚群变化〔J〕.中国寄生虫病防治杂志,2004,17:199-202.
〔3〕张秀昌,蔡念光,孙黎,等.弓形虫诱导人白血病细胞K562凋亡的实验观察〔J〕.中国寄生虫学与寄生虫病杂志,2007,25(3):185-188.
〔4〕李立伟,邵浙新,严 杰.刚地弓形虫对HUVEC、Vero和 J774A-1、THP-1侵入的比较研究〔J〕.中国人兽共患病学报,2006,22(7):597-600.
〔5〕Nash PB,Purner MB,Leon RP,etal.Toxoplasma gondii infected cells are resistant to multiple inducers of apoptosis〔J〕.J Immunol,1998,160:1824-1830.
〔6〕Heussler VT,Kuenzi P,Rottenberg S.Inhibition of apoptosis by intracellular protozoan parasites 〔J〕.Int J Parasitol,2001,31:1166-1176.
〔7〕Goebel S,Gross U,Luder CG.Inhibition of host cell apoptosis by Toxoplasma gondii is accompanied by reduced activation of the caspase cascade and alterations of poly(ADP-ribose)polymerase expression〔J〕.J Cell Sci,2001,114:3495-3505.
〔8〕Nishikawa Y,Makala L,Otsuka H,et al.Mechanisms of apoptosis in murine broblasts by two intracellular protozoan parasites,Toxoplasma gondii and Neospora caninum 〔J〕.Parasite Immunol,2002,24:347-354.
〔9〕Payne TM,Molestina RE,Sinai AP.Inhibition of caspase activation and a requirement for NF-kβ function in the Toxoplasma gondii mediated blockade of host apoptosis 〔J〕.J Cell Sci,2003,116:4345-4358.
〔10〕Molestina RE,Payne TM,Coppens I,et al.Activation of NF-kβ by Toxoplasma gondii correlates with increased expression of antiapoptotic genes and localization of phosphorylated IkB to the parasitophorous vacuole membrane〔J〕.J Cell Sci,2003,116:4359-4371.
〔11〕Sinai AP,Payne TM,Carmen JC,et a1.M echanisms underlying the manipulation of host apoptotic pathways by Toxoplasma gondii〔J〕.Int J Parasitol,2004,34(3):381-391.
〔12〕Nishikawa Y,Kawase O,Vielemeyer O,et al.Toxoplasma gondii infection induces apoptosis in noninfected macrophages:role of nitric oxide and other soluble factors〔J〕.Parasite Immunology,2007,29:375-385.
〔13〕张改,葛以跃,吴江平,等.弓形虫培养上清体外对细胞的影响〔J〕.中国血吸虫病防治杂志,2007,(3):196-199.
〔14〕郑焕欣,陈发凯,陈观今.一种新的弓形虫速殖子纯化方法〔J〕.中国寄生虫病防治杂志,1993,6(2):146.
〔15〕陈永军,王权,龚朋飞,等.弓形虫两种保种方法的实验〔J〕.中国兽医寄生虫病,2007,15(5):22-24.
〔16〕陈观今.中国对弓形虫体外培养和分离纯化的研究〔J〕.热带医学杂志,2000,00:64-67.
〔17〕彭黎明,江虹,Chris Bradley.细胞凋亡和继发性坏死的 Annexin法定量检测〔J〕.华西医大学报,2001,32(4):602-604.
〔18〕杨麦贵,杨阳,黄萍,等.男性不育精液中NO的含量与生殖细胞凋亡的关系〔J〕.细胞与分子免疫学杂志,2005,21(4):510-513.

