2株胞内分枝杆菌临床分离株的鉴定*
潘爱珍,张媛媛,王 心,赵秀芹,万康林
由于非结核分枝杆菌(Non-tuberculosis Mycobacterium,NTM)肺病与结核分枝杆菌(Mycobacterium tuberculosis,M.tuberculosis)引起的肺结核病的临床表现极为相似,容易造成误诊误治,而且非结核分枝杆菌病的发病呈逐年上升趋势〔1〕。因此分枝杆菌的快速准确菌种鉴定对结核病的诊断和鉴别诊断及有效化疗都有极其重要的意义。分子生物学技术鉴定菌种的方法虽有多种〔2〕,但如何联合应用多种分类鉴定方法,克服每项技术的局限性,进而形成标准化体系是未来快速鉴定菌种的趋势。我们在进行结核分枝杆菌临床分离株的oxyR-ahpC间隔耐药区的PCR检测的过程中,发现用PNB,TCH鉴别培养基鉴定为结核分枝杆菌的两株分枝杆菌临床分离株的PCR扩增产物的分子量明显大于结核分枝杆菌,而与胞内分枝杆菌相同,通过联合应用多种分子生物学技术和生物信息学技术对这两株菌株进行定种鉴定,最终确定为胞内分枝杆菌。并为探索新菌种鉴定的特异位点和菌种鉴定技术体系提供初步基础。
1 材料与方法
1.1 6株待鉴定分枝杆菌临床分离株 12个省市的285株(北京13株、福建106株、广西8株、西藏49株、四川 39株、河南19株、湖南 20株、吉林 7株、甘肃17株、新疆4株、陕西1株、浙江2株)临床分离菌株经PNB、TCH鉴别培养基初步鉴定为结核分枝杆菌。从这285株临床分离菌株选取6株,其中包括oxyR-ahpC基因间隔区PCR扩增产物分子量异常的2株和随机选取PCR扩增产物分子量正常的4株。
由中国疾病预防控制中心传染病预防控制所结核病研究室传代培养、保藏。
1.2 标准参考菌株 分枝杆菌标准株,包括结核分枝杆菌标准株(H37Rv)、鸟分枝杆菌(95001),胞内分枝杆菌(95002),由中国疾病预防控制中心传染病预防控制所结核病研究室传代培养、保藏。
1.3 培养基 常规罗氏培养基和PNB、TCH鉴别培养基由中国疾病预防控制中心传染病预防控制所结核病研究室按标准配置方法制备。
1.4 分枝杆菌标准株和临床株DNA CTAB法提取〔3〕,生理盐水收集结核分枝杆菌新鲜培养物50-100mg(湿重),用溶菌酶,10%SDS/蛋白酶K 混合液及CTAB破除细胞壁,去除蛋白,脂类等物质,然后用氯仿萃取,冰乙醇洗涤DNA沉淀,最后用TE溶解DNA沉淀,-20℃保存。
1.5 oxyR-ahpC间隔区PCR扩增、测序分析 引物为oxyR-ahpC1:5'-GCT TGATGTCCGAGAGCATCG-3',oxyR-ahpC2:5'-GGTCGCGTAGGCAGTGCCCC-3'),PCR反应体系为:引物各1.0μL,PCR-mix 20μL,DNA 模板2μL,纯水 16μL。PCR 条件:预变性 94℃10min,变性 94℃1min,退火 60℃1min,延伸72℃1min,循环次数 30次,最后充分延伸72℃10min。扩增产物用1.5%琼脂糖凝胶电泳25min,EB染色20min后,紫外灯下观察结果。引物由赛百盛合成,PCR-mix购自天根公司,PCR扩增产物均由华大基因公司测序。测序结果用DNASTAR软件比对,并在网站http://blast.ncbi.nlm.nih.gov/Blast.cgi进行同源性比较。
1.6 多位点PCR扩增与电泳 选择在结核分枝杆菌复合体菌种中存在不同分布的7个位点〔4〕作为扩增的目的条带,PCR反应体系和反应条件同上,其中退火温度为60℃,扩增产物用1.5%琼脂糖凝胶电泳25min,EB染色,紫外灯下观察结果。
1.7 PCR-限制性内切酶酶切片段多态性分析(PCR-RFLP) PCR 引物为 hsp65F 和 hsp65R〔5〕反应体系和反应条件同上,其中退火温度为60℃。扩增产物用HaeIII和BstpI两种内切酶去酶切,体系为 HaeIII或 BstpI1μL,PCR 产物 15μL,10×H buffer或 10 ×B buffer 2μL,纯水 2μL。分别在37℃和60℃孵育2 h。酶切产物选用4%Metaphor agrose琼脂糖,100V 120min,EB染色,紫外灯下观察结果。根据条带泳动的位置和数量,确定不同分枝杆菌菌种类型。
2 结 果
2.1 oxyR-ahpC间隔区PCR扩增 结核杆菌标准株H37Rv的oxyR-ahpC间隔区片段PCR扩增产物大小为约700bp,而6株临床分离株中有2株(FJ07008,ZJ06019)的oxyR-ahpC基因间隔区PCR产物明显的长度大于1 000bp,与胞内分枝杆菌的扩增产物相同。见图1。

图1 oxyR-ahpC间隔区PCR扩增产物电泳结果Fig.1 PCR amplification of oxyR-ahpC intergenic-spacer region gene
2.2 测序分析 对oxyR-ahpC间隔区PCR产物测序,与公共数据库(GenBank database,http://www.ncbi.nlm.nih.gov/)作DNA序列同源性比较,本次是在片段大小相同的同个区域进行比较,FJ07008和ZJ06019与结核分枝杆菌H37Rv的该片段序列差异很大,同源性为84%;与胞内分枝杆菌的该片段相似性高,同源性为99%,见表1。

表1 在NCBI上blast比较oxyR-ahpC间隔区 DNA序列同源性Table 1 Blastn of test strains about oxyR-ahpC intergenic-spacer region on NCBI
2.3 多位点PCR扩增 根据文献报道的凝胶电泳图谱〔4〕,临床菌株FJ07003,XJ06186和结核分枝杆菌H37Rv 7个基因位点的电泳条带均为阳性,FJ07008和ZJ06019和鸟结核分枝杆菌、胞内分枝杆菌的第一个基因位点的电泳条带均为阳性,其余为阴性,故判断 FJ07008和ZJ06019两株临床菌株为非结核分枝杆菌,见图2。
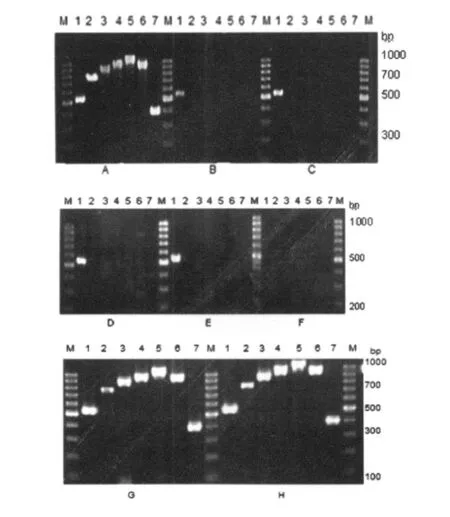
图2 多位点PCR扩增结果Fig.2 Multi-locus PCR amplification of seven genes
2.4 hsp65 PCR-RFLP 根据文献报道的凝胶电泳图谱〔6〕判断,FJ07008和ZJ060192株菌和胞内分枝杆菌菌株两种酶切后的电泳图条带一致,而FJ07003,XJ06186和结核杆菌H37Rv电泳图条带一致,故判断FJ07008和ZJ060192株菌为胞内分枝杆菌,见图3。

图3 BstpI和HaeIII两种内切酶酶切鉴定结果Fig.3 Identification of BstpI and HaeIII restrictive enzymes digestion
3 讨 论
目前分枝杆菌菌种的鉴定,传统的分类、鉴定系统主要以形态和生理生化特征的综合指标为依据,易受多种因素影响,鉴定结果极不可靠,存在着很大的异质性,鉴定一种菌种费时,约4周,还不包括培养所需时间 4-8周。因此有其局限性〔2〕。如PNB、TCH鉴别培养基进行菌种鉴定,虽然已被常规应用,但其为临床提供信息慢,而且鉴定出的菌种有一定局限性,只能区分至结核分枝杆菌,非结核分枝杆菌和牛分枝杆菌,不能进一步进行种的鉴定〔7〕。
目前,应用分子生物学技术鉴定分枝杆菌菌种不仅快速可靠,而且具有成本低廉,可建立标准化操作程序的优点,成为快速鉴定分枝杆菌的新方法〔2〕。同时本次实验采用软件比对并利用网络生物信息资源对PCR产物异常结果进行判断等基本生物信息学技术,不仅有助于我们更好的认识临床菌株,还为进一步实验提供了线索。生物信息学技术则是通过对生物学实验数据的获取、加工、存储、检索与分析,达到揭示数据所蕴含生物学意义之目的〔8〕。
NTM 广泛分布于自然界,在水、土壤、尘埃、人及动物体内普遍存在〔9〕。作为NTM 之一的鸟-胞内分枝杆菌复合菌群包括鸟分枝杆菌、胞内分枝杆菌两个种,28个血清型,仅从表型上难以进行区分。国内外的研究认为鸟-胞内分枝杆菌复合体主要是以机会感染的方式在儿童和免疫缺陷病人中发生〔9〕。由于AIDS的流行,鸟-胞内分枝杆菌复合体的感染也日趋引起人们的重视。在AIDS患者中,在无菌种鉴定结果的情况下,容易与结核病混淆,但是药物敏感性不同,许多非结核分枝杆菌耐药性更强,而化疗方案应根据不同菌种来制定〔10〕。因此能快速、准确鉴定出分枝杆菌类型,不仅对临床诊断和治疗,而且在流行病学上均有重要意义。
我们在进行结核分枝杆菌临床分离株的oxyR-ahpC间隔耐药区的PCR检测的过程中,发现用PNB、TCH鉴别培养基鉴定为结核分枝杆菌的两株分枝杆菌临床分离株的PCR扩增产物的分子量明显大于结核分枝杆菌,而与胞内分枝杆菌相同,通过联合应用多种分子生物学技术和生物信息学技术对这两株菌株进行定种鉴定,最终确定为胞内分枝杆菌。并为探索新菌种鉴定的特异位点和菌种鉴定技术体系提供初步基础。
本研究中选用的hsp65基因广泛地存在于分枝杆菌中,该基因核苷酸序列的多态性总体上大于16S rRNA基因的多态性,其核苷酸位点的变化具有种的特异性,适合用于对分枝杆菌菌种类型进行区分〔10〕。用 PCR-RFLP方法分析 hsp65基因,能够将分枝杆菌鉴定到种的水平,尤其是可以将鸟-胞内分枝杆菌复合体内菌种鉴别〔5〕。临床菌株的菌种鉴定往往要求快速、敏感、准确、简便,以PCR为基础的分子生物学菌种鉴定技术即具有此特点。但是正是由于分子生物学方法敏感度高,极易因造成实验室交叉污染而出现假阳性结果,因此需要严格控制实验条件〔10〕。
〔1〕Donnabella V,Salazas SJ,Bonk S,et al.Increasing incidence of Mycobacterium xenopi at Bellevue hospital:an emerging pathogen or a product of improved laboratory methods〔J〕.Chest,2000,118(5);1365-1370.
〔2〕靳晓红,刘元东,庄玉辉,等.分枝杆菌菌种的基因快速鉴定技术〔J〕.国外医学临床生物化学与检验学分册,2002,23(2):89-90.
〔3〕Embden JD,Cave MD,Crawford JT,et al.Strain identification of Mycobacterium tuberculosis by DNA fingerprinting:Recommendations for a standardized methodology〔J〕.Clin Microbiol,1993,31(8):446-2450.
〔4〕Huard RC,Lazzarini LC,Butler WR,et al.PCR-Based Method to Differentiate the Subspecies of the Mycobacterium tuberculosis complex on the basis of genomic deletions〔J〕.Journal of Clinical Microbiology,2003,41(4):1637-1650.
〔5〕Brunello F,Lig ozzi M,Christelli E,et al..Dentification of 54 Mycobacterium species by PCR-restriction fragment length polymorphism analysis of the hsp65 gene〔J〕.Clin Microbiol,2001,39:2799-2806.
〔6〕Chimara E,Ferrazoli L,Ueky SY,et al.Reliable identification of mycobacterialspecies by PCR-restriction enzyme analysis(PRA)-hsp65 in a reference laboratory and elaboration of a sequence-based extended algorithm of PRA-hsp65 patterns〔J〕.BMC Microbiology,2008:(8);48.
〔7〕刘金伟,匡铁吉,王全河,等.分枝杆菌鉴定方法的比较研究〔J〕.中华结核和呼吸杂志,2000,22(10):631.
〔8〕Lesk AM.Introduction to Bioinformatics〔M〕.New York:Oxford University Press,2002:1-61.
〔9〕Koh W,Kwon OJ,Lee KS.Nontuberculous Mycobacterial pulmonary diseases in immunocompetent patients〔J〕.Korean Journal of Radiology,2002,3(3):145-157.
〔10〕Katoch V M.Infections due to non-tuberculous mycobacteria〔J〕.Indian J M ed Res,2004,120:290-304.

