单纯性肥胖人群血清骨桥蛋白水平升高的意义
刘晓英 汪永义
1 中南大学公共卫生学院(410008)
2 上海交通大学医学院附属仁济医院(200127)
由于现代生活方式和饮食习惯的改变,肥胖对人们的健康造成了越来越大的威胁。在一些发达城市,肥胖发生率尤高。如在上海,肥胖发生率在男性中已高达31.7%,女性高达36.4%,并有继续上升的趋势。目前,肥胖被认为是冠状动脉粥样硬化性心脏病、恶性肿瘤的独立危险因素[1,2]。
较早的研究发现,骨桥蛋白(osteopontin,OPN)在炎症过程中起着重要的调节作用。OPN曾经被称为早期T细胞活化基因。OPN通过诱导免疫细胞转移和浸润到炎症部位来支持机体免疫,其主要靶细胞是巨噬细胞。OPN可以提高巨噬细胞干扰素γ和白细胞介素12的分泌,并抑制白细胞介素10的分泌。因此,OPN也被认为是一个炎症相关细胞因子[3]。
事实上,肥胖已经被认为是一种程度较轻的慢性炎症。最近发现,肥胖人群的脂肪组织里有较高的OPN表达,且有较多的巨噬细胞浸润,OPN的存在是巨噬细胞浸润的基础[4]。此外,OPN与血管粥样硬化及肿瘤发生、发展密切相关,而肥胖又是冠状动脉粥样硬化性心脏病及恶性肿瘤的独立危险因素。因此,我们检测肥胖人群血清OPN水平,分析其改变的意义。
1 材料与方法
1.1 临床资料
根据单纯性肥胖定义,对于其他疾病或医疗的原因而引起的肥胖患者,剔除在选择之外。同时,为了避免影响血清OPN水平,剔除了有高血压、糖尿病、恶性肿瘤、骨代谢性疾病、免疫系统疾病、肝炎、肾脏疾病等病史患者[5]。根据以上严格入选标准,选取了来院体检人群1386例,35~45岁,并根据体质量指数(BMI,即体质量kg/身高m2)将人群分成两组:BMI>30为单纯性肥胖人群,BMI<30为非肥胖组人群。两组人群的详细临床资料详见表1。
1.2 血清OPN水平检测
分别取入选个体的静脉血,分离血清,用OPN检测试剂盒(Endogen,Cambridge,MA),应用ELISA法检测血清OPN水平。
1.3 统计学分析
所有数据都采用SPSS 11.5进行统计分析。两组之间的计量资料比较采用t检验,计数资料比较采用χ2检验;应用直线回归分析血清OPN水平和BMI之间的关系;P<0.05被认为差别具有统计学意义。
2 结 果
2.1 单纯性肥胖组较非肥胖组血清OPN水平明显增高
统计分析表明,单纯性肥胖组血清OPN水平为(77.5±20.6)ng/mL,对照组为(41.3±13.8) ng/mL,P<0.01。
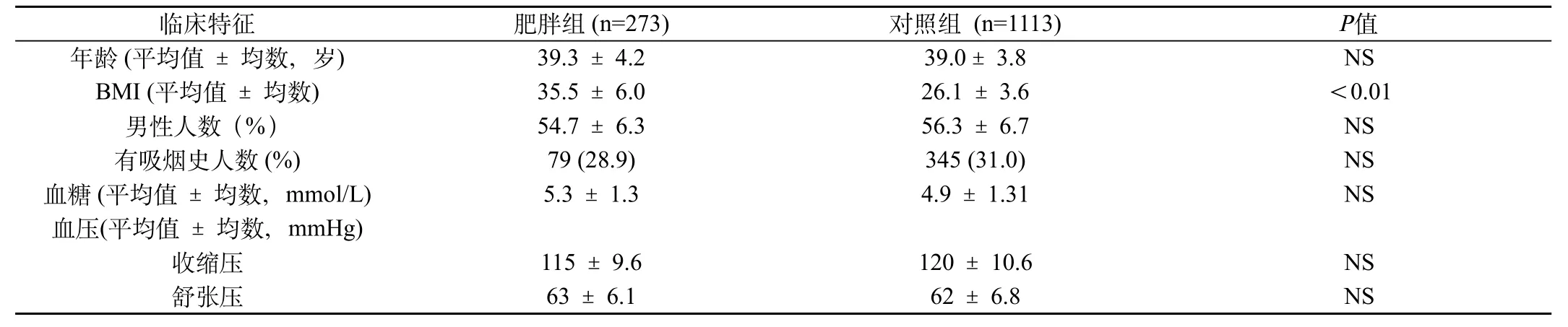
表1 两组人群的临床特征
2.2 血清OPN水平和BMI之间的相关性分析
应用直线回归分析血清OPN和BMI之间的相关性,结果建立回归方程:Y = 0.5687X + 3.156,R2= 0.7452,P<0.01。表明血清OPN水平和BMI之间显著正相关。
3 讨 论
我们发现,单纯性肥胖人群的血清OPN水平较非肥胖组人群明显升高,而且,OPN水平与体质量指数正相关,提示血清OPN水平与体内脂肪组织含量相关。OPN具有多种重要的生物学功能,其最主要的生物学功能是调节炎性反应和介导肿瘤发生转移。肥胖是心血管疾病和恶性肿瘤的独立危险因素,我们认为,血清OPN水平升高在其中起到了重要作用。
心血管系统的粥样硬化同样已经被认为是一种慢性炎症性疾病,高水平的OPN mRNA和OPN蛋白在人主动脉、颈动脉、冠状动脉的粥样斑块里被发现[6]。有研究者用致粥样硬化饮食喂养OPN转基因小鼠、野生型小鼠、OPN基因剔除小鼠,OPN转基因小鼠较野生型小鼠明显发生粥样硬化;相对地,OPN基因剔除小鼠较野生型小鼠很少发生粥样硬化,提示OPN在粥样硬化的发生中起到了重要作用[7]。血清高水平的OPN不仅能促进血管平滑肌细胞的增殖和迁移,而且能促进炎性细胞的聚集[8],这些都是粥样硬化发生的病理生理基础。
肿瘤细胞主要起源于组织中低分化或者未分化的干细胞,是组织增生过程汇中干细胞异常分化的结果。肿瘤细胞与同源干细胞之间具有类似的细胞行为和生长调控机制,其发生和发展过程都需要OPN的参与。体外研究发现,外源性OPN能够通过整合素受体促进肿瘤细胞的黏附和迁移,并产生凋亡信号,促进肿瘤细胞的生存和生长,缺乏OPN则细胞凋亡数量明显增加[9]。又如在神经母细胞瘤生长期间,大量表达的OPN能有效地促进血管内皮细胞的长入,加速肿瘤组织中血管床的形成,从而为肿瘤的生长提供必要的物质基础[10]。OPN在肿瘤的转移中也起着重要的作用。小鼠结肠腺癌细胞株CT26的OPN经RNA干扰后,该细胞株的体内外转移特性明显受抑,而加入外源性OPN后,转移特性明显增强[11]。类似情况也同样见于胃癌细胞[12]。
我们的研究表明,血清OPN水平在单纯性肥胖人群中明显升高,为心血管疾病和恶性肿瘤的发生发展提供了温床,针对血清OPN进行早期干预,将减少肥胖人群心血管及肿瘤相关疾病的发病率。
[1] Van Gaal LF,Mertens IL,et al. Mechanisms linking obesity with cardiovascular disease[J]. Nature,2006,444(712):875-880.
[2] Adami HO,Trichopoulos D. Obesity and mortality from cancer[J].N Engl J Med,2003,348(17): 1623-1624.
[3] Ashkar S,Weber GF,Panoutsakopoulou V,et al. Eta-1 (osteopontin):an early component of type-1 (cell-mediated) immunity[J].Science,2000,287(5454): 860-864.
[4] Nomiyama T,Perez-Tilve D,Ogawa D,et al. Osteopontin mediates obesity induced adipose tissue macrophage infiltration and insulin resistance in mice[J]. J Clin Invest,2007,117(10): 2877-2888.
[5] Xu G,Nie H,Li N,et al. Role of osteopontin in amplification and perpetuation of rheumatoid synovitis[J]. J Clin Invest,2005,115(4):1060-1067.
[6] Kurata M,Okura T,Watanabe S,et al. Osteopontin and carotid atherosclerosis in patients with essential hypertension[J]. Clin Sci(Lond),2006,111(5): 319-324.
[7] Chiba S,Okamoto H,Kon S,et al. Development of atherosclerosis in osteopontin transgenic mice[J]. Heart Vesseles,2002,16(3): 111-117.
[8] Chaulet H,Desgranges C,Renault MA,et al. Extracellular nucleotides induce arterial smooth muscle cell migration via osteopontin[J].Circ Res,2001,89(9): 772-778.
[9] Geissinger E,Weisser C,Ficher P,et al. Aurocrine stimulation by osteopontin contributes antiapoptocic signal of melanocytes in dermal collagen[J]. Cancer Res,2002,62(16): 4820-4828.
[10] Hiramaa M,Takahashi F,Takahashia K,et al. Osteopontin overproduced by tumor cells acts as a potent angiogenenic factor contributing to tumor growth[J]. Cancer Latt,2003,198(1): 107-117.
[11] Wai PY,Mi Z,Guo H,et al. Osteopontin silencing by small interfering RNA suppresses in vitro and in vivo CT26 murine colon adenocarcinoma metastasis[J]. Carcinogenesis,2005, 26(4):741-751.
[12] Tang H,Wang J,Bai F,et al. Inhibition of osteopontin would suppress angiogenesis in gastric cancer[J]. Biochem Cell Biol,2007,85(1):103-110.

