超滤提取黄芪多糖的工艺研究
黄芪(Radixastragali)为豆科植物蒙古黄芪或膜荚黄芪的干燥根,补中益气,含有多糖、甙类、氨基酸、黄酮和微量元素等多种化学成分[1]。近年来经研究及临床验证,分子量小于80 000的黄芪多糖可制成静脉注射液,用于化疗后的滋补,以提高人体的免疫力[2],也可以对其改性而增强其活性,具有很好的抗艾滋病和抗凝血作用[3,4];分子量大于80 000的黄芪多糖则可制成营养口服液。
按不同分子量分离提取黄芪多糖是黄芪综合利用的重要途径,其中能否分离出均一的多糖非常重要。鉴于超滤技术[5]具有设备简单、操作方便、节省能源、不产生二次污染等优点,作者在此采用超滤技术对黄芪多糖进行分离纯化,考察了操作压力、运行温度、流速、初始料液浓度等工艺参数对超滤提取的影响,拟为黄芪多糖在医药领域和保健品行业的工业化开发提供参考。
1 实验
1.1 原料、试剂与仪器
黄芪多糖,甘肃效灵生物开发有限责任公司。
葡萄糖、乙醇、苯酚、硫酸,均为分析纯。
UV-2401PC型紫外分光光度计,上海精密科学仪器有限公司分析仪器总厂;HH-601型恒温水浴锅,金坛恒丰仪器厂;DDS-307型电导率仪;Hanna浊度分析仪;高速管式离心机;平板式超滤膜设备:膜面积1 m2,截留分子量(或孔径)0.2 μm、0.1 μm、20万、10万、5万、2万、1万、0.5万,厦门世达膜科技有限公司。
1.2 装置(图1)
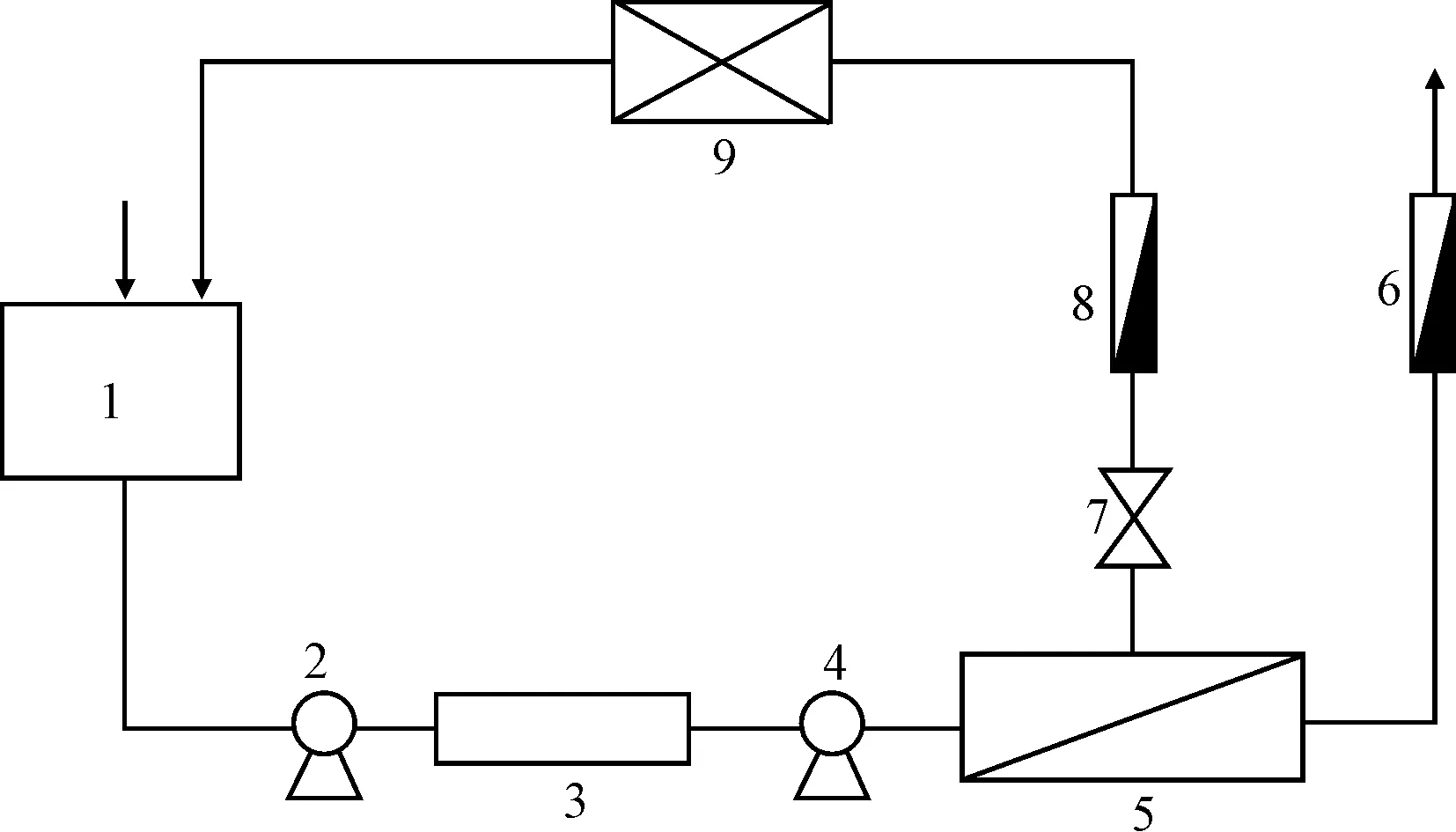
1.料液箱 2.低压泵 3.保安过滤器 4.高压泵 5.膜组件 6.透过液流量计 7.调压阀 8.浓缩液流量计 9.换热器
黄芪多糖水提液由料液箱流入低压泵,通过保安过滤器后,由高压泵输入到膜组件中,经膜组件分离后,透过液通过膜组件上的透过液出口经透过液流量计流出待用;浓缩液经膜组件浓缩液出口经过调压阀、浓缩液流量计和换热器后循环至料液箱。根据不同的实验目的,选择循环或浓缩过程。用调节阀调节压力。
1.3 方法
1.3.1 标准曲线的绘制
精密称取105℃干燥至恒重的无水葡萄糖14 mg,置100 mL量瓶中,加适量水溶解,稀释至刻度,摇匀,即得0.14 mg·mL-1对照品溶液。分别精密量取对照品溶液0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL置具塞试管中,加水至2 mL;再精密加入5%苯酚溶液1 mL,摇匀;迅速精密加入硫酸6 mL,摇匀,置40℃水浴10 min,取出;置冰水浴5 min,取出。以相应的试剂为空白,在490 nm波长处测定吸光度。以吸光度为纵坐标、浓度为横坐标,绘制标准曲线。
拟合葡萄糖标准曲线得到线性回归方程y=61.29x+0.0015,相关系数为0.9981。式中:y为吸光度;x为葡萄糖浓度(mg·mL-1)。
1.3.2 样品测试
精密吸取待测样品2 mL,按1.3.1方法测定吸光度,根据回归方程计算多糖含量。
1.3.3 分析方法


式中:ci为膜组件进料中多糖浓度;cp为透过液中多糖浓度。


电导率采用DDS-307型电导率仪测定,浊度采用Hanna浊度分析仪测定。
2 结果与讨论
2.1 预处理
为了降低超滤对膜的污染、保证超滤膜的分离特性和通量、克服浓差极化,浸提液必须在超滤前进行预处理,除去不溶性固形物。以固形物去除率及多糖损失为指标对离心(3000 r·min-1)5 min、0.8 μm微滤以及5 μm精密过滤3种预处理方法进行比较,结果见表1。
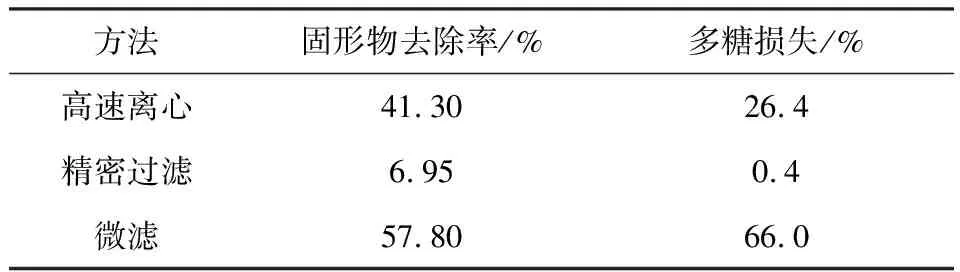
表1 3种预处理方法比较
由表1可见,3种预处理方法均可有效地去除粗多糖溶液中的杂质。微滤预处理时,多糖损失高达66.0%,这可能是一些大分子量(大于200万)[6,7]的黄芪多糖被微滤膜截留的缘故;5 μm精密过滤多糖损失最小,但不溶性固形物去除率稍差;高速离心对不溶性固形物有较高的去除率,多糖损失也较少。
预处理方式的选择与后续超滤膜的选择密不可分,若要最大限度保留所有多糖,则选择精密过滤进行预处理,同时,超滤选择板式或管式;若要收集所要求的截留分子量的部分多糖,则选择高速离心进行预处理,同时,超滤选择卷式或中空纤维。预处理方式的选择较为灵活,应根据料液性质、富集多糖的范围来定。
2.2 黄芪多糖分子量的分布
在35℃、0.3 MPa条件下选用截留分子量分别为400 kDa、200 kDa、10 kDa的滤膜对黄芪提取液依次进行超滤,将多糖提取液分为4段,测定每段的多糖含量,结果见图2。
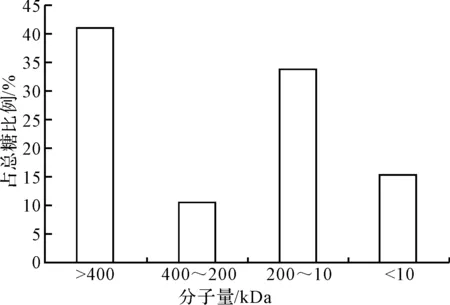
图2 黄芪多糖的分子量分布
由图2可知,超滤后分子量>400 kDa的黄芪多糖约占总糖的40.6%,分子量在400~200 kDa之间的黄芪多糖占10.1%,分子量在200~10 kDa之间的黄芪多糖占33.5%,分子量<10 kDa的寡糖和单糖约占15.2%。
多糖的药理活性与其初级结构、高级结构、分子量、溶解度、粘度有着密切的关系,多糖分子的多级结构又与其分子量有着直接的关系,一般分子量为100~200 kDa的高分子多糖呈现较强的活性[8~10],分子量为10~100 kDa的黄芪多糖具有免疫调节作用[11~13]。因此,选择分子量为10~200 kDa的黄芪多糖作为活性黄芪多糖制品进行后续实验。
2.3 超滤工艺的优化[14]
2.3.1 温度对超滤的影响
唐亮(化名)自认为是网络游戏高手,但是自从在虚拟世界中遭遇另外一位游戏玩家“古世龙”后,就遭遇到了游戏的“滑铁卢”。“古世龙”在网络中杀死了唐亮的朋友,抢了唐亮在游戏中的老婆,两人在游戏中多次厮杀,唐亮总是失败。终于,在网络游戏中被杀死23次之后,分不清虚拟世界和真实世界的唐亮,决定采取一种特殊的报复方式,一场网络游戏引起的血案就此发生。他叫上几个平时一起玩网络游戏的兄弟,找到现实当中的“古世龙”,教训了他一顿。一场虚拟世界里的厮杀终于演变成了一场现实当中的厮杀,二者最大的区别就是,在真实的世界里,人的生命只有一次。
在0.3 MPa压力下,用截留分子量为10 kDa的滤膜对黄芪提取液进行超滤,温度对膜通量的影响如图3所示。
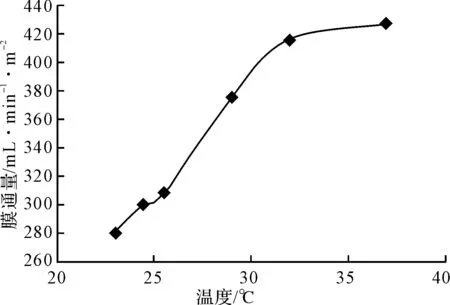
图3 温度对膜通量的影响
由图3可知,随着温度的升高,膜通量增大。这是因为在一定范围内,升高温度使溶液粘度下降、扩散系数和传质系数增大、多糖溶解度增大,溶质与水的亲合力相应增大,浓差极化相应减小,导致膜通量增大;但温度过高会导致滤膜性能和溶液理化性质的改变。综合考虑,选择超滤温度为30℃。
2.3.2 压力对超滤的影响
在 30℃对黄芪多糖提取液进行超滤,压力对膜通量的影响如图4所示。
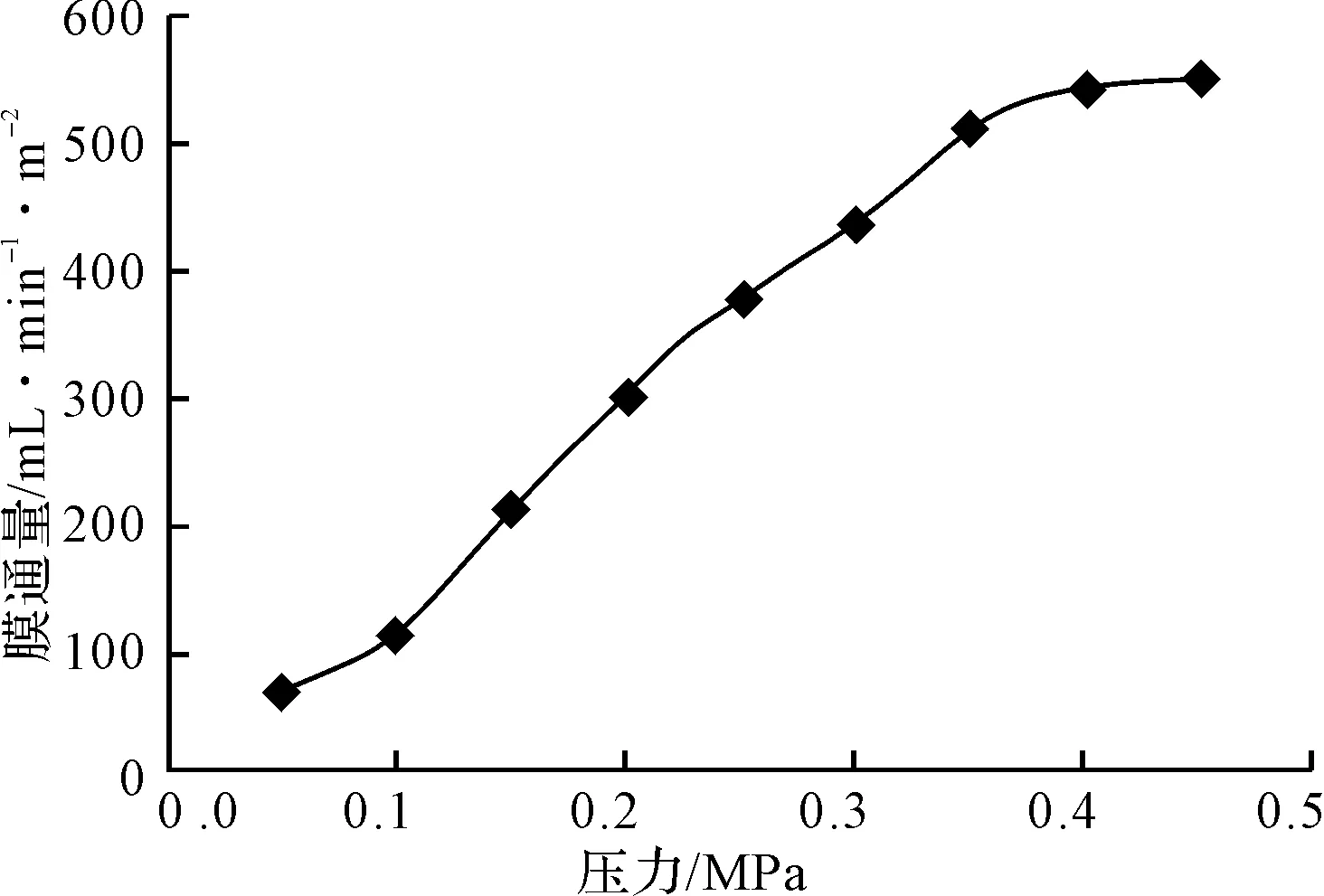
图4 压力对膜通量的影响
由图4可知,随着压力的增大,膜通量显著增大。这是因为压力差较小时,压力的增大使溶液通过滤膜的推动力增大,故膜通量明显增大。当压力达到 0.35 MPa 后,膜通量趋于恒定;如再增加压力,膜通量增加使得膜面上被截留溶质的浓度增大,浓差极化作用加剧,开始形成较厚的膜面凝胶层,导致阻力大大增加,因而膜通量增加较少。综合考虑,选择超滤压力为0.35 MPa。
2.3.3 流速对超滤的影响
在30℃、0.35 MPa条件下对黄芪多糖提取液进行超滤,进料流速对膜通量的影响见图5。
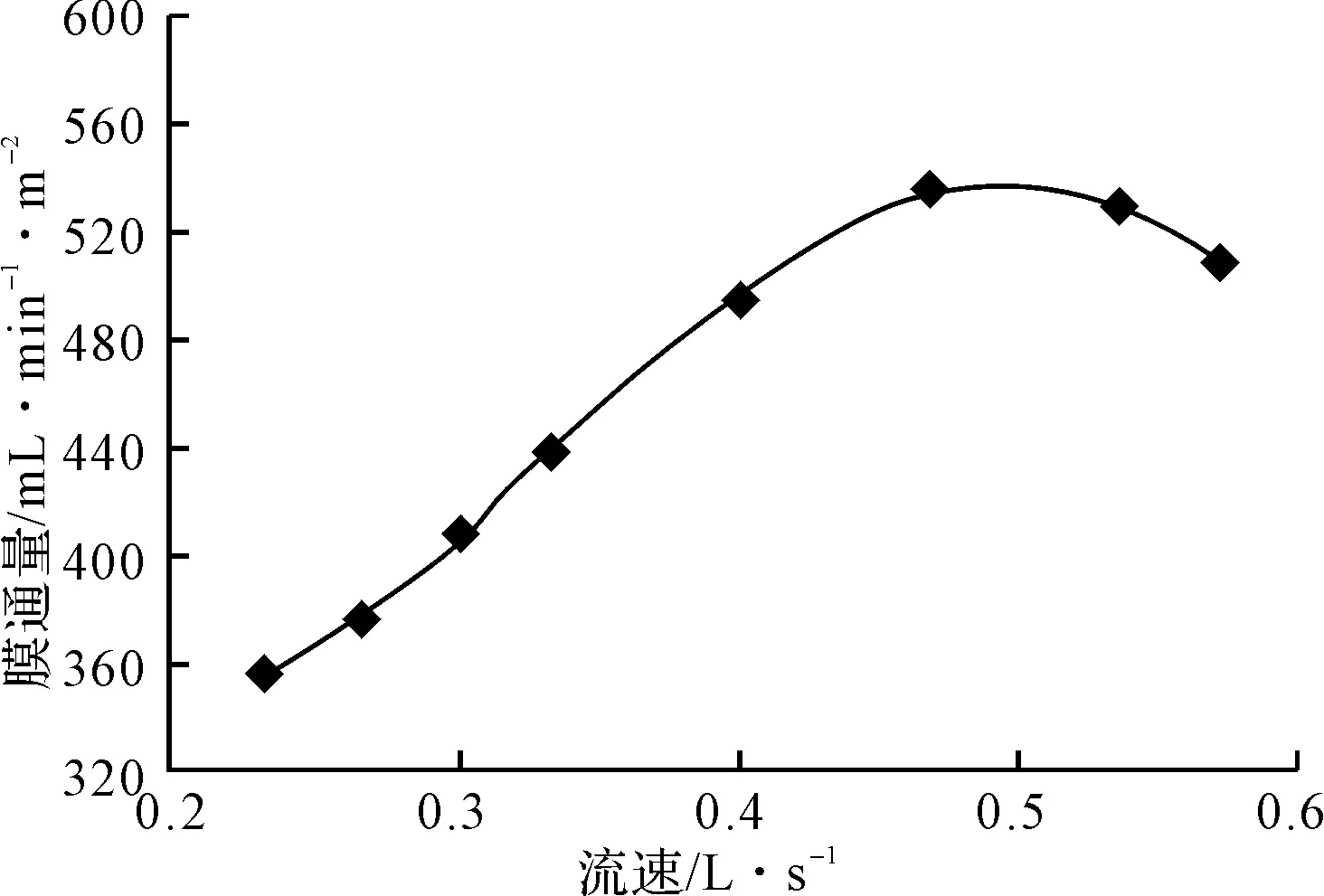
图5 流速对膜通量的影响
由图5可知,随着流速的不断加快,膜通量呈上升趋势。这是因为加快流速阻碍了浓差极化的积累和形成,并且对膜面的沉积物也具有冲刷作用,从而减缓了膜面的污染。当流速超过0.467 L·s-1时,膜通量反而下降。这是因为流速加快并不能从根本上消除膜污染,过快的膜表面流速反而增大了压力损失,作用在膜表面的有效压力减小,膜通量也随之减小。因此,选择进料流速为0.467 L·s-1。
2.3.4 初始料液浓度对超滤的影响
在30℃、0.35 MPa、0.467 L·s-1条件下,对黄芪多糖提取液进行超滤,初始料液浓度对膜通量的影响见图6。
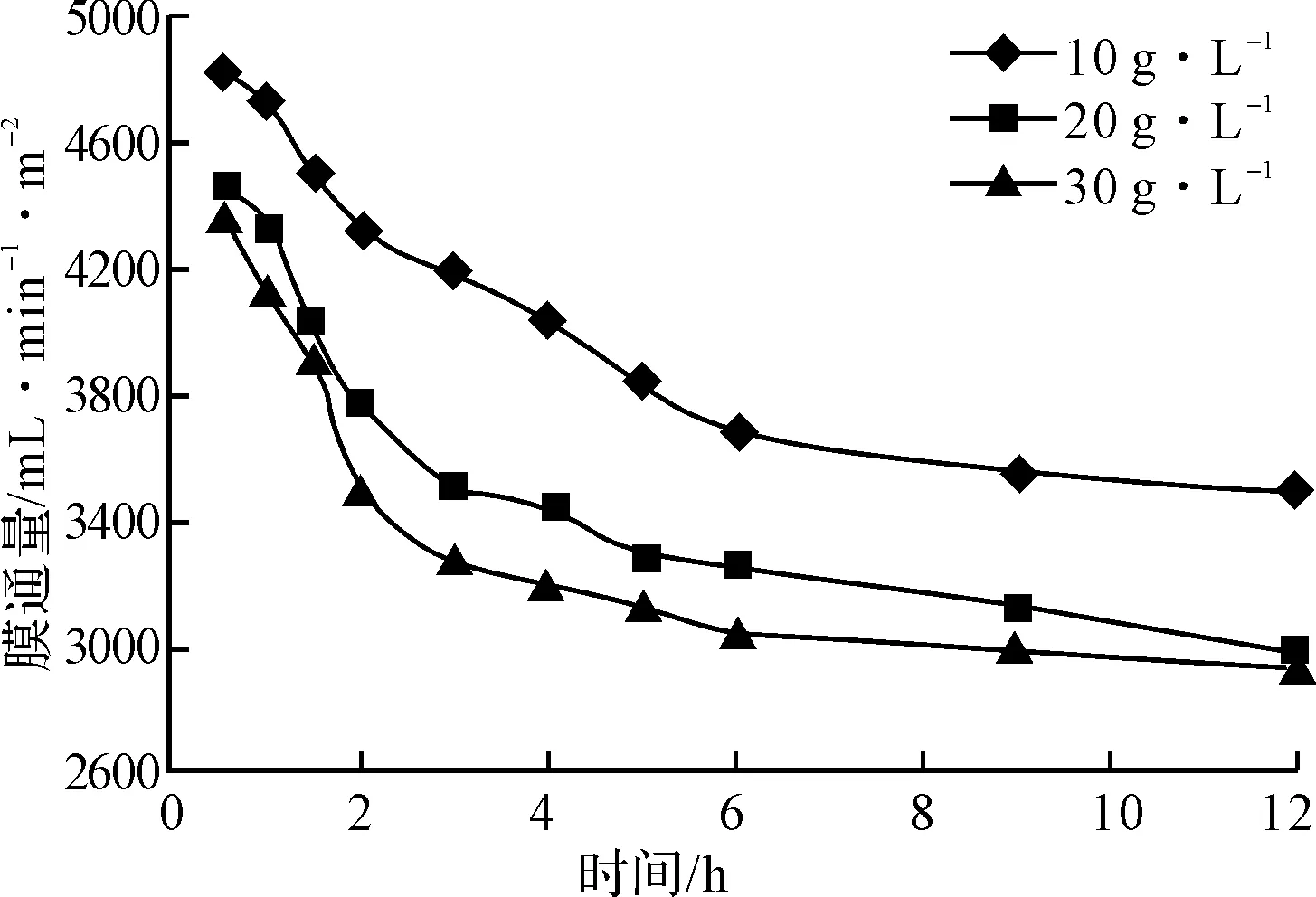
图6 初始料液浓度对膜通量的影响
由图6可知,膜通量随着初始料液浓度的增大而减小。这是因为,一方面随着初始料液浓度的增大,料液粘度增大,溶质扩散系数减小,由膜边界向料液主体的反向扩散通量减小,浓差极化严重;另一方面初始料液浓度增大,溶质沉积在膜表面,阻塞膜孔,增加扩散阻力,造成通量下降。由于初始料液浓度太低会增加浓缩的费用,综合考虑,选择初始料液浓度为20 g·L-1。
2.4 黄芪多糖超滤产物
黄芪粗多糖水溶液采用5 μm精密过滤进行预处理,处理液在初始料液浓度为20 g·L-1、温度为30℃、压力为0.35 MPa及进料流速为0.467 L·s-1的条件下,用截留分子量为200 kDa和10 kDa的滤膜依次对料液进行超滤,取分子量为100~200 kDa之间的浓缩液,进行超滤得到活性黄芪多糖制品。制品中多糖含量由原来的36.0%提高到86.8%,说明超滤是一种很有效的多糖纯化方法。
2.5 超滤膜的清洗
在35℃、0.3 MPa下分别采用去离子水、氢氧化钠溶液对污染后的超滤膜(以10 kDa为例)进行清洗,结果见表2。

表2 超滤膜的清洗效果对比
由表2可知,超滤膜经去离子水清洗后,膜通量恢复较差,只有31.5%;采用氢氧化钠溶液清洗后,膜通量恢复率达到84.7%。
3 结论
采用截留分子量为200 kDa和10 kDa的超滤膜对黄芪多糖进行提取分离,在初始料液浓度为20 g·L-1、压力为0.35 MPa、温度为35℃、进料流速为0.467 L·s-1的最佳条件下,多糖含量由36.0%提高到86.8%。有效实现了黄芪多糖提取液中活性多糖与大分子蛋白、多酚等物质的分离。
参考文献:
[1] 国家药典委员会.中国药典一部(2005版)[M].北京:化学工业出版社,2005:212-213.
[2] 杨金兰,武正簧.应用150-CALC/ GPC 色谱仪测试黄芪多糖的分子量及其分布[J].太原工业大学学报,1994,25(4):77-84.
[3] Soedjak H S.Colorimetric determination of carrageenans and other anionic hydrocolloids with methylene blue[J].Anal Chem,1994,66(24):4514-4518.
[4] 邓岗,耿美玉,辛现良,等.古糖酯的分光光度法测定[J].青岛海洋大学学报,1999,29(1):57-59.
[5] 郭敏亮,姜涌明.考马斯亮蓝显色液组分对蛋白质测定的影响[J].生物化学与生物物理进展,1996,23(6):558-561.
[6] 林颖,吴毓敏,吴雯,等.天然产物中糖含量测定方法正确性的研究[J].天然产物研究与开发,1996,8(3):5-8.
[7] 闫巧娟,韩鲁佳,江正强,等.黄芪多糖的分子量分布[J].食品科学,2004,25(8):27-30.
[8] Sakagami H,Aoki T,Simpson A,et al.Induction of immunopotentiation activity by a protein-bound polysaccharide,PSK(review)[J].Anticancer Research,1991,11(2):993-999.
[9] Misaki A,Kishida E,Kakuta M,et al.Carbohydrate and Carbohydrate Polymers[M].ATL Press.Mount Prospect,Illinois USA,1993:116-129.
[10] Ooi V E,Liu F.Immunomodulation and anti-cancer activity of polysaccharide-protein complexes[J].Current Medicinal Chemistry,2000,7(7):715-729.
[11] 方圣鼎,陈燕,徐小异,等.中药黄芪有效成分的研究(Ⅰ)多糖体的分离、性质及其生理活性[J].有机化学,1982,(1):26-31.
[12] 王莹,赵毅民,张起凤,等.黄芪中一种新葡聚糖的分离纯化与化学结构研究[J].中草药,2001,32(11):962-964.
[13] 姜东.黄芪多糖的提取、分离、纯化及其生物学活性研究[D].杭州:浙江大学,2006.
[14] 张玉忠,郑领英,高从堦.液体分离膜技术及应用[M].北京:化学工业出版社,2004:86-90.

