前列腺癌的MRI诊断:T2WI、DWI、MRS及其综合应用
李春媚,陈 敏*,李飒英,王文超,赵伟峰,杨正汉,刘 明,周 诚
前列腺癌(prostate cancer,PCa)是男性泌尿生殖系统最常见的恶性肿瘤之一,其发病率在欧美国家恶性肿瘤中居首位,死亡率仅次于肺癌[1]。在亚洲国家,随着人口增长、人均寿命延长和生活习惯改变以及该病检出手段日益进步,其发病率及死亡率逐年上升[2]。
前列腺癌的临床诊断主要包括:早期诊断及定位、分期诊断及对侵袭性的预测。其中,肿瘤的体积(大小)、TNM分期、Gleason评分是前列腺癌预后的主要评价指标。目前前列腺癌术前的主要诊断方法有:①前列腺特异抗原(prostate specif i c antigen,PSA)检测;②直肠指检(digital rectal examination,DRE);③直肠内超声(transrectal ultrasonography,TRUS);④磁共振检查(magnetic resonance imaging,MRI);⑤活体组织检查(biopsy)。其中,超声引导下经直肠穿刺活检被视为前列腺癌术前诊断金标准。依靠PSA、DRE及TRUS可进行前列腺癌初筛,但这些诊断方法的特异性有待提高,并且对肿瘤分期的评估有较大局限性。MRI以其在三维空间及软组织对比分辨率高以及多序列多参数成像的优势被认可为前列腺癌最佳影像学诊断技术之一。近年来,T2WI被广泛用于常规前列腺MRI形态学检查,但其对肿瘤定性及定位诊断的敏感性和特异性仍有待提高。在MR功能成像方面,动态增强扫描(dynamic contrast-enhanced MRI,DCE-MRI)、扩散成像(diffusion-weighted imaging,DWI)及表观扩散系数(apparent diffusion coeff i cient,ADC)图和MR波谱成像等技术有了较大发展,进一步提高了前列腺癌MR诊断的准确性。
本研究着重于探讨T2WI、DWI及MRS三种方法独立及三者结合对前列腺癌的诊断价值。
1 材料与方法
1.1 病例资料
本研究收入2006年2月至2007年3月期间在本院行前列腺MRI检查并经穿刺活检确诊的42例患者。42例患者年龄45~82岁,平均63.28±7.40岁。35例因不同程度的排尿困难、尿频、尿潴留等症状就诊;6例无症状体检时发现PSA升高,PSA值5.3~147 ng/ml;1例为前列腺结节复查。所有患者均经DRE和(或)血清PSA检查异常(非癌患者PSA范围4.7~38.00 ng/ml,平均11.93 ng/ml;前列腺癌患者PSA范围7.4~147 ng/ml,平均52.47 ng/ml)。
所有患者活检时间与MR检查间隔不超过3个月,检查前均未经过内分泌、放疗等非手术治疗。
1.2 MRI检查
采用Siemens Magnetom Espree 1.5 T高场超导MR成像仪,使用体部矩阵线圈发射结合脊柱矩阵线圈接受信号。
常规MRI:前列腺局部行薄层轴、矢和冠状位FSE-T2WI扫描,扫描参数:TR 3500 ms,TE 85 ms,ETL 19,层厚5 mm,层距0.5 mm,FOV 24 cm,NEX 4,矩阵320×256;FSE-T1WI薄层扫描,扫描参数:TR 450 ms,TE 12 ms,层厚5 mm,层距0.5 mm,FOV 24 cm,NEX 2,矩阵256×192。
DWI:采用轴位扫描,扫描参数:TR 2900 ms,TE 84 ms,ETL 128,NEX 3,矩阵230×256,层厚3 mm,层距0.6 mm,FOV 23 cm,扫描时间共1.08 min;扩散敏感系数(b)值分别为0、1000 s/mm2。MR扫描仪自动生成ADC图。
MRS:进行MRS扫描前先进行前列腺 T2WI抑脂轴位横断面、矢状面和冠状面3个方位的定位扫描,然后在上述3个方位的定位像上进行MRS扫描定位,扫描范围应包括整个前列腺,扫描区周边共添加8条饱和带,饱和带尽量靠近前列腺,以便最大可能抑制前列腺周围的脂肪信号[3]。MRS扫描开始前首先进行自动或手动匀场(自动匀场效果不好时,改为手动匀场)。扫描完毕后,在工作站MRS分析软件对扫描数据进行自动后处理,并以软件自带的测量和计算公式分别测量前列腺代谢产物胆碱(Cho)、肌酸(Cre)和枸椽酸盐(Cit)的波峰谱线以及(Cho+Cre)/Cit(CC/C)比值。可用体素的标准是:75%以上位于兴趣区,没有受到未能抑制的水和脂肪信号的污染,主要代谢物波谱的信噪比大于5。
1.3 数据评估
由两名不了解临床资料、诊断经验不同(前列腺影像诊断经验分别为1年和10年)的放射学医师各自对MRI进行回顾性盲法阅片诊断,所有病例依据前列腺6分区法诊断,按5分制评分。当单独评分结果出现不一致时,由两人协商取得一致结果后,将该结果作为最终评分。
前列腺6分区方法:轴位MRI图像上将前列腺分为左、右两侧,每侧由上到下平均分为底部、中部和尖部3部分,共6分区。根据手术病理或穿刺活检的结果,将病变归入相应的分区。
5分制评分:1.肯定不是癌;2.可能不是癌;3.不确定;4.可能是癌;5.肯定是癌。
1.4 诊断标准
T2WI诊断:诊断标准设定如下[4]:①在T2WI上,在高信号的前列腺外周带内出现低信号灶,前列腺带状结构破坏并(或)病变处包膜中断并(或)外周带与中央腺体界线消失应考虑前列腺癌,评分为5;②T2WI上,中央腺体内出现边缘欠清晰规则的低信号影,并内部及周围正常腺体结构消失,考虑为中央腺体内恶性病变,评分为5;③T2WI上,在高信号的前列腺外周带内出现低信号灶,边界欠清晰规则,并周围腺体腺管结构分布欠清晰,但不伴前列腺带状结构破坏、病变处包膜中断及外周带与中央腺体界线消失,评分为4;④T2WI上,中央腺体内出现边缘欠清晰规则的低信号影,周围腺体结构欠规则,评分为4;⑤T2WI上,外周带或中央腺体可见低信号,但难以鉴别良恶性,评分为3;⑥T2WI上,均匀高信号的外周带内出现边缘较清晰规则的低信号灶或外周带信号弥漫性减低,并周围腺体腺管结构分布清晰正常,考虑为前列腺良性病变,评分为2;⑦T2WI上,外周带呈均匀高信号表现,腺体带状结构分布清晰自然,外周带和中央腺体间分界清楚,两者间存在带状结构,考虑为正常前列腺组织,评分为1。
DWI诊断:在MR工作站上对所得ADC图进行ADC值测量并记录。采用前列腺6分区法分别测量各区ADC值。正常腺体测量时每区域采用同样大小的感兴趣区(3 mm×3 mm )不少于2个,平均3个,最后取其平均值。病变区域测量时,于病灶最明显层面进行测量。将所得各区域数据按数值从小到大排序,将所得数据以5分位点分组并将数据归入各组,以5分制依次评分为5~1分。
MRS诊断:在MR工作站上对所得MRS图进行CC/C比值测量并记录。采用前列腺6分区法分别测量各区数值。正常腺体测量时每区域采用同样大小的感兴趣区不少于2个,后取其平均值。病变区域测量时,于病灶最明显层面进行测量。将所得各区域数据按数值大小排序,以王霄英等人[5]研究所得国人正常前列腺组织CC/C统计数据(0.42±0.19)为标准,以为界值,分别评分为1~5分。
三者综合诊断:对每例患者结合T2WI、DWI及MRS三者独立诊断分值求平均取整作为三种方法综合诊断分值。对每组数据采用以下校正方法:每组数据中,三种方法独立所得的分值任一出现5分者,即对综合诊断分值加1分;任一出现1分者,即对综合诊断分值减1分。
1.5 前列腺穿刺
超声引导下穿刺活检:根据前列腺大小和临床需要先常规系统活检6~13针,并对重点怀疑部位行靶穿刺2~5针(见图1、2)。
6点穿刺:双侧尖部、中部及基底部。
8点穿刺:6点加两侧叶外侧中部2点。
11点穿刺:在6点基础上增加左、右叶外周带外侧各1点及中线3点。
13点穿刺:在6点基础上增加左、右叶外周带外侧各2点及中线3点。
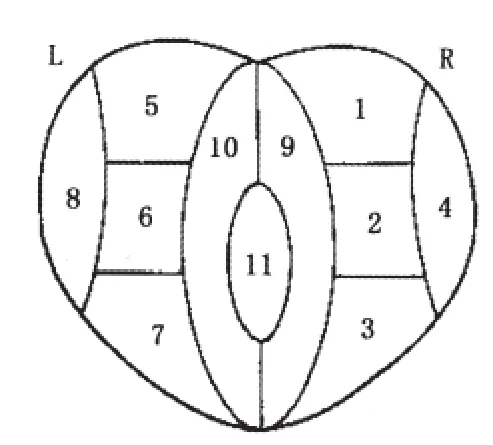
图1 11针穿刺法

图2 6针穿刺法
由操作医师记录活检位置。标本以10%福尔马林固定,用石蜡包埋切片,由病理医师观察报告。
1.6 数据统计和分析
所有数据应用SPSS 11.5统计软件进行统计分析,以P<0.05为差异有统计学意义。采用敏感性、特异性、Younden指数、符合度、阳性似然比、阴性似然比评价诊断试验的真实性。计算阳性预测值、阴性预测值进行诊断试验收益评价。计数资料采用χ2检验分析。根据诊断结果和病理对照结果做受试者操作特性(receiver operating characteristic curve,ROC)曲线分析。
2 结果
2.1 病理穿刺结果
所有42 例患者在超声引导下经直肠行6~13针穿刺活检。前列腺癌15例,其中中高分化(Gleason评分1~3分)1例,占6.67%;中分化(Gleason评分4~7分)10例,占66.7%;低分化(Gleason评分8~10分)4例,占26.7%。27例为前列腺良性病变。
前列腺252个分区全部得到病理证实,其中51个分区为癌,201个分区为非癌,癌灶在各分区间分布的差异无统计学意义(表1)。

表1 不同分区的穿刺病理结果

表2 T2WI诊断结果
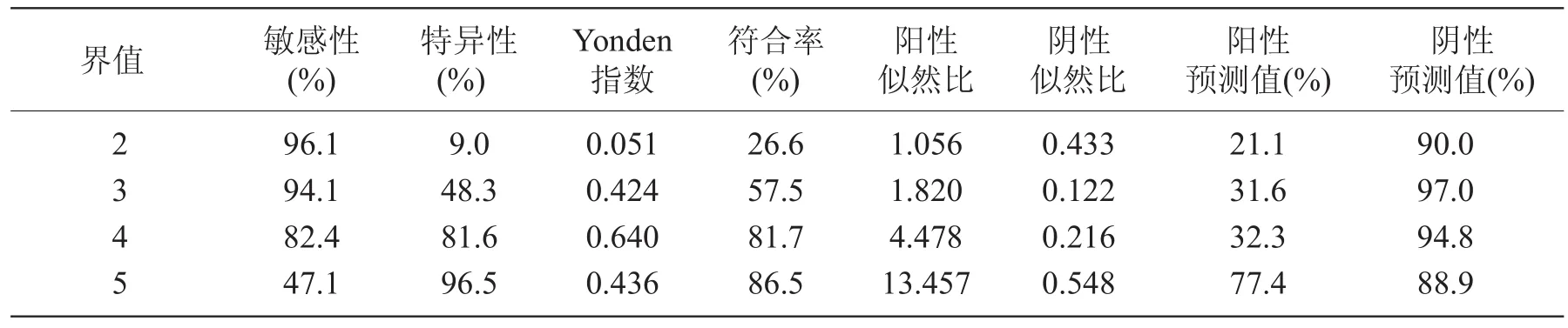
表3 ADC诊断结果

表4 MRS诊断结果
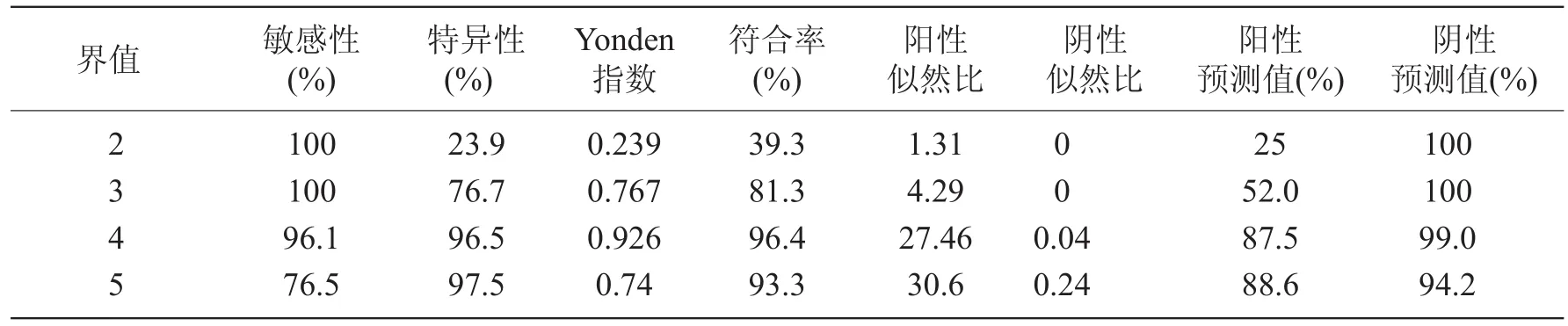
表5 三种方法综合诊断结果
2.2 MRI诊断结果
将结果取4种不同界值,分别对诊断的真实性、可靠性和收益进行评价。
T2WI诊断结果:根据Yonden指数,在界值取3时,T2WI诊断结果与病理结果最相符,敏感性为88.2%,特异性为67.2%,阳性预测值与阴性预测值分别为40.5%及95.6%。根据T2WI诊断和病理结果对照做出ROC曲线,ROC曲线下面积为0.848±0.030(图3,表2)。
DWI诊断结果:根据所得Yonden指数,在界值取4时,即ADC诊断界值为1.31×10-3mm2/s时,ADC诊断结果与病理结果最相符,敏感性为82.4%,特异性为81.6%。阳性预测值与阴性预测值分别为32.3%及94.8%。ROC曲线下面积为0.860±0.033(图3,表3)。
MRS诊断结果:根据所得Yonden指数,在界值取5时,即CC/C界值为0.99时,MRS诊断结果与病理结果最相符,敏感性为84.3%,特异性为98.0%。阳性预测值与阴性预测值分别为91.5%及96.1%。ROC曲线下面积0.961±0.016(图3,表4)。
三种方法综合诊断结果:根据Yonden指数,界值取4时,诊断结果与病理结果一致性较高,其敏感性、特异性分别为96.1%及96.5%,阳性预测值及阴性预测值分别为87.5%和99%。ROC曲线下面积为0.978±0.009(图3,表5)。
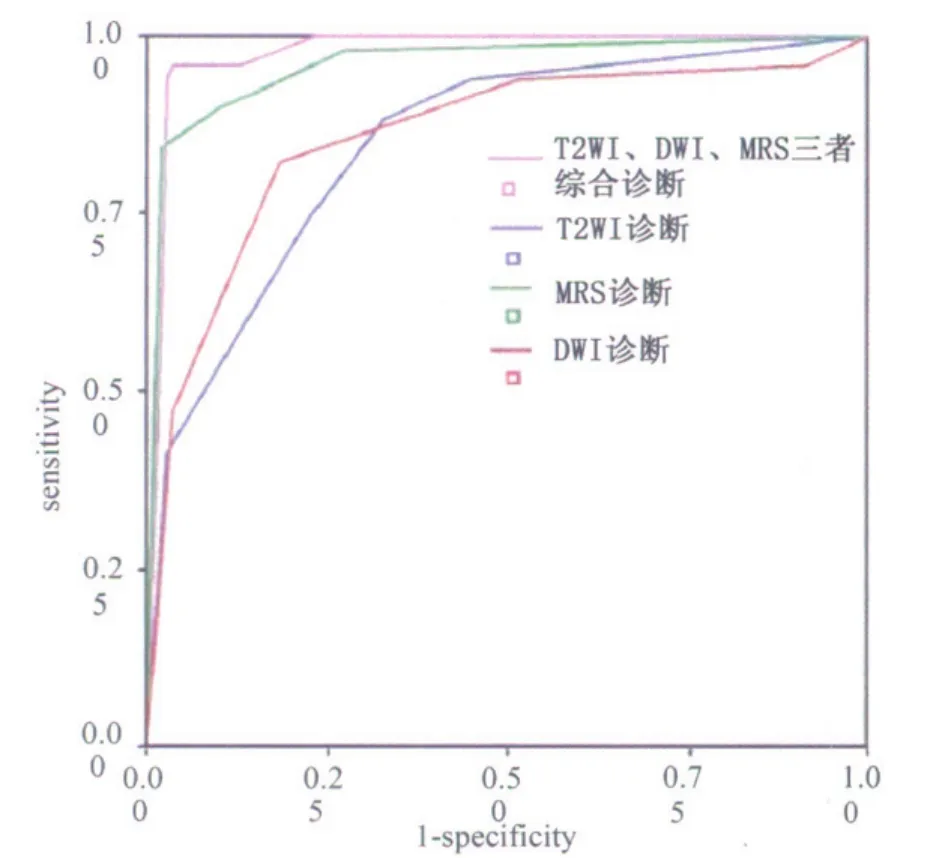
图3 三种方法综合诊断结果的ROC曲线及与各方法所得ROC曲线对照
3 讨论
3.1 T2WI诊断前列腺癌
前列腺解剖结构在T 2 W I上显示最好。70%~75%的前列腺癌发生于外周带,T2WI上通常表现为低信号,在外周带容易与正常组织的高信号相区别(图4A)。然而,T2WI上外周带低信号并非前列腺癌特异表现,部分良性病变如前列腺炎、前列腺出血、良性前列腺增生(benign prostatic hyperplasia,BPH)、放疗或内分泌治疗后改变等也可有类似表现,这些疾病是导致外周带前列腺癌诊断特异性减低的常见原因。而发生于中央腺体的前列腺癌则显示欠佳,因为癌与正常组织在T2WI上均表现为低信号。Quint等[6]早期研究表明部分前列腺癌在T2WI上表现为等或高信号,易被漏诊。Ikonen等[7]的研究进一步提示了低分化的前列腺癌由于向周围腺体内浸润,因而与周围的前列腺无明确分界,在T2WI上表现为等信号,不易被检出。

图4 前列腺癌。4A. 抑脂T2WI右侧外周带不规则形低信号影,内部腺体结构不清,与相邻中央腺体分界不清,右侧包膜中断,相邻静脉丛受侵。T2WI评分为5分。4B. MRS示Cho峰明显增高,Cit峰下降,CC/C值为1.68,MRS评分为5分。4C. ADC图示右侧大部分腺体信号明显减低,ADC值0.65~0.67×10-3 mm/s2 ,ADC评分为5分
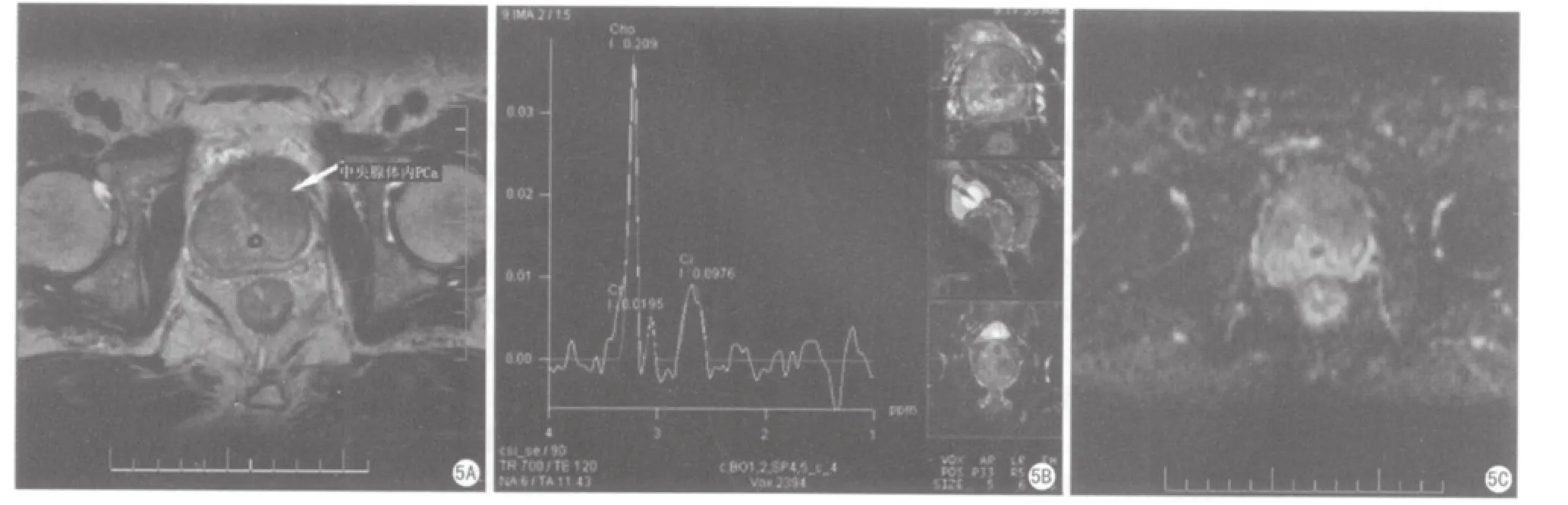
图5 中央腺体内前列腺癌。5A. T2WI左侧中央腺体内较大的低信号肿块影,内部腺体结构不清,边缘结节状。T2WI评分5分。5B. MRS示Cit峰明显减低,Cho峰高耸,CC/C值为1.96,MRS评分为5分。5C. ADC图示左侧中央腺体内明显的低信号灶,ADC值0.75~0.87×10-3 mm/s2 ,ADC评分为5分
本实验中,大多数癌性病变与文献报道相符[6,7],表现为T2WI上不规则低信号肿块影,并伴有周围腺体组织结构破坏或包膜受侵。实验中假阳性分区为慢性前列腺炎症和BPH干扰造成,假阴性分区则由体积小于5 mm3的病灶或位于尖部或中央腺体的病灶导致。
3.2 DWI诊断前列腺癌
随着平面回波成像的应用,利用DWI的ADC值鉴别前列腺良恶性病变具有了可行性。低ADC值反映了高细胞密度和高血流导致的自由水扩散受限。而高细胞密度和高血流与微血管密度相关,两者均提示前列腺内肿瘤组织的存在。
本研究中,前列腺癌区域均表现为在DWI上相对于周围正常组织高信号,ADC图低信号,中央带内PCa兴趣区的平均ADC值低于非癌组织兴趣区。这与大多数相关文献报道的扩散成像表现相符[8,9](图5C)。正常前列腺外周带的腺泡沿着尿道呈放射状分布,腺体和腺管结构丰富,水分子运动自由度较高,ADC值也相应较高,而在肿瘤区域,细胞密度增大、高核浆和细胞外水减少比可能会对分子扩散造成影响,从而使ADC值下降。已有研究表明,肿瘤与外周带ADC值存在显著不同[8,10]。本研究中,正常前列腺中央腺体在ADC图上信号较外周带明显降低,与文献报道一致,分析为中央腺体内基质及平滑肌成分比较较大,对分子的扩散有一定限制影响。但本实验数据也表明PCa与良性病变如良性前列腺增生、炎症间及正常前列腺组织间ADC值的交叉较大,导致部分良性病变为假阳性数据,并干扰部分早期局灶性癌变的检出,使得诊断的敏感性和特异性不够理想,此结果与Pickles等[10]研究结果相符。
3.3 MRS诊断前列腺癌
MRS通过对代谢物包括枸橼酸盐(Cit)、胆碱(Cho)和肌酸(Cre)的测量以及(Cho+Cre)/Cit的比值的计算,在前列腺癌的诊断中起重要作用[11,12](图4B、5B)。我们的研究显示,CC/C界值为0.99时,MRS敏感性为84.3%,特异性为98.0%,准确性为0.961。而正常及良性病变前列腺组织的CC/C值与前列腺癌存在显著差异,为0.53±0.28。癌灶波谱显示Cit峰下降,部分消失,Cho峰明显升高,Cre峰未见明显改变。Cho+Cre水平明显高于Cit水平,CC/C值升高,分布于2.20±1.11。本研究中,假阴性病例主要由位于尖部的肿瘤和微小癌灶导致,假阳性病例主要由于良性前列腺增生及慢性炎症导致。
3.4 三者综合诊断前列腺癌
近年来,许多研究综合运用不同磁共振技术诊断前列腺癌[13,14]。Shimofusa等人[15]对DWI和T2WI综合应用诊断前列腺癌所作研究表明相比DWI及T2WI两种技术独立成像,综合应用两者的诊断结果与病理较符合,Wefer等[16]研究以及Scheidler等[17]的研究证实T2WI与MRS的结合诊断增加了前列腺癌的检出和定位的准确性。
本研究中,三种方法综合应用诊断时,界值取4,其敏感性、特异性分别为96.1%及96.5%,ROC曲线下面积为0.978±0.009,诊断前列腺癌的准确性最高,与病理穿刺结果高度一致,有助于进一步提高前列腺癌检出的敏感性,其较高的特异性显著提高了对良恶性病变的鉴别诊断能力。根据ROC曲线下面积,MRS单独诊断效率与综合方法诊断结果相近,尤其在诊断的特异性方面优势显著,与以前的报道相符[11,12]。
由于本研究所选非癌组病变以良性前列腺增生及慢性前列腺炎症比例较大,而正常前列腺比例很小,因此良恶性病变的鉴别诊断尤为重要。根据结果,MRS在此方面有较高价值,这与国内外文献报道一致。但其扫描时间过长,在微小癌灶、腺体边缘病变及前列腺周围组织受侵判断方面有一定局限。DWI成像时间较短,肿瘤和正常组织在ADC图中对比明显,但ADC值根据不同个体及不同扫描参数差异较大。本研究中,由于ADC诊断中良恶性病变诊断数据交叉较大,因此在三种诊断技术中,ADC诊断效能居中,其扫描技术如b值的选择及ADC界值的确定有待进一步研究。T2WI可较好的显示前列腺及盆腔内周围组织的定位及形态,在判断肿瘤分期中有一定价值。本研究中,T2WI能够明确的显示分期较高的或者低分化恶性度较高的癌灶,但对早期局灶癌或高分化癌变的敏感性欠佳,对慢性前列腺炎症及混合型或基质型前列腺增生的病变诊断特异性不高。
采用界值为4分诊断时,假阳性病例由慢性前列腺炎病变导致,假阴性病例为1例微小灶性癌。
本实验的不足之处:①病理结果均为系统穿刺结果,其所获组织标本量较少,导致假阴性率较高。前列腺尖部病变及早期侵袭性较低的微小灶更易被漏穿。②系统穿刺结果和MRI6分区法定位的符合度有待进一步研究。③本实验所选非癌性病变多数为良性前列腺增生或慢性前列腺炎,正常前列腺组织比较较小,此比例可能造成假阳性数据增加,所得特异性减低。④由于目前国内外尚未有关于对照三种成像技术的大规模数据报道,且本实验数据规模较小,因此采用平均三种方法评分值,未探讨三种方法在前列腺癌诊断价值中的权重。
由本研究结果可以看出,MR的形态学成像和功能成像在前列腺癌诊断中各有所长,三种成像技术综合应用可以较好的弥补各种方法对诊断敏感性和特异性的局限,在提高诊断准确性方面价值显著。而在三种MR成像技术中,MRS的诊断价值较高。
[1]Jemal A, Siegel R, Ward E, et al. Cancer statistics. CA Cancer J Clin, 2007, 57(1): 43-66.
[2]Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics.CA Cancer J Clin, 2002, 55(2): 74-108.
[3]Mescher M, Merkle H, Kirsch J, et al. Simultaneous in vivo spectral editing and water suppression. NMR Biomed, 1998, 11(6): 266-272.
[4]Tanimoto A, Nakashima J, Kohno H, et al. Prostate cancer screening: the clinical value of diffusion-weighted imaging and dynamic MR imaging in combination with T2-weighted imaging. J Magn Reson Imaging, 2007, 25(2):146-152.
[5]Wang XY, Zhou LP, Ding JP, et al. Quantitative criteria of MR spectroscopy in the differential diagnosis of prostate cancer in China: preliminary study. Chin J Med Imaging Technol, 2004, 20(8): 1150-1153.
[6]Quint LE, Van Erp JS, Bland PH, et al. Prostate cancer:correlation of MR images with tissue optical density at pathologic examination. Radiology, 1991, 179(3): 837-842.
[7]Ikonen S, Karkkainen P, Kivisaari L, et al. Endorectal magnetic resonance imaging of prostatic cancer:comparison between fat-suppressed T2-weighted fast spin echo and three-dimensional dualecho, steady-state sequences. Eur Radiol, 2001, 11(2): 236-241.
[8]Hosseinzadeh K, Schwarz SD. Endorectal diffusion weighted imaging in prostate cancer to differentiate malignant and benign peripheral zone tissue. J Magn Reson Imaging, 2004, 20(4): 654-661.
[9]Issa B. In vivo measurement of the apparent diffusion coeff i cient in normal and malignant prostatic tissues using echo-planar imaging. J Magn Reson Imaging, 2002, 16(2):196-200.
[10]Pickles MD, Gibbs P, Sreenivas M, et al. Diffusionweighted imaging of normal and malignant prostate tissue at 3.0T. J Magn Reson Imaging. 2006, 23(2): 130-134.
[11]Kurhanewicz J, Vigneron DB, Nelson SJ. Threedimensional magnetic resonance spectroscopic imaging of brain and prostate cancer. Neoplasia, 2000, 2(2): 166-189.
[12]Zakian KL, Sircar K, Hricak H, et al. Correlation of proton MR spectroscopic imaging with Gleason score based on stepsection pathologic analysis after radical prostatectomy.Radiology, 2005, 234(3): 804-814.
[13]Reinsberg SA, Payne GS, Riches SF, et al. Combined use of diffusion weighted MRI and 1H MR spectroscopy to increase accuracy in prostate cancer detection. Am J Roentgenol, 2007, 188(1): 91-98.
[14]Tanimoto A, Nakashima J, Kohno H, et al. Prostate cancer screening: the clinical value of diffusion-weighted imaging and dynamic MR imaging in combination with T2-weighted imaging. J Magn Reson Imaging, 2007,25(2): 146-152.
[15]Shimofusa R, Fujimoto H, Akamata H, et al. Diffusionweighted imaging of prostate cancer. J Comput Assist Tomogr, 2005, 29(2): 149-153.
[16]Wefer AE, Hricak H, Vigneron DB, et al. Localization of prostate cancer: comparison of sextant biopsy,magnetic resonance imaging and magnetic resonance spectroscopic imaging with step section histology. J Urol, 2000, 164(2):400-404.
[17]Scheidler J, Hricak H, Vigneron DB, et al. Prostate cancer: localization with three-dimensional proton MR spectroscopic imaging—clinicopathologic study.Radiology, 1999, 213(2): 473-480.

