腹泻性贝毒大田软海绵酸间接竞争ELISA检测方法的建立
胡乐琴,柳俊秀,王 权,田晓玲,何培民
(1.上海海洋大学水产与生命学院,上海南汇201306; 2.中国农业科学院上海家畜寄生虫病研究所,上海闵行200232)
大田软海绵酸(OA)是腹泻性贝类毒素(DSP)的主要成分,其藻源分布广,在我国引发的中毒事件最多,危害最大[1],已被列为最重要的食物中毒之一,而我国迄今为止尚没有一种较合适于现场使用的软海绵酸检测方法,因此研制我国自己的检测软海绵酸的方法已成为当务之急。与其他检测方法相比,酶联免疫法具有灵敏度高、特异性好、重复性高和检测准确快速的优点[2],在现场快速检测上具有开发前景,近年来在赤潮藻毒素快速检测方面得到重视和发展。本实验室在成功制备高效价OA单克隆抗体的基础上,初步建立了检测OA的间接竞争酶免疫学检测方法,为研制具有自主知识产权的相关检测试剂盒奠定了基础。
1 材料与方法
1.1 材料与试剂 杂交瘤细胞株由本课题组研制和冻存;BALB/c健康小鼠由中国科学院实验动物中心研究所提供。其他试剂国产分析纯。
1.2 OA单克隆抗体制备 按常规小鼠腹水法[3]制备单克隆抗体。
1.3 包被抗原(2.5 mg/L)的制备 按文献[4]的方法制备。
1.4 间接竞争ELISA检测方法的建立
1.4.1 抗原、抗体最佳稀释浓度的确定 在96孔ELISA板上按常规方法进行。检测抗原用包被缓冲液pH 9.6,0.05 mol/L碳酸盐缓冲液稀释为1∶1 000、1∶2 000、1∶4 000、1∶8 000四个浓度 ,每浓度做3个重复;OA抗体用含5%牛血清的稀释液稀释成1∶5 000、1∶10 000∶1∶15 000、1∶20 000、1∶4 0000、1∶6 000、1∶8 000七个浓度梯度;封闭液为1%明胶;酶标二抗羊抗鼠 IgG浓度为1∶5 000;显色液为 TMB;终止液为 2 mol/L H2SO4。在酶标仪上测定OD450值。
1.4.2 一抗、二抗最佳反应时间的确定 根据以上试验选取最佳的抗原、抗体稀释度包板,将一抗的保温时间设为 30、60、90、120 min 4 组 ,每组 3 个平行,二抗反应时间固定为60min。测定OD450值,选择最佳一抗反应时间。固定此最佳的一抗反应时间,将二抗反应时间设为 30、60、90、120 min 4组,每组3个平行,重复以上试验,根据OD450值选择最佳二抗反应时间。
1.4.3 OA溶解液甲醇含量对id-ELISA的影响一抗和甲醇同时加入,每孔甲醇终浓度设置为0%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%等11个浓度梯度,测OD450值。根据OD450值的大小进行判定甲醇对免疫反应的影响。
甲醇溶解OA后和一抗同时加入,OA浓度为1∶8 000;每孔甲醇的终浓度为20%、30%、40% 。另设一组不加OA的作为阴性对照组。测OD450值,计算出抑制率。
1.5 OA间接竞争ELISA标准曲线的获得 OA终浓度稀释为200 ng/mL、100 ng/mL、50 ng/mL、25 ng/mL 、12.5 ng/mL 、6.25 ng/mL 、5 ng/mL 、2.5 ng/mL 、1.25 ng/mL、0.625 ng/mL 、0.3125 ng/mL 、0.156 ng/mL、0.078 ng/mL 13个浓度梯度,按最佳的稀释度和反应时间,用间接竞争ELISA法检测OD450值,以抑制率(P/N)为纵坐标,以log(10×OA浓度)为横坐标绘制标准工作曲线。
1.6 样品模拟提取与加标回收 方法参见(Tagmouti-Talha F,2000)[5]。将贝类样品洗净、匀浆,称取5 g于离心管,加入弱酸性的甲醇溶液,随后加入一定量的OA标准液。3 500 r/min离心10 min,取上清。将上清分装两管,分别加入甲醇和正己烷,涡旋混匀,静止分层。弃正己烷层,在旋转蒸发仪上蒸干,加少量甲醇溶解壁上附着物,再蒸干。最后用100 μ L 甲醇溶解残余物 ,再加 900 μ L PBST,混匀 。提取物进行ELISA检测。
OA的实测含量(ng/mL)是根据酶标板上测得OD450值后由标准曲线求得log(10×OA浓度),再通过反对数计算得出。
1.7 精密度测定 取一定量样品,平行提取,同时检测,求得实测浓度。
1.8 计算 抑制率P/N(%)=(A0-A)/A0×100%(A为吸光值);回收率=实测浓度/添加浓度×100%;精密度=变异系数=SD/X(X为实测浓度的平均值,SD为标准差)。
2 结果
2.1 抗原和单抗最适工作浓度的确定 按试验方法测定OD450值,选OD450值为2.0左右的确定为抗原抗体最适工作浓度。结果显示,检测抗原OAOVA按1:2 000稀释即浓度为 1.25 μ g/L,单抗稀释度为1:20 000时,既能保证免疫反应效果好,又使得抗原抗体用量最少。
2.2 甲醇含量对id-ELISA的影响 试验结果表明,未加OA时,OD450随着一抗中甲醇浓度的提高而递增,当甲醇终浓度高于10%时,这种递增趋势更明显。当OA与甲醇同时加入时,甲醇浓度的增加会降低OA免疫反应的抑制率(如图1)。因此,样品提取时,为了保证OA全部萃取出来,可先用少量甲醇将其溶解,再用缓冲溶液PBST将甲醇含量稀释到10%以下,而在ELISA检测时,可以直接用PBST稀释OA标准溶液或样品溶液,将甲醇对检测的干扰减少到最低值。
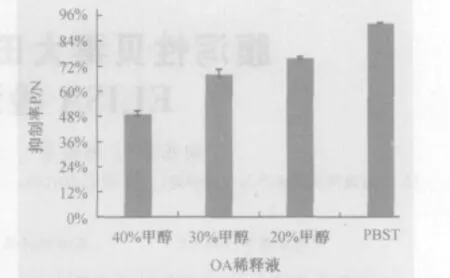
图1 甲醇含量对抑制率的影响 (加OA)
2.3 抗体反应时间对id-ELISA的影响 从试验结果得知,未加OA时,吸光值OD450会随着抗体反应时间的延长而增加,考虑到要节省检测时间,因而选用抗体反应时间都为60 min和90 min进行OA间接竞争免疫抑制反应,结果如图2所示,表明一抗和酶标二抗的反应时间均为60 min时,其抑制率较高,即抗体对包被抗原结合反应的抑制效果最好。
2.4 OA间接竞争ELISA检测方法的建立 用碳酸盐缓冲液将OA-OVA包被原稀释为1∶2 000,包被96孔酶标板,每孔 100 μ L,4℃过夜;弃残液,洗板;用1%明胶封板,每孔 150 μ L,37℃下保温 2 h;弃封闭液,洗板,用PBST将OA标准溶液或贝类萃取液稀释为系列浓度,分别与等体积的单抗混匀,单抗终稀释度为1∶20 000,每孔加入100 μ L,37℃下保温1 h;弃去残液,洗板,加入酶标二抗,按产品说明书推荐的浓度 1∶5 000进行稀释,每孔100 μ L,37℃下保温1 h;洗板3次,每孔加入100 μ L显色液,室温下反应10~15 min,加入终止液,测OD450值。
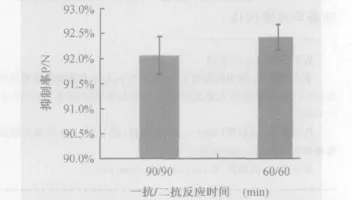
图2 抗体反应时间对id-ELISA的影响
2.5 OA间接竞争ELISA标准曲线的获得 试验结果如图抑制率曲线(图3)和标准曲线(图4)。抑制率曲线呈“S”分布。当OA的浓度低于0.3125 ng/mL时,抑制率几乎降到0,而高于50 ng/mL时,OA对免疫反应的抑制效果几乎一样,因此,OA浓度的有效检测范围在0.3125 ng/mL~50 ng/mL之间,在此范围内绘制OA间接竞争ELISA标准曲线。
标准曲线的回归方程和相关系数分别为y=0.392x-0.054,R2=0.955,有效线性检测范围为0.3125 ng/mL~50 ng/mL,IC50为2.59 ng/mL,检测限为0.45 ng/mL。

2.6 OA加标回收率与样品精密度测定结果 在OA阴性的贝类样品中分别加入12.5、25、125、500 ng/mL的OA标准溶液,提取后用本试验建立的间接竞争ELISA法进行检测,其回收率与精密度结果见表1。此方法平均回收率为55.85%,变异系数为3.03%~8.94%,说明该方法重复性良好,无需在样品检测时做更多平行样。既节约了试剂成本,又节约了人力和时间的消耗。
3 讨论
目前,国内检测OA的方法主要是小鼠法、高效液相色谱法(HPLC)和免疫检测技术(ELISA)。小鼠法简便易行,但缺点是受干扰较大,数据不精确[6];HPLC法可准确分析毒素的含量和种类,检测限可低至ng/g,但样品前处理过程复杂,仪器昂贵,需要专门人员;ELISA法比HPLC法样品前处理简单得多,特异性好,无需纯化浓缩。另外,ELISA法比HPLC法操作时间短,一次可处理大量样品,而且,ELISA法比HPLC法投资小,适合基层单位使用,因此呈现出了较好的应用前景,受到国内外研究人员的广泛关注。

表1 回收率与精密度测定结果
国外多家公司已开发研制出了检测OA的试剂盒,如日本 Panapharm Laboratories公司生产的OA ELISA检测试剂盒检出限是10 ng/mL[7],美国柏尔BIOO公司也生产出了OA ELISA检测试剂盒,但由于价格昂贵,远不适用于我国商检部门的大量应用。近几年国内外均开展了许多关于OA毒素的检测研究,如卢士英[8],用ELISA法检测OA的线性范围为0.4 ng/mL~25 ng/mL,而本研究的线性检测范围为0.3125 ng/mL~50 ng/mL,比其检测范围要广;李爱峰[9]利用蛋白磷酸酶活力抑制法检测OA的最低浓度为0.6 ng/mL,Takashi U等建立的ELISA检测腹泻性贝毒方法检出限为10 ng/mL[2],而本研究的最低检测限是0.45 ng/mL,比前者都低;Maurice V L等[10]运用OA的快速检测试剂盒,检测其 IC50为 6.5 ng/mL,本研究的IC50为2.59 ng/mL,说明本研究的灵敏度更低。
因此,本试验研究结果证明,该ELISA方法工作范围更宽,灵敏度较低,检测限也偏低,试验重复性较高。但样品回收率与国内外存在较大差距,今后需在样品模拟提取上进一步摸索与完善。
[1]Suganuma M,Fujuki H,Suguri H,et al.Okadaic acid:a new non-12-O-tetradecanoyl phorbol acetate type tumour promoter[J].Proc natn Acad Sci USA,1988,85:1768-1773.
[2]刘仁沿,梁玉波,张芳,等.中国沿海贝类腹泻性贝毒的酶联免疫分析方法[J].大连海事大学学报,2008,34(2):33-36.
[3]李自刚,王慧杰.生物检测技术[M].北京:中国轻工业出版社,2007.
[4]Nuria M Llamas,Linda Stewart,Terry Fodey,et al.Development of a novel immunobiosensor method for the rapid detection of okadaic acid contamination in shellfish extracts[J].Anal Bioanal Chem,2007,389:581-587.
[5]Tagmouti-Talha F,Moutaouakkil A,T aib N,et al.Detection of Paralytic and Diarrhetic Shellfish Toxins in Moroccan Cockles(Acanthocardia tuberculata)[J].Bull Environ Contam Toxicol,2000,65:707-716.
[6]柳俊秀,陈桃英,何培民,等.微小亚历山大藻麻痹性贝类毒素的检测[J].生物技术通报,2008,5:181-184.
[7]Vale P,Sampay o MAM.Comparison between HP LC and a commercial immunoassay kit for detection of okadaic acid and esters in Portuguese bivalves[J].Toxicon,1999,37:1565-1577.
[8]卢士英,周玉,李岩松,等.大田软海绵酸单克隆抗体 ELISA检测方法的建立[J].中国兽医学报,2007,27(3):336-411.
[9]李爱峰,于仁成,李钧,等.利用蛋白磷酸酶活力抑制法检测牡蛎体内的腹泻性贝毒[J].分析化学研究报告,2006,34(3):283-287.
[10]Maurice V L,Joanne F J,Dorothy J E,etal.First report of a new rapid assay for diarrhetic shellfish poisoning toxins[J].Harmful Algae,2006,5:74-78.

