利用昆虫杆状病毒表达系统表达PCV2 ORF2蛋白及其抗体的制备
韦 莉,王 菁,朱珊珊,侯 磊,佘锐萍,刘 爵
(1.中国农业大学动物医学院,北京海淀100193;2.北京市农林科学院畜牧兽医研究所,北京海淀100097)
猪圆环病毒(porcine circovius,PCV)最早是Tischer等于1974年在传代细胞系PK15中发现,该病毒可以持续感染PK15细胞,不引起细胞病变,对猪无致病性。1991年在加拿大猪群中发现称之为断奶仔猪多系统衰竭综合征(post-weaning multisystemic wasting syndrom,PMWS)的病,发现其主要是由一种致病性猪圆环病毒引起,目前,将这种致病性PCV划为 PCV2,而将对猪无致病的称为PCV1。PMWS通常发生于5~12周龄的仔猪,典型症状包括消瘦、虚弱、呼吸困难和淋巴结肿大,急性暴发时,死亡率可达15%以上。PMWS既可水平传播,导致断奶仔猪发病死亡;亦可垂直传播,引起繁殖障碍,给养猪业带来了很大的经济损失,已引起世界各地的广泛的重视。
PCV为圆环病毒科圆环病毒属成员,是迄今发现的一种最小的动物病毒。PCV2基因组为环状单链DNA,基因组分为3种,1 766 nt、1 767 nt和1 768 nt[1],病毒粒子无囊膜,呈二十面体对称,直径17 nm。PCV含有两个主要阅读框ORF1和ORF2,ORF1编码与病毒复制相关蛋白,此蛋白在这两型病毒之间有85%同源性,是PCV1和PCV2产生抗原交叉性的主要原因[2]。而ORF2编码病毒结构蛋白-衣壳蛋白(Cap)的基因,此蛋白具有良好的免疫原性,且PCV1和PCV2之间不发生血清学交叉反应[3],是检测病毒抗体水平的良好抗原。T ruong 等[4]、Nawagitgul等[5]及 Blanchard 等[6]利用PCV2 ORF2特异性抗原表位或完整蛋白作为诊断抗原建立了PCV2 ELISA方法,并在临床应用中取得了较好的效果。另外,Liu等[7-8]报道一个由ORF3编码的新蛋白质,参与宿主细胞凋亡。
由于该病毒感染细胞不出现细胞病变,且病毒培养物毒价很低、不易纯化,给研究和生产工作带来一定困难。20世纪80年代发展起来的杆状病毒表达系统,可以在昆虫细胞内表达蛋白质,由于表达的蛋白转录后加工修饰较好、生物学活性高、表达量高及安全性好等优点[9],日益受到人们的重视,已成为研究和生产各种蛋白的有力工具。国内刘长明等[10]用昆虫杆状病毒表达了PCV2 ORF2,但其选用蚀斑筛选重组病毒,比较繁琐;樊惠英等[11]用Bac-to-Bac系统成功表达PCV2 ORF2,并形成病毒样颗粒。本试验目的是利用昆虫杆状病毒表达PCV2 ORF2基因,制备出ORF2的抗体,为今后的研究奠定基础。
1 材料与方法
1.1 质粒、细胞株和菌种 载体 pBluescriptSKORF2 、pFast-bacHTa、E.coli DH10Bac 感受态,Sf9细胞均为本组保存。
1.2 试剂 质粒提取试剂盒购自Promega公司,快速凝胶回收试剂盒购自QIAGEN公司,T4连接酶,Taq DNA polymerase购自TaKaRa公司;各种限制性内切酶,低分子量标准蛋白(Marker)购自BioLabs公司,辣根过氧化物(HRP)标记二抗购自Sigma公司;SF900-ⅡSFM 培养基购自Gibco公司;Cellfectin Reagent转染试剂购自Invitrogen公司。
1.3 ORF2基因的扩增、回收 用PCR扩增完整的 ORF2基因,使用引物为:HT aORF2(5):5′-CCGCTCGAGG ATG ACG TAT CCA AGG AGG CGT TAC-3′和 H TaORF2(3):5′-GGGGTACC TTA AGG GTT AAG TGG GGG GTCTT T AAG-3′,限制性酶切位点分别为 XholⅠ和KpnⅠ用下划线表示。50 μ L扩增体系中含 0.5 μ L pBluescriptSK-ORF2,特异性引物各 50 pmol/μ L,1μ L 10 mmol/L dNTP混合物,2.5 U的 Taq酶,5 μ L 10×PCR缓冲液(含 15 mmol/L MgCl2)。反应程序为:94℃变性3 min;94℃35s,55℃45s,72℃1 min 30 s,共35个循环;72℃延伸10 min。琼脂糖凝胶检测PCR产物。用快速凝胶回收试剂盒回收PCR产物。
1.4 重组杆状病毒Bacmid-ORF2的构建与鉴定回收的 ORF2经 XholⅠ和 KpnⅠ酶切,克隆至pFast-bacH Ta载体中,构建pFast-bacH Ta-ORF2,将其转化入感受态DH10Bac中,用M13公用引物和ORF2特异性引物 PCR鉴定阳性的重组质粒Bacmid-ORF2,制备重组质粒,转染Sf9昆虫细胞,参照文献[13]进行重组病毒增殖,获得稳定重组病毒,重组病毒命名为rBac-ORF2,4℃避光贮存。
1.5 间接IFA检测重组病毒rBac-ORF2的表达Sf9细胞于 96孔板中长成单层后,接种 rBac-ORF2,72 h后,用PBS洗2次,冷无水乙醇固定,室温作用30 min,再用PBS洗3次,用PCV2猪血清作为一抗50 μ L/孔,37℃孵育1 h,PBS 洗 3次,加荧光标记羊抗猪IgG为二抗 50 μ L/孔,37℃孵育1 h,用PBS洗2~3次后,在荧光显微镜下观察。
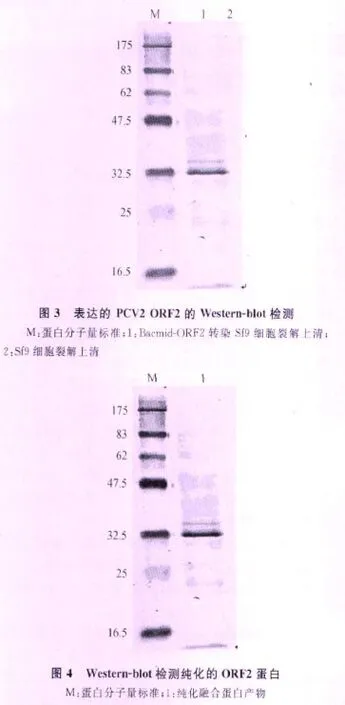
1.6 Western-blot检测重组病毒rBac-ORF2的表达 以重组病毒适量感染昆虫细胞Sf9,72 h后见胞核变大,有粗糙颗粒状,1 000 r/min离心5 min,分别收集上清与细胞,上清避光贮于4℃,细胞用预冷的裂解液重悬后,冰浴中超声裂解,4℃,10 000 r/min,离心,30 min收集上清。常规制备样品,12%SDS-PAGE分离蛋白,将蛋白转移至NC膜上,封闭NC膜,PBS-T洗膜2次,加入适当稀释的一抗溶液,室温孵育2 h,PBS-T液洗膜3次,放入适当稀释H RP标记的羊抗猪IgG二抗中,室温孵育1.5 h,PBST液洗膜3次,每次10 min。把NC膜浸入到配好的底物溶液中显色,出现颜色时,立刻用蒸馏水冲洗终止反应,拍照。
1.7 目的蛋白的纯化 收集的细胞用预冷的含8 mol/L尿素裂解液重悬后,冰浴中超声裂解细胞,4℃,20 000 r/min离心30 min,收集上清。用600 μ L含8 mol/L尿素裂解缓冲液平衡Ni-NTA柱,以1 000 r/min离心5 min。在预平衡的Ni-NTA柱中注入600 μ L细胞裂解上清,其中含有6×His标记的蛋白,1 000 r/min离心5 min并收集上清。用600 μ L含8 mol/L尿素冲洗缓冲液洗Ni-NTA柱2次,1 000 r/min离心 5 min。用200 μ L含8 mol/L尿素洗脱缓冲液抽提蛋白3次,1 000 r/min离心5 min,并收集抽提洗出液。采用透析复性的方法使变性的蛋白复性。
1.8 豚鼠抗血清的制备 注射前将提纯的蛋白样品与Seppic公司生产的豚鼠专用免疫佐剂等体积混合,形成乳浊液。用酒精棉球消毒豚鼠四肢,将所备样品等量注射到豚鼠腹股沟皮下(多点注射)。2周后以同样剂量与佐剂等体积混合,四肢肌肉注射,加强免疫1次。再2周后以同样剂量与佐剂等体积混合后第2次加强免疫。免疫后10 d测抗体滴度,若滴度达到要求则处死豚鼠取血清,若未达到要求,则再加强免疫,经间接ELISA检测抗体滴度达到要求后再采血分离血清。
2 结果
2.1 重组 Bacmid质粒的 PCR鉴定 分别用ORF2特异引物和M13引物进行PCR扩增发现结果均与预期相符,表明Bacmid-ORF2构建正确。
2.2 重组杆状病毒间接免疫荧光鉴定 用带有ORF2基因重组Bacmid质粒转染Sf9细胞,感染72 h后,间接免疫荧光试验表明,在接种重组质粒的Sf9细胞中可见到特异性的荧光(图1)。而未接种的Sf9细胞无荧光反应(图2)。

2.3 ORF2蛋白的表达 将重组蛋白PCV2 ORF2转至NC膜上进行免疫学反应,结果显示,所表达的蛋白产物能被PCV2特异性血清识别,证明表达产物是ORF2的特异性蛋白,并且具有免疫原性(图3)。用变性方法通过Ni-NAT柱提纯,复性后,Western-blot检测结果获得较纯的目的蛋白(图4)。
2.4 豚鼠血清抗体滴度分析 用提纯的重组蛋白免疫豚鼠,分别取免疫前、后豚鼠血清分析抗体滴度。免疫前的豚鼠血清作为一抗时,包被抗原为5 ng、10 ng、20 ng、40 ng 和 80 ng,抗体滴度1 ∶50时均出现阳性反应,1∶100时均无明显阳性反应。免疫后豚鼠血清作为一抗时,抗原量10 ng时,1∶2 000下仍有弱阳性反应;80 ng时,1∶4 000仍有明显阳性反应,说明该制备抗体与PCV2 ORF2蛋白具有显著的结合力。
3 讨论
猪圆环病毒2型(PCV2)感染可造成猪免疫系统的损伤,引起感染猪的T淋巴细胞、B淋巴细胞数量减少;细胞因子的表达量改变,而且感染PCV2后,机体的免疫力下降,感染猪处于亚健康状态,其他病原如猪呼吸与繁殖综合征病毒、猪细小病毒等或应激因素如免疫刺激等多种因素都可加重PCV2感染猪的病情,进而发展成临床症状和病理变化较明显的断奶后多系统衰竭综合征、皮炎和肾病综合征等与猪圆环病毒相关的疾病。PCV2的ORF2蛋白是目前已知惟一编码病毒结构蛋白-衣壳蛋白(Cap)的基因,PCV2的表型特异性特征很可能决定于ORF2编码的Cap蛋白。该蛋白可引起感染猪产生很高的抗体水平,因此是检测病毒抗体水平的良好抗原[3]。本试验利用分子手段将 PCV2的ORF2基因构建到真核载体中,从而利用昆虫细胞杆状病毒系统表达出此蛋白,进而制备抗体,可用于病原的检测及病毒的进一步研究。
Bac-to-Bac杆状病毒表达系统采用杆状病毒穿梭载体技术大大缩短了病毒纯化和鉴定的时间。阳性的重组杆状病毒感染Sf9昆虫细胞表达的ORF2蛋白进行了多种翻译后修饰,接近于天然的病毒编码蛋白,具有较高的生物学活性,而且杆状病毒具有高度的种属特异性,仅感染昆虫细胞,对脊椎动物细胞无感染性,其表达产物安全可靠,经简单处理即可用于后续试验。
为了获得较好的抗体,应选择体重在800 g左右,身体健康的雄性豚鼠,并要注意尽量减少对动物的刺激。我们采用腹股沟皮下注射的方法进行免疫,因注射点接近腹股沟淋巴结,易于激发免疫,从而制备出高价的血清抗体,以备后续试验的进行。
[1]Shang S B,Jin Y L,Jiang X T,et al.Fine mapping of antigenic epitopes on capsid proteins of porcine circovirus,and antigenic phenotype of porcine circovirus T ype 2[J].Mol Immunol,2009,46(3):327-334.
[2]王忠田,杨汉春,郭鑫.规模化猪场猪圆环病毒2型感染的流行病学调查[J].中国兽医杂志,2002,38(10):3-6.
[3]Liu Q,Tikoo S K,Babiuk L A.Nuclear location of the O RF2 protein encoded by po rcine circovirus type 2[J].Virol,2001,285(1):91-99.
[4]T ruong C,M ahe D,Blanchard P,et al.Identification of an immunorelevant ORF2 epitope from porcine circovirus type 2 as a serological marker for experimental and natural infection[J].Arch Virol,2001,146:1197-1211.
[5]Nawagitgul P,Harms P A,Morozov I,et al.Modified indirect porcine circovirus(PCV)type 2-based and recombinant capsid protein(ORF2)-based enzyme-linked immunosorbent assaya for detection of antibodiese to PCV[J].Clin Diagn Lab Immunol,2002,9:33-40.
[6]Blanchard P,M ahé D,Cariolet R,et al.An ORF2 proteinbased ELISA for porcine circovirus ty pe 2 antibodies in postweaning multisystemic wasting syndrome[J].Vet Microbiol,2003,94:183-194.
[7]Liu J,Chen I,Du Q,et al.T he ORF3 protein of porcine circovirus type 2 is involved in viral pathogenesis in vivo[J].J Virol,2006,80:5065-5073.
[8]Liu J,Zhu Y,Chen I,et al.The O RF3 protein of porcine circovirus ty pe 2 interacts with porcine ubiquitin E3 ligase Pirh2 and facilitates p53 expression in viral infection[J].J Virol,2007,81:9560-9567.
[9]M aeda S,Kawai T,Obinata M,et al.Production of human αinterferon in silkworm using a baculovirus vecto r[J].Nature,1985,315:592-594.
[10]刘长明,陆月华,张超范,等,猪圆环病毒2型重组Cap蛋白在昆虫杆状病毒中的表达[J].中国预防兽医学报,2005,27(6):479-482.
[11]樊惠英,陈焕春,佟铁铸,等.猪圆环病毒2型ORF2基因在昆虫细胞中的表达及其特性[J].生物工程学报,2005,21(6):975-978.
[12]T omoshi N,Satoko I,Eiko S,et al.High level expression and purification of bioactive bovine interleukin218 using a baculovirus sy stem[J].Vet Immunol Immunopathol,2002,87:65-72.

