1株鹅副黏病毒的生物学特性分析
张彦红,樊惠英,蔡绍鑫,罗开健,廖 明,任 涛
(华南农业大学兽医学院农业部动物疫病防控重点开放实验室,广东广州510642)
鹅副黏病毒病是由鹅副黏病毒(goose paramyxovirus,GPMV)引起的一种急性、烈性、高度接触性传染病。该病以肠道糠麸样溃疡,胰腺、脾脏肿胀且表面有大小不等的灰白色坏死灶为主要特征[1]。自1997年首次在国内被发现后[2],目前该病在山东、广西、安徽、浙江、上海、辽宁、云南和江苏等地区广泛流行[3],严重影响了我国养鹅业的发展。本研究拟对实验室保存的鹅副黏病毒61/GO/GD/05分离株进行生物学特性试验,以期全面认识、了解其特性,为禽副黏病毒的研究打下基础。
1 材料与方法
1.1 毒株 鹅副黏病毒61/GO/GD/05株、NDV阳性血清由华南农业大学兽医学院农业部动物疫病防控重点开放实验室提供。
1.2 实验动物 9~11日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;粤黄鸡苗购自华南农业大学种鸡场;1日龄清远鹅购自清远市博士鹅业有限公司。
1.3 试剂 T rizol LS Reagent购自 Invitrogen公司;Reverse T ranscriptase XL(AMV)、RNA酶抑制剂(PRI)、dNTPs、DNA Marker DL-2 000、Ex Taq聚合酶为宝生物工程(大连)有限公司产品。
1.4 病毒的增殖与传代 将61/GO/GD/05株尿囊液用灭菌生理盐水稀释1 000倍,尿囊腔接种9~11日龄SPF鸡胚5枚,0.2 mL/枚,37℃孵育72 h,逐日观察,期间弃去24 h以内死亡的鸡胚,最终无菌收集尿囊液,作为第1代尿囊液毒。如此反复传代至第3代,收集第3代尿囊液毒作为工作用种毒,-80℃保存备用。
1.5 鸡胚半数感染量(EID50)的测定 将61/GO/GD/05株尿囊液用灭菌生理盐水作连续10倍稀释(10-6~10-10),每个稀释度经尿囊腔接种8枚10日龄的SPF鸡胚,0.2 mL/枚,37℃孵育72 h,逐日观察,期间弃去24 h以内死亡的鸡胚,最终无菌采集尿囊液并测定其HA效价,以HA效价为4log2以上判为阳性。按照 Reed-Muench法计算 61/GO/GD/05分离株的EID50。
1.6 鸡胚最小致死量的平均死亡时间(MDT)的测定 参照OIE试验及判定标准进行[4],将61/GO/GD/05株尿囊液用灭菌生理盐水作连续10倍稀释(10-6~10-10),每个稀释度接种5个鸡胚,0.2 mL/枚,每天观察4次,连续观察7 d。记录每个鸡胚的死亡时间。
1.7 脑内致病指数(ICPI)的测定 参照OIE试验及判定标准进行[4],将61/GO/GD/05株尿囊液用灭菌生理盐水作10倍稀释后经脑内接种10只1日龄SPF雏鸡,每只接种0.05 mL,另设10只注射生理盐水,作为对照组,隔离饲养。接种后,每24 h观察发病及死亡情况并打分,连续观察8 d。
1.8 静脉致病指数(IVPI)的测定 参照OIE试验及判定标准进行[4],将61/GO/GD/05株尿囊液用灭菌生理盐水作10倍稀释后,接种10只6周龄的SPF鸡,每只静脉接种0.1 mL,另设10只注射生理盐水作为对照,隔离饲养,每24 h观察1次,连续观察10 d。根据发病和死亡情况,通过对每只鸡的记分(正常0分,患病1分,麻痹 2分,死亡 3分)计算IVPI。
1.9 对雏鸡、雏鹅的致病性试验 将61/GO/GD/05株尿囊液作10倍稀释后,通过腿部肌肉注射接种10只21日龄的非免疫鸡和鹅,0.2 mL/只。同时设生理盐水对照组10只。攻毒后观察15 d,记录发病及死亡情况。
1.10 对鹅半数致死量(LD50)的测定 将61/GO/GD/05株尿囊液用灭菌生理盐水作连续10倍稀释(10-0~10-5),每个稀释度分别经腿部肌肉注射接种10只14日龄NDV阴性的健康鹅,0.5 mL/只。另取10只为生理盐水对照组。攻毒后观察15 d,记录发病及死亡情况,采用Reed-Muench法计算出LD50。1.11 分子生物学特性
1.1 1.1 引物设计 参考GenBank上的APMV基因组序列,使用 DNAStar(Verison5.07)和 Primer Premier(Version5.0)软件设计扩增F基因的特异性引物,引物序列如下:P1:F-P1:5′-attat GGATCCATGGGCTCCAAACCTTCTACCAGGT TCC-3′(BamH Ⅰ ),F-P2:5′-attat GGATCC TCATGCTCCTGTAGTGGCTC-3′(BamH Ⅰ),预计扩增长度约为1 662 bp。
1.1 1.2 RNA提取及RT-PCR 用Trizol Reagent提取病毒RNA,将 RNA沉淀溶于15 μ L DEPC水中;然后参照 Reverse T ranscriptase XL(AMV)反转录酶使用说明书进行反转录。以反转录产物为模板,参照 Ex Taq聚合酶使用说明书进行 PCR,PCR产物参照快速纯化试剂盒说明书进行回收。
1.1 1.3 序列测定及遗传变异分析 对回收后的PCR产物进行测序,测序工作由上海英骏生物技术有限公司完成。应用DNAStar 5.07软件拼接测序后的核苷酸序列和推导的氨基酸序列。将GPMV 61/GO/GD/05分离株与国内外13株APMV-1参考株的F基因进行序列相似性分析,并按照Lmniczi等[5]建立的方法对61/GO/GD/05分离株进行基因分型。
2 结果
2.1 61/GO/GD/05分离株生物学特性的测定结果 见表1。

表1 61/G O/GD/05分离株生物学特性的测定结果
2.2 对雏鸡的致病性试验 攻毒后3 d,鸡只开始陆续发病,主要表现为精神沉郁、羽毛松散、闭眼昏睡、瘫卧在地、拉稀等症状。剖检死亡鸡,发现腺胃有出血点、胰腺坏死及肠道出血。鸡只的死亡率和发病率见表2。

表2 61/GO/GD/05分离株对鸡、鹅的致病性试验 (%)
2.3 对雏鹅的致病性试验 攻毒后第4天鹅开始发病,主要表现为精神沉郁,食欲减退。剖检病死鹅,可见食管、气管黏液增多,肠道出血,腺胃肌胃交界处轻微出血,脾脏肿大,胰腺肿大、坏死、出血(见图1)。在攻毒后第7天采咽喉拭子和泄殖腔拭子进行病毒分离。鹅的死亡率和发病率,见表2。

图1 61/GO/GD/05分离株对鹅致病性试验图谱
2.4 RT-PCR结果 对61/GO/GD/05分离株的病毒RNA进行了RT-PCR扩增,扩增片段与预期大小相符,电泳检测结果见图2。
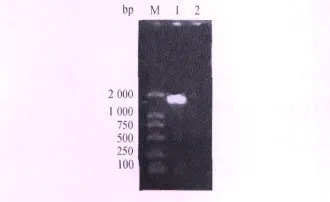
图2 F基因的PCR扩增
2.5 F基因序列分析及基因型 将GPMV 61/GO/GD/05分离株与GenBank上13株APMV毒株的F基因进行核苷酸序列相似性分析,发现61/GO/GD/05毒株与我国早期分离的GPMV SF02和ZJ1毒株相似性最高,分别为98.3%和98.0%,与Clone 30的相似性最低,为84.2%(图3);与F48E9毒株的相似性为86.6%。基因型分析表明,该毒株为基因Ⅶ型,为我国目前主要流行基因型。F蛋白的裂解位点的氨基酸组成为RRQKRF,符合GPMV强毒株裂解位点碱性氨基酸组成的特点。
3 讨论

本试验的GPMV 61/GO/GD/05分离株的MDT值为78 h,ICPI值为1.70,IVPI值为2.34。后两项指标显示其为强毒力株,而MDT的结果则显示其为中等毒力株。Gerganow等[5]也曾分离到一株NDV病毒,MDT值属于强毒力型,ICPI值属于中等毒力型,而IVPI值属于低毒力型,3个指标均不一致,最终该毒株毒力的判定以动物发病试验结果为依据。本研究中的致病性试验表明,61/GO/GD/05分离株对21日龄鸡的发病率为100%,死亡率为90%,对16日龄鹅的发病率为100%,死亡率为50%,表明该病毒对雏鸡、雏鹅均具有较强的致病性。
此外,研究已证实GPMV的F蛋白是决定禽副黏病毒毒力的主要决定因素[6-8]。对不同毒株F基因序列分析表明,毒力不同的毒株F基因序列不同,其差异主要表现在F基因裂解位点区域。强毒株在裂解位点的氨基酸序列为112R-R-Q-K/R-RF117,而弱毒株或无毒株在裂解位点的氨基酸序列为112G-R/K-Q-C-R-L117,而且这一结论已经通过反向遗传操作技术得到了证实。用此方法来鉴定NDV的强弱毒已经被世界动物卫生组织(OIE)采纳。本试验的GPMV 61/GO/GD/05分离株F蛋白裂解位点区(112-117)氨基酸的序列分析结果为RRQKRF,符合NDV强毒株的氨基酸序列特征。因此,综合以上研究结果,判定GPMV 61/GO/GD/05分离株为强毒株。
对不同毒株的F基因序列分析表明,61/GO/GD/05毒株与我国早期分离的GPMV SF02和ZJ1毒株相似性最高,分别为98.3%和98.0%,但与我国标准强毒F48E9株相似性仅为86.6%。虽然目前我国广泛使用鸡新城疫常规疫苗对鹅副黏病毒病进行预防和控制,但试验表明此类疫苗的免疫效果并不理想,说明鹅副黏病毒和LaSota株、F48E9株抗原性存在较大差异。
将GPMV 61/GO/GD/05分离株接种健康雏鹅能复制出与临床症状一致的临床症状和剖检病变。该病毒的分离鉴定再次证明水禽不再仅是禽1型副黏病毒的宿主和贮存库,而是已成为禽1型副黏病毒自然感染发病、死亡的易感禽类。分离的GPMV 61/GO/GD/05株既可引起鹅感染发病,又对鸡有强致病性,推测这可能与长期使用NDV疫苗,使得环境中免疫压力增强,导致型禽1副黏病毒发生变异及水禽(鸭、鹅)与陆禽(鸡)混养有关[9]。
[1]李洁,孙振州,栾爽艳.鹅副黏病毒病的研究进展[J].水禽世界,2006(6):55-58.
[2]辛朝安,任涛,罗开健,等.鹅副黏病毒感染诊断初报[J].养禽与禽病防治,1997,16(1):5-8.
[3]张倩,王志亮,单虎,等.鹅源新城疫的生物学特性分析[J].中国兽医学报,2006,26(6):6-9.
[4]Office International des Epizootes.Newcastle disease[EB/OL].http://www.oie.int.
[5]Lmniczi B,Wehmann E,Herczeg J,et al.Newcastle disease outbreaks in recent yearsin western Europe were Caused by an oid(Ĭ)and a novel genotype(Ï)[J].Arch Virol,1998,143:49-64.
[6]Bruce S,Mark G,Janice C,et al.Genomic sequences of lowvirulence avian paramyxovirus-1(Newcastle disease virus)isolates obtained from live-bird markets in North America not related to commonly utilized commercial vaccine strains[J].Veterinary Microbiology,2005,106:7-16.
[7]Scott J G,Jill T,Bradd C B,et al.Isolation of Avian Paramyxovirus 1 from a Patient with a Lethal Case of Pneumonia[J].Journal of Virology,2007,81(22):12709-12714.
[8]秦卓明,马保臣,贾强,等.一株基因H型新城疫强毒株的分子特性[J].微生物学报,2006,42(6):912-916.
[9]胡永强,单松华,何水林,等.鹅源副黏病毒 SF02株的生物学特性研究[J].上海农业学报,2004(2):109-113.

