苯丙哌林缓释胶囊人体生物等效性研究
陈 梅,郑 永,魏 来,邹品文
(重庆医科大学附属第二医院,重庆 400010)
磷酸苯丙哌林缓释胶囊为非麻醉性镇咳药,其镇咳作用是可待因的2~4倍,具有起效快、不抑制呼吸、维持时间长、毒副作用小等特点,主要用于治疗急性支气管炎及各种原因引起的咳嗽,对刺激性干咳效果最佳。经国家药品食品监督管理局批准(批准文号为2005L02961),受西南药业股份有限公司委托,我院临床药理基地实施了该公司研制的磷酸苯丙哌林缓释胶囊的人体生物等效性试验,以验证其生物等效性。现报道如下。
1 仪器与试药
Waters高效液相色谱仪,包括Waters 1525泵、Waters 2487紫外可变波长检测器、Waters Breeze工作站;WHX微型涡旋混合器(上海跃进机械厂);KL512J型氮吹仪(北京康林科技有限责任公司)。试验药物为西南药业股份有限公司研制的磷酸苯丙哌林缓释胶囊(40 mg/粒,批号为20050901);参比药物为湖北中佳药业有限公司生产的磷酸苯丙哌林缓释片(40 mg/片,批号为050101);乙腈(天津市四友生物医学技术有限公司,色谱纯);正庚烷(苏州工业园区正兴化工研究院),三乙胺及异丙醇(重庆川东化工〈集团〉有限公司化学试剂厂),磷酸二氢钾(重庆化学试剂厂),均为分析纯;磷酸苯丙哌林标准品(中国药品生物制品检定所,批号为0237-9701)。
2 方法与结果
2.1 受试者选择
选择18名男性健康志愿受试者,汉族,平均年龄(21.1±1.0)岁,平均身高(173.1±5.6)cm,平均体重(65.2 ±6.7)kg。试验前所有受试者经肝功能、肾功能、血压、心电图等检查均正常,受试前2周未用一切药物,受试期间禁烟、酒、茶、咖啡和剧烈体力活动;受试前均签署知情同意书并经医院伦理委员会讨论通过。
2.2 溶液配制
精密称取干燥至恒重的磷酸苯丙哌林标准品7.8 mg,用适量甲醇溶解,置25 mL量瓶中,加甲醇至刻度,即为312.0 μg/mL的磷酸苯丙哌林标准贮备液;精密称取干燥至恒重的安定标准品2.1 mg,用适量甲醇溶解,置50 mL量瓶中,加甲醇至刻度,即为42.0 μg/mL的安定内标贮备液。
2.3 给药方法及生物样本采集
将18名受试者随机分为2组,每组9名,禁食12 h后,于次日晨空腹口服80 mg磷酸苯丙哌林受试药物或参比药物,均用200 mL温开水服下。于给药前及给药后 0.5,1.0,2.0,3.0,4.0,5.0,6.0,8.0,10.0,12.0,24.0,36.0,48.0 h 时抽取前臂静脉血 3 mL,5 000 r/min离心5 min后分离血浆,将血浆样本于低温(-20℃)保存,待测。间隔2周后交换服用另一种药物,再按上法采集、分离、保存血浆样本。
2.4 血药浓度测定
2.4.1 色谱条件及色谱行为
色谱柱:Phenomenex® Gemini C18柱(150 mm ×4.6 mm,5μm),固定进样环20 μL;流动相:乙腈-0.05 mol/L磷酸二氢钾-5%磷酸 - 三乙胺(125 ∶175 ∶10 ∶0.1)[1-3];流速:1.0 mL/min;紫外检测波长:210 nm;柱温:25℃。在拟订的色谱条件下,色谱图见图1。可见苯丙哌林、安定与血中内源性杂峰分离良好,峰形尖锐,杂质和代谢物不干扰药物的测定。
2.4.2 样品处理
精密吸取受试者血浆1.0 mL,精密加入质量浓度为4.2 μg/mL的安定内标液 50 μL,加入 2 mol/L 的 NaOH 0.2 mL,旋摇 30 s,再加入3 mL提取液[正庚烷 -异丙醇(95∶5),V/V],涡旋震荡1 min,5 000 r/min离心1 min,吸取上层有机层,置尖底试管,70℃水浴氮气吹干,残渣用50 μL流动相复溶,取复溶液20 μL进样。
2.4.3 方法学考察

标准曲线制备:在空白血浆中加入质量浓度为31.2 μg/mL的苯丙哌林标准溶液,使血药浓度分别为461.08,230.54,115.27,57.64,28.82,14.41 ng/mL,按 2.4.2 项下操作测定,记录色谱图、样品峰面积。以苯丙哌林峰面积 A1与安定内标峰面积 A2的比值 I对苯丙哌林血药浓度 C进行回归分析,得标准曲线方程为 C=10.883+323.551I,r=0.997 2(n=6),线性范围为 461.08~14.41 ng/mL ,最低检测质量浓度为7.71 ng/mL。
回收率试验:在空白血浆中加入质量浓度为31.2 μg/mL的苯丙哌林标准溶液,配制高、中、低质量浓度的标准血样,使血样的苯丙哌林质量浓度分别为461.08,115.27,14.41 ng/mL。按2.4.2项下操作测定,由标准曲线计算出血样中苯丙哌林的药物质量浓度,将求得的质量浓度与已知血药浓度相比,计算方法回收率,连续测定5次。结果见表1。
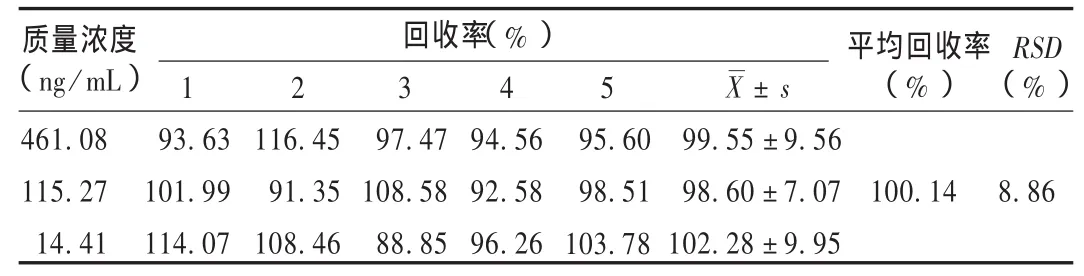
表1 回收率试验结果
精密度试验:取回收率试验项下高、中、低质量浓度的3种溶液,按2.4.2项下操作测定,日内测定5次,并连续测定5 d。结果高(461.08 ng/mL)、中(115.27 ng/mL)、低(14.41 ng/mL)质量浓度的日内精密度 RSD分别为6.47%,4.89%,6.07%(n=5),日间精密度 RSD分别为7.93%,8.36%,3.06%(n=5)。
稳定性试验:将质量浓度为115.27 ng/mL的标准血样于常温放置8 h,按2.4.2项下操作测定,结果0,8 h时的血药浓度分别为(119.67±18.21)ng/mL 和(117.77±8.89)ng/mL。将质量浓度为115.27 ng/mL的标准血样放置于-20℃冰箱中保存,于0,7,14 d时取出血样,常温下融冻后,依法测定血药浓度,血样测定完后放回冰箱保存,下次融冻再测浓度,结果7 d和14 d时的血药浓度分别为(121.98±13.26)ng/mL 和(116.47±10.92)ng/mL。以上结果表明,血样在常温下放置8 h、-20℃冰箱保存14 d均稳定。
2.5 药-时数据及药代动力学参数
18名健康男性受试者交叉服用80 mg的苯丙哌林受试药物及参比药物后,每位受试者的血药浓度-时间数据采用微机3P97程序自动拟合,参考实测值与理论值的相关系数(R2)、最大绝对误差和相对误差、曲线拟合优度及 AIC等指标选择模型。结果表明,口服苯丙哌林缓释片或胶囊后,药-时数据符合一室药代动力学模型,平均血药浓度药 -时曲线见图2,有关药代动力学参数及生物利用度见表2。


表2 样品人体药代动力学参数(X ± s,n=18)
2.6 生物等效性分析
AUC0-48未经对数转换方差分析结果显示,两药间无显著性差异( P > 0.05),双单侧 t检验结果,t1=2.826≥ t1α=1.746,t2=3.363≥t1α=1.746(等效),90% 置信区间为 87.0% ~ 109.5% ;经对数转换方差分析结果显示,两药间无显著性差异(P>0.05),双单侧 t检验结果,t1=3.159,t2=3.897(等效),90%置信区间为87.5%~109.1%。Cmax未经对数转换方差分析结果显示,两药间无显著性差异(P>0.05),双单侧 t检验结果,t1=9.500,t2=13.631(等效),90%置信区间为93.5% ~104.0%;经对数转换方差分析结果显示,两药间无显著性差异( P>0.05);双单侧 t检验结果,t1=9.449,t2=9.594(等效),90%置信区间为 93.5% ~106.5%。对实测的受试药物与参比药物的 Tmax用非参数统计Wilcoxo法进行检验,两药间无显著性差异。
3 讨论
采用高效液相色谱法测定人体血浆中苯丙哌林质量浓度,方法简便、灵敏、可靠,能够满足磷酸苯丙哌林缓释胶囊人体药代动力学和生物利用度研究需要。通过对两种缓释制剂的主要药代动力学参数进行统计学分析,显示两制剂间无显著性差异,两种制剂生物利用度相当,即两制剂生物等效。
[1]杨秀娟,杨秀云.高效液相色谱法测定磷酸苯丙哌林片的含量[J].色谱,2000,11(6):566-567.
[2]王本杰,郭瑞臣,李朝武,等.磷酸苯丙哌林缓释片人体生物利用度试验[J]. 中国药房,2001,11(12):671-673.
[3]杜宗敏,张逸凡,钟大放,等.磷酸苯丙哌林人体药代动力学及其制剂的相对生物利用度研究[J].中国临床药理学杂志,2000,16(5):209-213.

