奥曲肽+奥美拉唑预防肝癌围介入手术期上消化道出血的疗效观察
杨小强 肖春泽 周明 王秀兰 胡宜莲 孟晓玲
急性上消化道出血是肝癌介入治疗的严重并发症之一,占肝癌介入治疗期并发症的15%以上,再出血率达60%以上。且多发生于TACE术后24小时以内[9]。国内虽有报道,但对其病因及发病机制说法不一[1-2]。原发性肝癌合并肝硬化、门静脉高压症的比例很高,有报道称达到87.5%。肝癌患者约有15~28%死于门静脉高压食管静脉曲张破裂出血。因此TACE治疗前预防则成为围手术期治疗的关键之一。本人于2007~9至今共对52例肝癌合并门静脉高压患者,用奥曲肽+奥美拉唑给予预防性治疗,取得满意疗效,现报道如下:
1 材料和方法
1.1 病例选择 男性32例,女20例,年龄38-73岁,经超声,CT,MRI,AFP诊断为原发性肝癌,肝硬化,门静脉高压。其中8例有肝活检证实为HCC。9例既往发生过上消化道出血,2例进行过脾切除,13例存在门静脉主干或左右分支癌栓。肝功能childB级28例,childC级24例。32例影像学(CT或MRI)有明显的食管静脉曲张。随机分为两组。治疗组26例,对照组26例。
1.2 方法 两组患者均给予常规介入治疗,具体如下:用seldinger技术穿刺股动脉,插管至肝固有动脉或肝左、肝右动脉,5~FU500~1000mg,顺铂40~80mg灌注,再超选择插管到肝段肿瘤供应血管,予丝裂霉素10~20mg或吡柔比星20~50mg+碘化油制成混悬液栓塞。治疗组:术前3天给予奥曲肽0.1mgivq8h;奥美拉唑40mgivbid。术后继续使用三天。对照组患者给予心得安10mgpotid。
1.3 疗效判定 介入术后观察血压、心率、血红蛋白、红细胞压积、粪潜血等。粪潜血阴性为显效。出现粪潜血阳性,但未出现呕血及肉眼黑粪,为有效。出现呕血、肉眼黑粪、为无效。以显效和有效例数的百分比为总有效率。
1.4 结果 治疗组介入术后均未发生上消化道大出血。对照组呕血2例,黑粪2例。存在明显差异。
2 讨论
肝癌围介入治疗期常会遇到致命性消化道出血,死亡率很高,占肝癌介入治疗期并发症的15%以上,再出血率达60%以上。其主要原因国内报道很多,但发病机制说法不一,可总结为如下几点:①原发病因素,我国原发性肝癌超过80%由慢性肝炎致肝细胞的反复损伤、增生发展为肝硬化结节恶变而来[16]。慢性肝炎后肝硬化引起的门静脉高压和肝癌肿块向周围侵犯肝血窦,形成病灶高压区或门静脉瘤栓等均可使门静脉回流受阻,这是肝癌并发消化道出血的基础。②化疗药物引起的剧烈呕吐使食管贲门黏膜撕裂或食管胃底静脉破裂而出血。但随着抗5-羟色胺受体药物的临床应用,化疗药物很少能再引起剧烈呕吐[4-5]。③化疗药引起急性溃疡或应激性溃疡而出血;④医源性因素,近年来肝癌介入的药物和栓塞材料对肝细胞的损伤,使肝硬化进一步加剧。碘油用量的增加,使碘油进入门静脉分支阻碍门静脉血流引起门静脉压进一步升高,使食管胃底静脉破裂出血。中村仁信等[6-7]认为,肝动脉和门静脉之间在肝血窦和周围血管网处有交通支,但在血管造影和少量注入碘油时,该交通支并不开放。当较大量碘油充满肝血窦时回引起肝内微循环的改变,使碘油经过交通支反流入门静脉。陈永德等[8]通过动物实验证实,经肝动脉灌注少量碘化油(2ml以内),门静脉压力无显著变化,随着碘油量的增加,门静脉压力可不断增加,碘油进入门静脉的量、门静脉压力与注入肝动脉内碘油量成正比。⑤肝癌并A-PVS时,动脉注入的碘油可经A-PVS进入门脉,升高或加重门静脉高压,致使食管下端及胃底曲张静脉破裂出血[1-3]。⑥血中某些活性因子(胰高血糖素、一氧化氮、胃泌素、血管内皮生长因子等[15])的间接作用,特别是介入治疗后肝功能的损伤引起这些因子代谢紊乱以及胃肠功能的紊乱和障碍,是上消化道出血的诱因。这些因子对肝内外血管系统不同部位的血管床和括约肌有不同的作用,可增加肝癌患者门静脉阻力至门静脉压升高并发消化道出血。此外,血管内皮生长因子能促使肝癌细胞株生长增殖,特别是介入治疗后肝内处于乏氧状态下促使血管新生[10]。
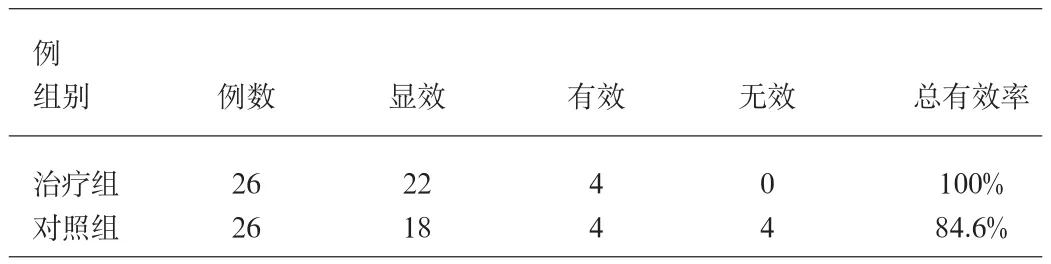
表1 两组患者比较
本组病例的详尽分析并复习文献,笔者认为门静脉高压致食管胃底静脉破裂和化疗药引起急性溃疡或应激性溃疡,是肝癌合并门静脉高压患者围介入治疗期急性上消化道大出血的主要原因。鉴于此我们考虑使用奥曲肽+奥美拉唑来预防肝癌介入术后急性上消化道大出血。奥曲肽止血的作用有三方面[11-13]:第一方面,降低门静脉压力:①直接作用内脏血管平滑肌和消化系脏器管道括约肌,能有效降低门静脉压和收缩消化器官血管丛,降低局部循环压力,从而止血;②抑制肿瘤血管的生成,降低门静脉血流。第二方面,抑制消化激素分泌,同时还有抑酸,抑制消化蛋白酶释放等作用,能显著减少内脏血流,减少胃肠道蠕动及介入术后综合征,从而起到控制消化道出血的作用。第三方面,对原发病的治疗:①奥曲肽能抑制各类生长因子基因的表达和结合,降低肿瘤局部循环中生长因子浓度,阻断肿瘤细胞与生长因子间的信息传递达到抑制肿瘤细胞的生长,阻止并发症的发生[14];②刺激免疫增殖提高免疫监视功能[15],诱导肿瘤细胞凋亡是遏制原发病防治并发症的根本所在。肝癌围介入治疗期消化道出血的患者发病原因不同、复杂,奥曲肽+奥美拉唑的药理性质能针对肝癌围介入治疗期的各种诱发消化道出血的病因起到止血作用。
通过观察,我们认为奥曲肽+奥美拉唑在预防肝癌围介入治疗期急性上消化道大出血疗效确切,不良反应少。但能否作为肝癌围介入期的常规治疗有待临床进一步探讨。
[1]张维娥,贾雨辰,杨甲梅,等.动脉插管化疗与栓塞治疗肝癌的少见并发症及防治[J].中华放射学杂志,1992,26:(10)776-777.
[2]王建华,颜志平,王小林,等.肝癌介入治疗若干问题探讨[J].介入放射学杂志,1996,5(1):3-6.
[3]李平,黎海亮,刘海泉,等.肝癌介入治疗后并发急性上消化道大出血的原因分析及处理[J].放射学实践,2001,16(2):84-85.
[4]Morrow GR,Hickok JT,Rosenthal SN,et al.Progress in rebucing nausea and emesis:comparisons of ondansetron,granisetron,tropisetron[J].Cancer,1995.76(3):343-357.
[5]张频,孙燕,张弘刚,等.呕必亭预防化疗所致呕吐的临床效果[J].中华肿瘤杂志,1996,18(2):154-156.
[6]Nakamura H,Hashimoto T,Oi H,et al.Lodized oil in portal vein after artery embolization[J].Radiology,1988,167(2):415-417.
[7]Nakamura H,Hashimoto T,Oi H,et al.Treatment of hepatocellurlar carcinoma by segmental hepatic artery injection of adriamycin in oil emulsion with overflow to segmental portal vein[J].Acta Radiol,1990,31(2):347-249.
[8]程永德,张正国,詹迎江,等.肝脾动脉双栓塞的实验研究[J].介入放射学杂志,1996,5(1):33-35.
[9]马新明,王敬忠.肝癌介入治疗后并发急性上消化道出血的原因分析及治疗措施[J].实用医学影像杂志,2004,5(1):47-51.
[10]刘青光,宋涛,孙昊,等.奥曲肽对人肝癌细胞株MHCC97-H的影响[J].西安交通大学学报,2007,28(2):190-192.
[11]LUDWIG D,SCHADEF S,BRUNING A,et al.48-hour hemodynamic effects of octerotide on postpranclial splanchnic hyperemia in patients with liver cirrhosis and portal hypertension:double-blind,placebocontrolled study[J].Did Dis Sci,2000,45(9):1019-1027.
[12]HUANG HC,LEE FY,CHAN CC,et al.Effects of soniatostation and octrotide on portal-systemic colllaterals in portal hypertensive rate[J].Hepatol,2002,36(2):163-168.
[13]姜立,薛新波,申铭.奥曲肽治疗急性肿瘤性下消化道出血22例[J].医药导报,2006,25(12):1284-1285.
[14]代金武,喻琳,罗芳,原发性肝癌生长抑素受体mRNA表达的研究[J].中华普通外科杂志,2003,18(1):54—56.
[15]申全,杨维舒.奥曲肽对肝动脉栓塞治疗大鼠肝癌影响的实验研究[J].中国介入影像与治疗学,2005,2(2):136—139.
[16]BOSCH J,BRUIX J,WAS A,et a1.Rolling review:the tretment of major complications of cirrhosis[J].Aliment Pharmacol Ther,1994,8(6):639.
[17]张孟增,张金山.介入放射学基础与临床[M].北京:中国科学技术出版社,2001:106,205.

