三种药物对PRRSV的体外抑制试验*
王爱萍,占松鹤,朱良强*,祁克宗,姚雪静
(1.安徽农业大学动物科技学院,安徽合肥 230036;2.安徽省动物疫病预防与控制中心,安徽合肥 230036)
三种药物对PRRSV的体外抑制试验*
王爱萍1,占松鹤2,朱良强2*,祁克宗1,姚雪静1
(1.安徽农业大学动物科技学院,安徽合肥 230036;2.安徽省动物疫病预防与控制中心,安徽合肥 230036)
选取干扰素、黄芪多糖、利巴韦林作为抗病毒药物,利用MTT法与细胞病变(CPE)抑制试验,通过PRRSV感染Marc-145细胞、病毒在细胞中复制、药物直接和病毒作用三个环节,对药物的作用效果进行评价。结果显示,3种药物体外对PRRSV的都具有抑制作用,干扰素、黄芪多糖体外对PRRSV具有明显的阻断作用,利巴韦林体外对PRRSV具有杀灭作用。因此,这3种药物在细胞水平上均有抑制病毒的作用,为防控PRRS提供了理论依据。
干扰素;黄芪多糖;利巴韦林;猪繁殖与呼吸综合征
猪繁殖与呼吸综合征(Porcine reproductive and respiration syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种急性接触性传染病,主要引起妊娠母猪的繁殖障碍以及仔猪的呼吸道症状[1-2]。1996年,郭宝清在国内首次分离到PRRSV,目前该病在我国广泛存在,已成为危害养猪业的重要病毒性疾病之一[3-4]。目前对该病的防控主要是采用接种疫苗的方法。但由于PRRSV存在高度的变异性,有时一个猪场同时存在两种不同的病毒变异株,给该病的免疫与防控带来了一系列的问题。又由于参与PRRS免疫保护的不仅有体液免疫,还有细胞免疫,因此用灭活疫苗免疫防制PRRS效果不佳,弱毒疫苗可以诱导机体产生全面的免疫应答,提高了针对PRRSV的免疫保护水平,但用弱毒疫苗存在毒力返强的风险,这一点已在几年前丹麦等国因广泛使用弱毒苗而导致该病大暴发中得以证实。因此,抗病毒药物则成为紧急预防和治疗该病的主要手段之一。
利巴韦林、干扰素、黄芪多糖是临床上常用的抗病毒药物。黄芪多糖能促进机体产生抗病毒干扰素,抑制病毒蛋白的合成,从而使机体产生抗病毒感染作用[5-6]。而干扰素具有广谱抗病毒活性,且具有速效多能的特点[7]。利巴韦林为临床上常用的广谱抗病毒药物。本试验选取这3种药物,以安徽部分地区发病猪体内分离到的PRRSV为受试病毒,观察药物对该病毒的体外抑制作用。
1 材料与方法
1.1 材料
1.1.1 药物 黄芪多糖(105μ g/mL)由本实验室配制;利巴韦林(105μ g/mL),江苏涟水制药有限公司产品,生产批号:0812162;猪基因工程干扰素(106IU/mL),大连三仪动物药品公司产品,生产批号:08082502。
1.1.2 病毒与细胞 PRRSV、Marc-145细胞由安徽省动物疫病预防与控制中心提供。
1.1.3 主要试剂与仪器 DMEM培养基为Gibco公司产品,胎牛血清为杭州四季青工程有限公司产品,胰蛋白酶为AM2RESCO公司产品,EDTA为国药集团化学试剂有限公司产品,青霉素(80万单位)、链霉素(80万单位)为华北制药有限公司产品,噻唑蓝、二甲基亚砜(DMSO)为上海杰美基因医药科技有限公司产品,CO2细胞培养箱为Kendro仪器公司产品,2级生物安全柜为ESCO科技有限公司产品,倒置显微镜为日本尼康公司产品,酶标仪为TECAN公司产品。
1.2 方法
1.2.1 黄芪多糖的提取 将黄芪根(粉末)加入到5倍~8倍量蒸馏水中,在68℃下浸取3 h,过滤得提取液。将提取液冷至室温后,倾入2倍体积的950 mL/L酒精,离心分离,得到黄芪多糖,再用950 mL/L酒精洗涤,然后干燥;将干燥物溶于10倍量的蒸馏水中,加热到100℃,保持5 min~8 min,冷却后,过滤除去沉淀,用AB-8吸附树脂对滤液脱色,得透明液体,然后重复上述醇沉过程,得到纯化的黄芪多糖。然后取黄芪多糖0.1 g,溶于1 mL细胞维持液中,过滤除菌,4℃保存备用。
1.2.2 PRRSV毒力的测定 常规方法消化Marc-145细胞[8],用生长液将细胞浓度调成1×106个/mL,接种到 96孔细胞培养板,100 μ L/孔,在37℃、体积分数为5%的CO2条件下培养形成细胞单层,接种稀释度分别为10-1~10-10的病毒液,每个稀释度8孔,100 μ L/孔,同时设不加病毒的正常细胞对照,连续观察7 d记录细胞病变。按照Reed-Muench法计算 TCID50。
1.2.3 药物的毒性测定 在96孔培养板上进行,用维持液将药物作连续2倍稀释,分别接种到长成良好的单层细胞中,每个稀释浓度接种5孔,同时设正常细胞对照。在37℃体积分数为5%的CO2条件下培养120 h,每日观察CPE情况。3种药物的稀释浓度见表1。
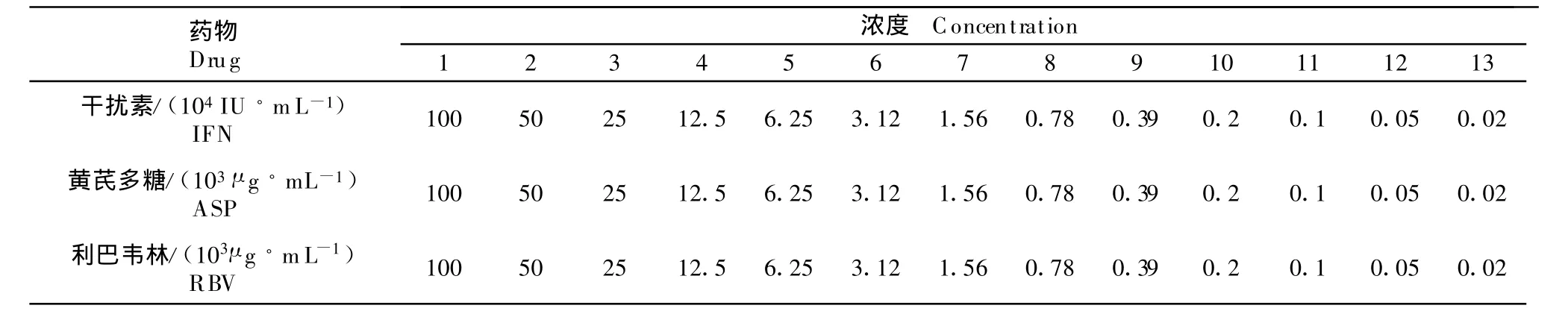
表1 干扰素、黄芪多糖、利巴韦林稀释浓度Table 1 Diluted concentrations of IFN,ASP,RBV
1.2.4 药物对 PRRSV的抑制作用测定 将100TCID50病毒液接种至长成单层Marc-145的96孔细胞培养板上,0.1 mL/孔,37℃吸附1 h,弃去病毒液,用 PBS洗 2遍,加入倍比稀释的药物,0.1 mL/孔,每个稀释度重复5孔。在37℃、体积分数为5%的CO2培养箱中培养,每天观察CPE,72 h测定 Marc-145细胞活力。同时制定CPE判定标准:记录“-”为正常细胞,“+”为25%以上的细胞出现CPE,“++”为 50%以上的细胞出现 CPE。“+++”为75%以上细胞出现CPE。
1.2.5 药物在Marc-145细胞上对PRRSV的阻断作用测定 以不同浓度的药液加入细胞层,于37℃培养4 h,然后弃去药液,用PBS洗2遍,每孔接种100TCID50病毒液0.1 mL/孔,在37 ℃、体积分数为5%的CO2培养箱中培养,记录方法和测定方法同上。
1.2.6 药物对PRRSV的直接杀灭作用测定 将不同稀释度的药液分别与等体积100TCID50病毒液混合,37℃作用2 h,加至长成单层Marc-145的96孔细胞培养板上,0.1 mL/孔,每个稀释度重复5孔。在37℃、体积分数为5%的CO2培养箱中培养,记录方法和测定方法同上。
以上试验均在药物的最大无毒浓度下进行,并设置正常细胞对照组,病毒感染对照组,按常规条件培养。
1.2.7 Marc-145 细胞活力测定 应用MT T比色法细胞增殖定量检测细胞活力。先加入 10 μ L MTT溶液,2 h后弃掉溶液,然后每孔加入100 μ L DMSO溶解结晶,15 min后置微孔板振荡器上振荡;最后在酶标仪上测定570 nm波长处的OD值,并作为细胞活性指标;采用SPSS13.0软件对数据进行分析,比较药物各剂量组的OD值与病毒对照组OD值之间的差别以评价药物的抗病毒作用。
2 结果
2.1 PRRSV在Marc-145细胞上的毒力测定结果
Marc-145传代细胞加入96孔板,24 h后可长成致密的单层,正常细胞呈三角形、多角形、等多种形态,细胞轮廓清晰。接种PRRSV 72 h~96 h后,细胞多角形轮廓逐渐失去棱角,细胞脱落、变圆、团缩、聚集成堆。按 Reed-muench法计算距离比得出PRRSV TCID50结果为106.25TCID50/mL。
2.2 药物毒性测定结果
试验结果显示,干扰素对Marc-145细胞最大无毒浓度为6.25×104U/mL,黄芪多糖和利巴韦林分别为1.25×103μ g/mL 和3.12×103μ g/mL。
2.3 药物对PRRSV的抑制作用的测定结果
试验结果表明,干扰素、黄芪多糖、利巴韦林对PRRSV在Marc-145细胞上的增殖具有明显的抑制作用,3种药物分别在0.39×104U/mL、1.56×103μ g/mL、0.39×103μ g/mL浓度时具有极显著的抑制CPE作用(P<0.01),其中干扰素对PRRSV引起的CPE最小抑制浓度为0.2×103U/mL,利巴韦林的最小抑制浓度为 0.2×103μ g/mL(表2)。

表2 IFN、APS、RBV在Marc-145细胞上对PRRSV的抑制作用结果Table 2 The inhibitory activity of IFN,ASP and RBV on M arc-145 infected with PRRSV
2.4 药物在Marc-145细胞上对PRRSV的阻断作用
由表3可知,干扰素、黄芪多糖分别在0.39×104U/mL、1.56×103μ g/mL 时阻止病毒侵入的作用极显著(P<0.01)。利巴韦林在3.125、1.56×103μ g/mL时 OD值显著大于病毒对照组(P<0.05),其他浓度差异不显著。

表3 IFN、APS、RBV在Marc-145细胞对PRRSV的阻断作用结果Table 3 The blocking activity of IFN,APS and RBV on Marc-145 infected with by PRRSV
2.5 药物对PRRSV的直接杀灭作用
由表4可以看出,干扰素、利巴韦林分别在0.78×103U/mL、0.39×103μ g/mL时OD 值均极显著大于病毒对照组(P<0.01)。黄芪多糖在12.5×103μ g/mL较高浓度时,OD值显著大于病毒对照组(P<0.05),其他浓度对病毒直接杀灭作用不显著。
3 讨论
关于药物抗病毒作用的机理,一般认为是多途径的,但主要有两条途径,一是抑制病毒的繁殖,二是直接杀灭病毒。本试验按不同的给药途径设计了3组试验,第1组先接种病毒后加药物,目的是观察药物能否对细胞内的病毒起作用,抑制其生物合成及成熟释放;第2组先加药物后接种病毒,目的是观察药物能否进入细胞或吸附细胞表面以阻止病毒的吸附和进入;第3组药物和病毒感作后同时加入,目的是观察药物对病毒的直接杀灭作用[9]。
试验测定了最大安全浓度范围内的3种药物对PRRSV的敏感性。结果显示病毒在细胞内复制时,黄芪多糖、干扰素、利巴韦林分别有4、5、4个浓度的药物组OD值极显著大于病毒对照组(P<0.01),表明这3种药物有较强的抑制病毒复制作用。病毒在PRRSV侵入 Marc-145细胞时,结果显示干扰素、黄芪多糖分别有5、4个浓度的药物组OD值极显著大于病毒对照组(P<0.01),表明这2种药物有较强的抗病毒侵入细胞的作用。干扰素、利巴韦林分别在4、4个梯度是药物组的OD值极显著大于病毒组OD值,说明这两种药物对病毒直接杀灭作用明显。且各种药物的抗病毒效果均呈现一定的量效关系,药物必须有合适的剂量才能发挥最佳药效。在进行药物体外抗病毒的研究过程中,最为常用的方法是CPE法[10]。在显微镜下观察病毒引起的细胞病变,但此法主观性强,且不能进行精确的定量分析。MT T分析法是使用MT T[(4,52二甲基噻唑)2,52二苯基四唑溴化物]对细胞进行染色,通过检测其光密度(OD值)的改变可判断细胞的活性,了解药物作用,从而进行药效的定量分析。邵文爱等[11]对MT T法和CPE法进行了比较,发现用
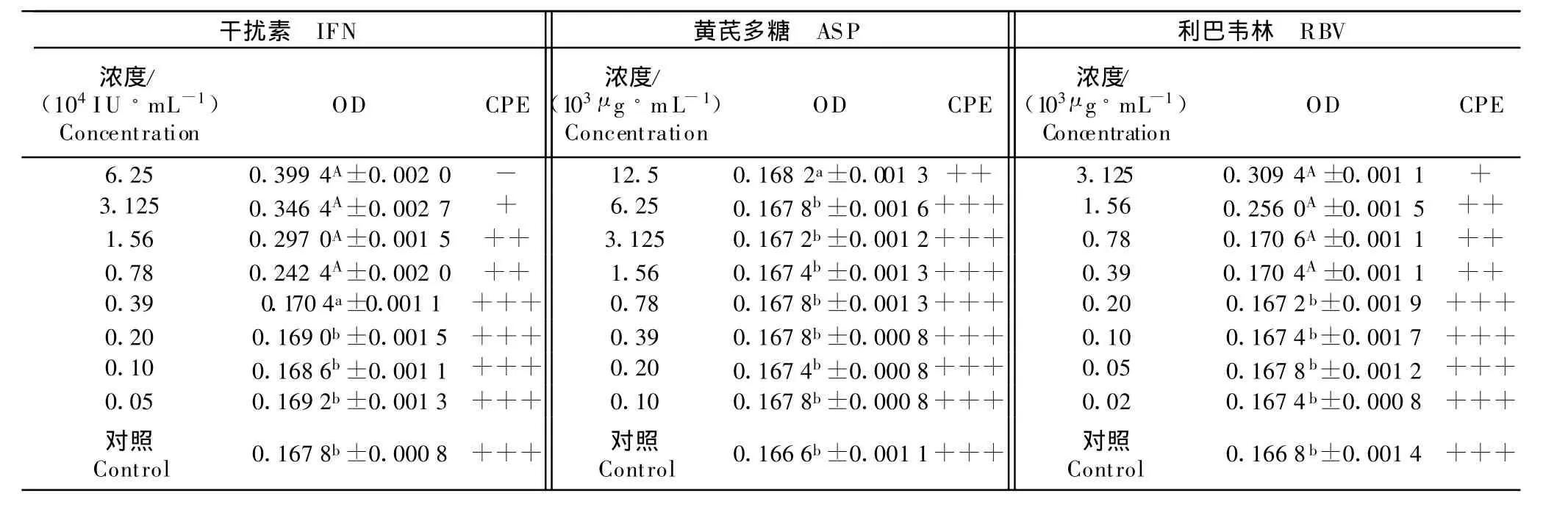
表4 IFN、APS、RBV对PRRSV的直接杀灭作用结果Table 4 The direct killing activity of the IFN,APS and RBV on P RRSVin vitro
CPE法判断细胞完全病变的稀释度,用MT T法却测定出还有细胞成活,证明MT T法能较敏感的检测出轻微的细胞病变,是一种快速客观准确的筛选和评价抗病毒药物的方法。MT T法与CPE法相结合可定量、精确地评估药物抗病毒的活性。
[1]HallW V.Porcine reproductive and respiratory syndrome(PRRS)virus-a significant disease of pigs[J].Aust Vet J,2005,83(5):260-261.
[2]Prieto C,Castro J M.Porcine reproductive and respiratory syndrome virus infection in the boara review[J].Theriogenology,2005,63(1):1-16.
[3]Keffaber K K.Reproductive failure of unknown etiology[J].Am Assoc Swine PractNewsl,1989(1):1-10.
[4]郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离P RRSV的研究[J].中国畜禽传染病,1996(2):1-4.
[5]Liu J,Henkel T.T raditional Chinese medicine(TCM)are polyphenols and saponins the key ingredients triggering biological activities[J].Curr Med Chem,2002,9(15):1483-1485.
[6]Kong X,Hu Y,Rui R,et al.Effects of Chinese herbal medicinal ingredients on peripheral lymphocyte proliferation and serum antibody titer after vaccination in chicken[J].Int Immunopharmacol,2004,4(7):975-982.
[7]崔保安,陈红英,张素梅,等.猪干扰素在大肠杆菌中的表达及抗病毒活性的检测[J].西北农林科技大学学报,2008,36(4):42.
[8]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:329-330.
[9]司书毅,张月琴.药物筛选-方法与实践[M].北京:化学工业出版社,2007:256-260.
[10]刘 钊,杨占秋,肖 红,等.MT T法在抗病毒药物筛选中的应用[J].武汉大学学报:医学版,2004,25(3):333.
[11]邵文爱,张丽媛,李康生,等.抗病毒药物筛选中两种方法的比较[J].汕头大学医学院学报,2006,19(1):52.
Inhibitive Effects of APS,RBV and IFN on PRRSVin vitro
WANGA Ai-ping1,ZHAN Song-he2,ZH U Liang-qiang1,QI Ke-zong1,YAO Xue-jing1
(1.College of Animal Science and Technology,Anhui Agricultural University,He fei,Anhui,230036,China;2.Anhui Animal Epidemic Disease Prevention and Control Center,He fei,Anhui,230036,China)
APS,RBV and IFN were adopted as antiviral drugs to evaluate the inhibitive effects to porcine respiratoryand reproductive syndrome virus(PRRSV)in vitroby the MT T and CPE assay through virus invading and replicating in Mark-145 cells,and the effect of direct inactiving virus.The results indicated that the three drugs had obviously inhibitive effect on the virusin vitro.IFN,APS had obviously blocking effect on PRRSVin vitro;RBV had obvious direct killing virus role.So IFN,APS and RBV could inhibit the replication of virus at cell level.This can provid seientific theory for PRRS control.
interferon(IFN);Astragaluspolysaccharide(ASP);ribavirin(RBV);PRRSV
S852.659.6;S859.7
A
1007-5038(2010)03-0060-04
2009-09-27
安徽省科技攻关项目(08010302150)
王爱萍(1983-),女,山东单县人,硕士研究生,主要从事动物疫病生物防控研究。*通讯作者

