细胞松弛素B对玻璃化冷冻牛卵母细胞的影响*
郭 娟,王志琴,赵云程,林嘉鹏,黄俊成*
(1.新疆畜牧科学院农业部家畜繁育生物技术重点开放实验室,新疆乌鲁木齐 830000;2.新疆农业大学动医学院,新疆乌鲁木齐 830052)
细胞松弛素B对玻璃化冷冻牛卵母细胞的影响*
郭 娟1,2,王志琴2,赵云程1,林嘉鹏1,黄俊成1*
(1.新疆畜牧科学院农业部家畜繁育生物技术重点开放实验室,新疆乌鲁木齐 830000;2.新疆农业大学动医学院,新疆乌鲁木齐 830052)
用不同浓度细胞松弛素B(CB)预处理体外成熟牛卵母细胞,以固体表面玻璃化(SSV)法冷冻解冻后的存活率和孤雌激活发育能力作为评价指标,探讨CB对体外成熟牛卵母细胞冷冻保存的影响。结果显示,存活率方面,各浓度CB处理组与对照组无显著差异(P>0.05);激活后卵裂率方面,20 μ g/mL CB处理组显著高于对照组(47.67%和30.25%,P<0.05);囊胚率方面,20 μ g/mL CB处理组极显著高于对照组(9.00%和1.75%,P≤0.01),同时还显著高于其他4个处理组(P<0.05)。研究表明,CB在玻璃化冷冻过程中的保护作用存在一定浓度的依赖性,其中用20 μ g/mL CB浓度处理最适于牛成熟卵母细胞玻璃化冷冻效果的改善。
卵母细胞;玻璃化冷冻;牛;细胞松弛素B
随着胚胎工程技术逐步应用于家畜繁殖和育种领域并形成产业化,卵母细胞的来源是制约其发展的重要因素,卵母细胞超低温冷冻保存则是把这些技术发展到应用阶段不可缺少的一个重要技术手段。
自1985年Rall W F等[1]首次应用玻璃化法对小鼠胚胎冷冻保存成功以来,由于其比传统程序化冷冻方法具有无需仪器设备、操作简便省时、适用范围广和冷冻效果好等优点,便很快应用于卵母细胞冷冻保存的研究中。但高浓度的玻璃化液也会对卵母细胞造成严重损伤,影响冷冻效果,于是人们通过寻找容易实现玻璃化并且对卵母细胞损伤较小的玻璃化液,以及大幅度提高冷冻速率而进一步减少冷冻对卵母细胞的损害。在此期间,多种玻璃化冷冻方法应运而生,如开放式拉长塑料细管法(open pulled straw,OPS)、固体表面玻璃化法(solid surface vitrification,SSV)和玻璃微细管法(glass micropipette,GMP)等都取得了一定的冷冻保护效果。目前,仅小鼠成熟卵母细胞的冷冻保存技术已趋为完善。家畜中,虽然牛卵母细胞冷冻保存研究最多,但只获得了极少数来自冷冻牛GV期[2]和体外成熟卵母细胞[3]的牛犊,其冷冻卵母细胞的成熟率、受精率和发育率与未冷冻卵母细胞相比都还很低。
细胞松弛素B(cytochalasin-B,CB)是一种细胞骨架稳定剂,能增加细胞骨架的弹性,降低卵母细胞和胚胎在冻融过程中由于细胞骨架变硬而引起的骨架变形和损伤[4-6]。CB在卵母细胞玻璃化冷冻过程中应用的报道还比较少,国外在猪卵母细胞上的研究较多,指出其对猪卵母细胞具有一定的影响作用。但在更有经济价值的牛卵母细胞上,目前国内外仅见Vieira A D等[7]和卞桂华等[8]的报道。为此,本试验开展了CB预处理对牛成熟卵母细胞SSV玻璃化冷冻效果的研究。
1 材料与方法
1.1 材料
卵巢采自新疆乌鲁木齐市天鹰屠宰场,精液是由新疆维吾尔自治区畜禽改良总站提供的细管冻精。所用试剂除TCM199(Gbico),FBS(Hyclone),BSA(Bovogen)和 MEN NEAA(Gbico)外,其余均为Sigma公司产品。
1.2 方法
1.2.1 卵母细胞的采集和成熟培养 从屠宰场收集成年母牛的卵巢,放入装有30℃~35℃灭菌生理盐水(含青、链霉素各100单位/mL)的保温瓶中,2 h内带回实验室。卵巢用38.5℃灭菌生理盐水冲洗3次,用10 mL一次性注射器从卵巢表面上直径为2 mm~8 mm卵泡内抽取卵母细胞。在体视镜下挑出卵丘细胞完整、卵母细胞胞质均匀的卵丘-卵母细胞复合体(COCs),先用洗卵液(Hepes-M199+1 mg/mL PVA+双抗)清洗2遍,再用成熟培养液(TCMI99+100 mL/L FBS+0.05 IU/mL FSH+0.05 IU/mL LH+1 μ g/mL E2)洗 3 次,最后将 50枚COCs吸入含0.5 mL成熟液的四孔培养板中,置38.5℃含体积分数为5%的CO2及饱和湿度的培养箱中培养。洗卵液、成熟液均预先在CO2培养箱平衡约2 h。
1.2.2 玻璃化冷冻程序 本试验采用SSV法进行玻璃化冷冻[9]。所有步骤在39℃下进行,具体方法如下:卵母细胞去掉部分卵丘细胞,置于基础冷冻液(HM)中 20 min(基础冷冻液由 Hepes-M199和200 mL/L FBS组成);将5枚~6枚卵母细胞置于含100 mL/L二甲基亚砜(DMSO)+100 mL/L乙二醇(EG)的 HM 液(VS1)中 1 min,移入含有200 mL/L DMSO+200 mL/L EG的HM液(VS2)中,在30 s内,将含有5枚~6枚卵母细胞和1 μ L~2 μ L的VS 2滴入提前浸入液氮的金属表面上,迅速冷冻,用镊子将冷冻的卵母细胞移入冻存管中,冻存于液氮中(1 d或1个月)。

图1 牛MⅡ卵母细胞解冻后胞质萎缩(100×)Fig.1 Ooplasm atrophy of bovine MⅡoocytes after thawing(100×)
解冻时将冷冻的卵母细胞在含0.25 mol/L蔗糖的HM液中停留1 min,然后移入含0.15 mol/L蔗糖的HM液中停留5 min。
1.2.3 复苏后卵母细胞存活评定 冻融后的卵母细胞在成熟液中继续培养2 h,观察其存活情况。存活的卵母细胞与未经冷冻的卵母细胞在形态上没有差别,如有完整透明带和细胞膜,且胞质折光性好则判定为存活;如透明带破裂、脱落、细胞质碎裂、细胞萎缩均视为异常(图1~图4)。

图2 牛MⅡ卵母细胞解冻后透明带破损(200×)Fig.2 Zona pellucide of disrepair bovine MⅡoocytes after thawing(200×)
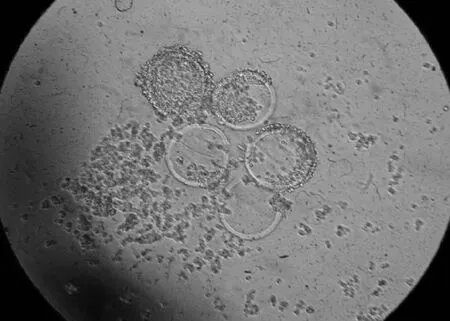
图3 牛MⅡ卵母细胞解冻后胞质溢出(100×)Fig.3 Ooplasm spill bovine MⅡoocytes after thawing(100×)

图4 解冻后形态正常牛MⅡ卵母细胞(100×)Fig.4 Morphologically normal bovine MⅡoocytes after hawing(100×)
1.2.4 卵母细胞的孤雌激活 成熟卵母细胞用5 mg/L透明质酸酶消化卵丘-卵母细胞复合体,得到裸卵 ,放入离子霉素(5 μ mol/L)中处理 5 min,然后移入已平衡好2 mmol/L 6-DMAP液中,在CO2培养箱中继续培养4 h。
1.2.5 胚胎体外培养 孤雌激活后的卵母细胞移入SOFaa培养液(50 μ L/滴,20 ~25枚/滴),置培养箱中进行体外发育培养。于激活后48 h后统计卵裂率,并换SOFaa+100 mL/L FBS共培养液继续培养至第7天~第 8天统计囊胚率(图5,图6)。
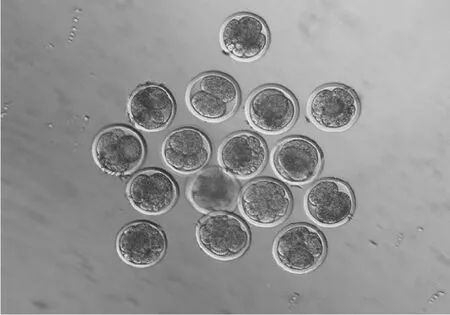
图5 牛MⅡ卵母细胞解冻后孤雌激活胚胎(100×)Fig.5 Embryo from vitrified-thawed bovine MⅡoocytes after activation(100×)

图6 牛M Ⅱ卵母细胞解冻后孤雌激活囊胚(100×)Fig.6 Blastocyst from vitrified-thawed bovine MⅡoocytes after activation(100×)
1.2.6 统计分析 试验所得数据采用SPSS 10.0软件进行差异显著性统计分析。
2 结果
2.1 不同浓度细胞松弛素B预处理对牛成熟卵母细胞冷冻后存活率的影响
CB预处理浓度分别为 2.5、7.5、10、20 和30 μ g/mL。将挑选的卵母细胞随机分为6组,第 1组卵母细胞直接冷冻作为对照组(即0组),其余5组用不同浓度CB处理30 min后,按照SSV玻璃化冷冻的方法处理卵母细胞,试验结果见表1。从所示数据可以看出,20 μ g/mL CB组的存活率相对较高,但经过统计分析表明,5个处理组的存活率与对照组之间都无显著差异(P>0.05)。这表明试验中所用各浓度CB均对玻璃化冷冻的牛成熟卵母细胞存活没有明显的改善作用和毒副作用。

表1 不同浓度CB对牛成熟卵母细胞玻璃化冷冻存活率的影响(n=3)Table 1 Effects of survival rate of vitrified bovine matured oocytes treated with CB in different concentrations
2.2 不同浓度细胞松弛素B预处理对牛成熟卵母细胞冷冻后孤雌激活后期发育能力的影响
冻融后用离子霉素和6-DMAP进行化学激活(表2)。可以看出,在卵裂率方面,5个处理组中20 μ g/mL CB组的卵裂率显著高于对照组(P<0.05),且它与 10 μ g/mL CB 组和30 μ g/mL CB 组相比差异显著(P<0.05);在囊胚率方面,20 μ g/mL CB组极显著高于对照组(P<0.01),同时它还显著高于其它4个处理组(P<0.05)。表明一定浓度的CB处理对冷冻后卵母细胞的后期发育能力有较大影响。
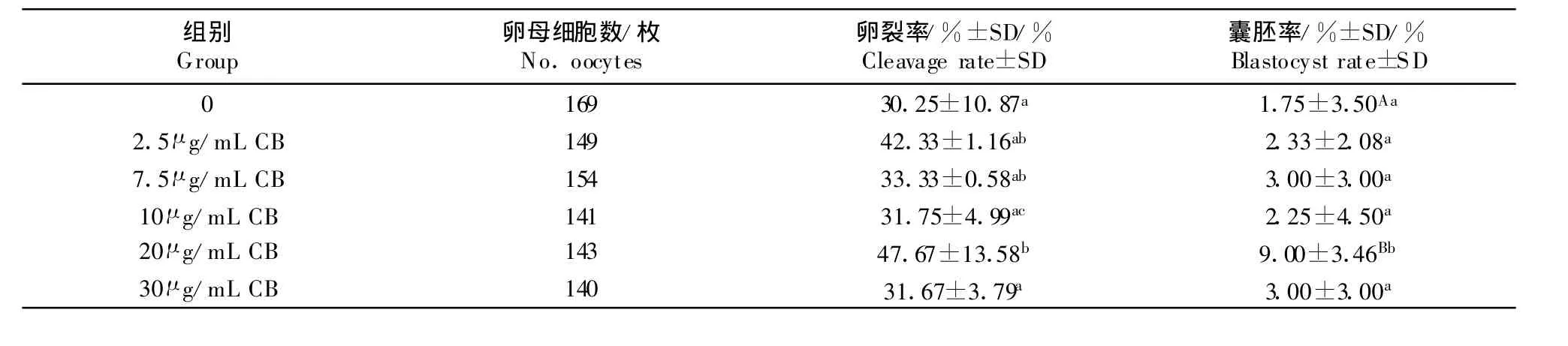
表2 不同浓度CB对牛成熟卵母细胞玻璃化冷冻发育能力的影响(n=3)Table 2 Effects on development capability of vitrified bovine matured oocytes treated with CB in different concentrations
3 讨论
3.1 细胞松弛素B对卵母细胞玻璃化冷冻存活率的影响
本试验中,以10倍递增方式增设了3个处理组。其中SSV玻璃化冻融后存活率结果显示,5个处理组的存活率与对照组差异均不显著(P>0.05)。这一结果与Legal F L[10]和Fujihira T等[11]在山羊和猪中的报道有所不同,Legal F L[10]认为,使用CB处理可提高山羊未成熟卵母细胞冷冻保存后的存活率。Fujihira T 等[11]报道,用7.5 μ g/mL CB 处理 30 min或5.0 μ g/mL CB处理10 min~30 min可以增加猪未成熟卵母细胞玻璃化冷冻后的存活率,并指出细胞松弛素作为细胞骨架松弛剂可以减弱细胞骨架基础的坚固性。这可能与卵母细胞的发育阶段和种间差异有关。
3.2 细胞松弛素B对卵母细胞玻璃化冷冻发育能力的影响
卵母细胞在冷冻保存中引起发育潜力降低是必然的,这主要是由于冷冻过程中渗透压的变化会改变细胞骨架成分的理化特性和完整性,导致减数分裂进程异常和胚胎发育延迟[4-5,12],同时细胞内外电解质浓度的增加也会使细胞膜损伤,进而影响复苏后卵母细胞的受精率[12,14-15]。CB是微丝抑制剂,在冷冻MⅡ期卵母细胞时能减弱对微管的损害并可能增加纺锤体微管的稳定性[4,11]。当前,CB在不同种间卵母细胞玻璃化冷冻过程中的保护作用存在很大差异。在国外,Isachenko V等[6]报道,玻璃化冷冻猪GV期卵母细胞前用7.5 μ g/mL CB处理,解冻后卵母细胞成熟率为22.0%,而对照组仅为5.6%。Dobrinsky J R等[4]报道,超低温冷冻保存扰乱了胚胎细胞膜和微丝的有序结构,而CB的加入可使这些微丝系统得到重构,形成新的骨架系统以支撑整个细胞,从而提高猪胚胎的冷冻效率。Vieira A D等[7]报道,OPS玻璃化冷冻牛未成熟(GV)卵母细胞用CB处理后,其卵裂率和囊胚率与对照冷冻组差异不显著(49%和3.6%,46.4%和3.6%)。Fujihira T等[16]报道,玻璃化冷冻鲸未成熟卵母细胞,用CB处理组与未处理组的成熟率差异并不显著(30.4%和27.3%)。Silvestre M A等[17]报道,在OPS玻璃化冷冻绵羊羔羊GV期卵母细胞时用CB预处理,其处理组(8.0%)与未处理组(12.7%)成熟率差异不显著(P>0.05)。Somfai T等[18]报道,CB可能会提高SSV玻璃化冷冻猪成熟卵母细胞后的存活率和发育率。张波等[19]报道,用5 μ g/mL CB预处理MⅡ期小鼠卵母细胞5 min,并没有提高玻璃化冻融后存活率、受精率和卵裂率。周佰成等[20]用9 μ g/mL CB组处理绵羊GV期卵母细胞的成熟率显著高于对照组(19.5%和16.7%)(P<0.05)。张家新等[21]报道,用浓度7.5 μ g/mL或10.0 μ g/mL CB预处理绵羊成熟卵母细胞20 min~25 min可以提高玻璃化冷冻效果。卞桂华等[8]指出,7.5 μ g/mL CB处理MⅡ期水牛卵母细胞冷冻解冻后,激活后的分裂率差异显著(55.56%和32.69%,P<0.05),但存活率和囊胚率与未处理组相比差异均不显著(88.89%、8.82%和94.20%、14.55%,P>0.05)。
我们在牛卵母细胞玻璃化冷冻方面的试验结果显示,在卵裂率方面,20 μ g/mL CB组显著高于对照组(P<0.05),且它与 10 μ g/mL CB 组和 30 μ g/mL CB组相比差异显著(P<0.05);在囊胚率方面,20 μ g/mL CB组极显著高于对照组(P≤0.01),同时它还显著高于其他4个处理组(P<0.05)。这表明CB在玻璃化冷冻过程中的保护作用存在一定浓度的依赖性,其中浓度20 μ g/mL CB对牛成熟卵母细胞玻璃化冷冻效果的改善作用最明显。
从本试验可以看出,即使 CB浓度提高到30 μ g/mL,对牛成熟卵母细胞冷冻后的存活率也没有明显的毒副作用。从数据分析来看,对冷冻的改善作用并没有随CB浓度递增而一直递增下去,而是到达一定浓度后就不再递增,呈现出下降趋势,其中的原因还有待进一步探索。
[1]Rall W F,Fahy G M.Ice-free cryopreservation of mouse embryos at 196 degrees C by vitrification[J].Nature,1985,313(6003):573-575.
[2]Fuku E,Xia L,Downey B R.Ultra-structural changes in bovine oocytes after cryopreservated by vitrification[J].Cryobiology,1995,32:139-156.
[3]Suzuki T,Nishikata Y.Fertilization and cleavage of frozen thawed bovine oocytes by one-step dilution methodin vitro[J].Theriogenology,1992,37:306-309.
[4]Dobrinsky J R,Pursel V G,Long C R,et al.Birth of piglets after transfer of embryos cryopreserved by cytoskeletal stabilization and vitrification[J].Biol Reprod,2000,62(3):564-570.
[5]Rojas C,Palomo M J,Albarracin J L,et al.Vitrification of immature andin vitromatured pig oocytes:study of distribution of chromosomes,microtubules and actin microfilaments[J].Cryobiology,2004,49(3):211-220.
[6]Isachenko V,Soler C,Isachenko E,et al.Vitrification of immature porcine oocytes:effects of lipid droplets,temperature,cytoskeleton and addition and removal of cryoprotectant[J].Cryobiology,1998,36(3):250-253.
[7]Vieira A D,Mezzalira A,Barbieri D P,et al.Calves born after pulled straw vitrification of immature bovine oocytes[J].Cryobiology,2002,45:91-94.
[8]卞桂华,陈自洪,杨 娟,等.细胞松弛素B(CB)对水牛卵母细胞玻璃化冷冻保存的影响[J].黑龙江畜牧兽医,2008(7):34-36.
[9]Dinnyes A,Dai Y,Jiang S,et al.High developmental rates of vitrified bovine oocytes following parthenogenetic activation,in vitrofertilization,and somatic cell nuclear transfer[J].Biol Reprod,2000,63:513-518.
[10]Legal F L,Gasqui P,Renard J P.Differential osmotic behavior of mammalian oocytes before and after maturation:a quantitative analysis using goat oocytes as a model[J].Cryobiology,1994,31:154-170.
[11]Fujihira T,Kishida R,Fukui Y,et al.Developmental capacity of vitrified immature porcine oocytes following ICSI:Effects of cytochalasin B and cryoprotectants[J].Cryobiology,2004,49(3):286-290.
[12]高玉时,章 明,李慧芳,等.地方鸡种微卫星DNA指纹图谱的建立与遗传变异分析[J].中国家禽,2004,8(1):184-188.
[13]Lim J M,Fukui Y,Ono H.Developmental competence of bovine oocytes frozen at various maturation stages followinged by in vitro maturation and fertilization[J].Theriogenology,1992,37:351-361.
[14]Chung H M,Hong S W,Lim M J,et al.In vitroblastocyst formation of human oocytes obtained from unstimulated and stimulated cycles after vitrification at various maturational stages[J].Fertil Steril,2000,73(3):545-551.
[15]Eroglu A,Toner M,Toth T L.Cryopreservation of human oocytes:the prophase I oocyte as an alternative approach[J].Assisted Reproduction Review,1995,5:241.
[16]Fujihira T,Kobayashi M,Hochi S,et al.Developmental capacity of Antarctic minke whale(Balaenoptera bonaerensis)vitrified oocytes followingin vitromaturation,and parthenogenetic activation orintracytoplasmic sperm injection[J].Zygote,2006,14(2):89-95.
[17]Silvestre M A,Yaniz J,Salvador I,et al.Vitrification of prepubertal ovine cumulus-oocyte complexes:effect of cytochalasin B pretreatment[J].Anim Reprod Sci,2006,93(1-2):176-182.
[18]Somfai T,Dinnyés A,Sage D,et al.Development to the blastocyst stage of parthenogenetically activatedin vitromatured porcine oocytes after solid surface vitrification(SSV)[J].Theriogenology,2006,66(2):415-422.
[19]张 波,冯 雪,方伟芬,等.细胞松弛素B和解冻方法对玻璃化冷冻小鼠卵母细胞的影响[J].中山大学学报:医学科学版,2007,28(6):645-648.
[20]周佰成,王志刚,刘丑生,等.细胞松弛素B对绵羊GV期卵母细胞玻璃化冷冻效果影响[J].中国畜牧兽医,2007,34(3):47-49.
[21]张家新,陈少轻,孟昭霞,等.卵丘细胞和细胞骨架稳定剂对绵羊成熟卵母细胞玻璃化冷冻的影响[J].安徽农业科学,2008,36(5):1879-1881.
Effects of Cytochalasin B on Vitrification of Bovine Mature Oocytes
GUO Juan1,2,W ANG Zhi-qin2,ZHAO Yun-cheng1,LIN Jia-peng1,HUANG Jun-cheng1
(1.The Key Labof Animal Biotechnology of Ministry of Agriculture,Xinjiang Academy of Animal Sciences,Urumqi,Xinjiang,830000,China;2.College of Veterinary Medicine,Xinjiang Agriculture University,Urumqi,Xinjiang,830052,China)
In the present study,effects of concentration of cytochalasin B(CB)on the development of bovine matured oocyte following solid surface vitrification(SSV)were examined.The results demonstrated that:no significant differences were observed in the survival rate among the control and treatment groups;However,after activation of oocytes,vitrified oocytes treated with 20 mg/mL CB resulted in a higher(47.67%and 30.25%,respectively,P<0.05)cleavage development rate than that of the control,while the blastocyst development rates were significantly higher(9.00%and 1.75%,respectively,P≤0.01)than that of the control and other treatment groups(P<0.05).In conclusion,the protective effects of CB have a certain concentration dependence in the vitrification process,especially pretreatment with 20 μ g/mL CB was beneficial for the vitrification of mature bovine oocytes.
oocyte;vitrification;bovine;cytochalasin B
S814.8
A
1007-5038(2010)03-0055-05
2009-09-21
新疆高技术研究与发展项目(200841122)和基金项目(200821182);国家863项目(2008AA101007)
郭 娟(1982-),女,河南人,硕士,主要从事动物生殖与发育研究。*通讯作者

