犊牛腹泻主要病原菌多重PCR方法的建立*
高立战,刘 军,赵学前,孙 栋,姜 力,孙 洋,祝令伟,冯书章*
(1.军事医学科学院军事兽医研究所,吉林长春 130062;2.吉林省通化县动物疾病预防控制中心,吉林通化 134100;3.吉林省兽医科学研究所,吉林长春 130062)
犊牛腹泻主要病原菌多重PCR方法的建立*
高立战1,刘 军1,赵学前2,孙 栋2,姜 力3,孙 洋1,祝令伟1,冯书章1*
(1.军事医学科学院军事兽医研究所,吉林长春 130062;2.吉林省通化县动物疾病预防控制中心,吉林通化 134100;3.吉林省兽医科学研究所,吉林长春 130062)
产毒性大肠埃希菌、A/E大肠埃希菌和沙门菌是造成犊牛腹泻的主要病原菌。选取产毒性大肠埃希菌的st和lt基因、A/E大肠埃希菌的eae基因和沙门菌的invA基因作为扩增靶基因序列,通过优化反应条件建立了四重PCR检测体系。对PCR产物回收、测序,验证PCR。通过特异性试验和敏感性试验证明该PCR体系特异性强、敏感性高,可有效地检测犊牛腹泻病原菌。使用该四重PCR检测22份临床样品,发现其中9份携带相关基因,并分离得到了相关致病菌。
大肠埃希菌;沙门菌;多重PCR
犊牛腹泻是指新生以及断乳期的犊牛所发生的一种急性腹泻,主要由肠道病原菌引起,其次病毒、寄生虫等病原体或者是营养性和环境性因素也可以导致犊牛腹泻。临床症状表现为高热,急性水样腹泻或出血性腹泻,呈进行性脱水,酸中毒症状,最终可衰竭死亡。随着养牛业规模扩大,犊牛腹泻的病例呈上升趋势,死亡率较高,成为影响犊牛早期的生长发育和后期生产性能的主要疾病之一。因此,弄清犊牛腹泻病因,准确做出诊断,及时治疗,尤为重要。
大肠埃希菌(Escherichia coli)和沙门菌(Salmonella)是造成犊牛腹泻的主要的细菌性病原微生物。在遗传学上,大肠埃希菌有不同的种群,有些是典型非致病性的,是人类和动物肠道正常微生物区系的一部分。然而,这种细菌的一些亚群获得了致病基因,这使它们能够引起肠内和肠外疾病[1]。大量的研究表明,奶牛犊牛因大肠埃希菌病造成的死亡占其死亡总数的一半左右,而肉牛犊牛因大肠埃希菌病造成的死亡占其死亡总数的一半以上。产毒性大肠埃希菌(enterotoxigenicE.coli,ETEC)是引起犊牛腹泻的常见主要病原菌[2],它分泌两种肠毒素,即耐热肠毒素(heat-stable toxin,ST)和不耐热肠毒素(heat-labile toxin,LT)。ST与受体结合后,通过激活鸟苷酸环化酶,导致腹泻;LT被宿主细胞内吞后解体,解体产生的部分肽段可通过激活腺苷酸环化酶,导致腹泻。从动物体内分离得到的ETEC的lt或st基因的序列有微小的差异,其致病性也有些差异[3]。A/E大肠埃希菌(attaching and effacingE.coli,AEEC)也被鉴定为犊牛痢疾及犊牛腹泻的病原菌[4-5]。AEEC携带的eae基因编码介导AEEC与肠上皮细胞紧密黏附的紧密素(Intimin)。Intimin介导的紧密黏附是A/E损伤的起始和必需步骤。可引起疾病但不产生肠毒素的A/E大肠埃希菌被称为致病性大肠埃希菌(entero-pathogenicE.coli,EPEC);既产生志贺毒素又有A/E效应,可以起出血性结肠炎(hemorrhagic colitis,HC)的A/E大肠埃希菌被称为出血性大肠埃希菌(entero-hemorrhagicE.coli,EHEC)。沙门菌是仅次于大肠埃希菌的犊牛肠道病原菌,也是成年牛腹泻的最重要的细菌性病原,主要侵害10日龄~30日龄犊牛[6],特别是都柏林沙门菌是犊牛腹泻的主要病原菌。沙门菌的invA基因是其侵袭性基因[7],它在沙门菌A群~E群中高度保守。
为了更准确及时地检测犊牛细菌性腹泻,了解犊牛细菌性腹泻的病原学及流行病学概况,为临床诊断与治疗提供科学依据,本试验以ETEC的st和lt、EPEC和EHEC的eae以及沙门菌的invA为靶基因,建立多重PCR检测体系。
1 材料与方法
1.1 材料
1.1.1 菌株 大肠埃希菌C83922(O101:K99:F41,ST+)、C83923(O8 ∶K87,LT+ST+)、C83915(O9∶K103,9879:NM,ST+)、鼠伤寒沙门菌(C77-31,InvA+)购自中国兽药监察所;EHEC O157∶H7 EDL933(Stx1+,Stx2+,Intimin+)、猪链球菌2型458、都柏林沙门菌(InvA+)、大肠埃希菌重组菌株EWD299(LT+)、大肠埃希菌 DH5α、EHEC O157∶H7 86-24(Intimin+)、EPEC O127∶H6 E2348/69(Intimin+)由本实验室保存;其他的参考菌株为23株非ETEC、非AEEC大肠埃希菌、3株乳房链球菌、2株粪肠球菌的临床分离株是由军事兽医研究所保存。
1.1.2 试剂和仪器 PCR仪(东胜创新 EDC-810);梅里埃 ViteK32自动微生物鉴定仪;TaqDNA聚合酶为宝生物工程(大连)有限公司产品;dNTP为北京鼎国生物技术有限公司产品;TIANGEN琼脂糖凝胶DNA回收试剂盒。
1.1.3 其他材料 麦康凯培养基购自青岛海博生物技术有限公司,Balb/c小鼠购自长春生物制品研究所。
1.2 方法
1.2.1 引物设计 以ETEC的st和lt基因、AEEC的eae基因以及致病性沙门菌的invA基因为四重PCR的扩增靶基因,分别根据 GenBank上的M25607.1、M57244.1 和 CP001144.1,选取保守序列,使用Blast-Primer3设计st、lt和invA的引物(表1)。引物由宝生物工程(大连)有限公司合成。
1.2.2 模板DNA制备 采用热裂解法制备细菌的DNA模板。取200 μ L(参考菌株单菌落的培养液)或1 mL(待检样品的培养液)LB细菌培养液,12 000 r/min离心2 min,留菌体弃上清,加入 50 μ L的双蒸水重悬沉淀,100 ℃水浴10min,10 000 r/min离心2 min沉淀菌体蛋白,取上清作为PCR的模板DNA;或从麦康凯培养基上挑取紫红色(大肠埃希菌)或黄白(沙门菌)单菌落,用 50 μ L的双蒸水重悬,将悬液100℃水浴10 min,10 000 r/min离心2 min沉淀菌体蛋白,取上清作为PCR的模板DNA;对于同步进行平板计数的不同浓度梯度的菌液,取 200 μ L 100℃水浴 10 min,10 000 r/min离心2 min,离心沉淀菌体蛋白,取上清作为PCR模板。
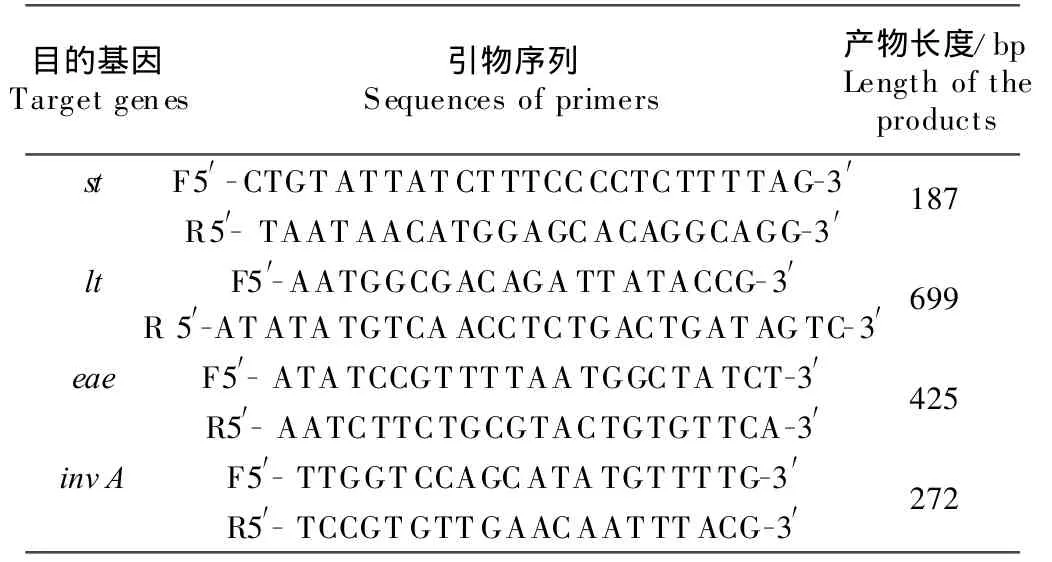
表1 四重PCR的引物Table 1 Primers of multi-PCR
1.2.3 建立多重PCR反应体系
1.2.3.1 不同退火温度 Ta对多重PCR的影响梯度 PCR的 Ta为 12个梯度,分别为58℃,58.4℃,58.7℃,59.3℃,60.1℃,60.8℃,61.4℃,62.1℃,62.9℃,63.5℃,63.8℃,64℃。
1.2.3.2 不同引物浓度对多重PCR的影响 在梯度PCR中逐对增加PCR引物,每对引物的起始浓度为0.25 μ mol/L,试验中再上调或下调相应引物的浓度,直至每条扩增带都达到较好的效果。
1.2.3.3 不同循环数对多重PCR的影响 多重PCR 分别进行 26、27 、28、29、30、31 和 32 个循环 。
1.2.4 PCR特异性实验
1.2.4.1 参考菌株检测 分别对 C83922、EDL933、都柏林沙门菌、EWD299 、C83923、C83915、C77-31、EHEC O157∶H7 86-24、EPEC O127∶H6 E2348/69,进行四重PCR扩增
1.2.4.2 对照菌株检测 对23株非ETEC和非AEEC大肠埃希菌、3株乳房链球菌、2株粪肠球菌的临床分离株进行四重PCR扩增。
1.2.4.3 PCR反应特异性片段测序 琼脂糖凝胶(20 g/L)电泳PCR产物,再使用DNA回收试剂盒回收,送宝生物工程(大连)有限公司测序。
1.2.5 PCR敏感性实验 挑取C83922、EDL933、都柏林沙门菌和EWD299的单菌落,接种于5 mL LB液体培养基中,37℃空气振荡培养12 h后,用生理盐水10倍倍比稀释,涂于麦康凯培养基上,平板计数。同时制作4种菌各个梯度的PCR模板。
1.2.6 临床样本检测 从吉林省通化县兴林养牛场(T1-T5以及TX1、TX2)、通榆县向海养牛场(X1-X5)、榆树县五棵树养牛场(W1-W6)和乾安县养牛户(Q1-Q4)共采集到了22份腹泻犊牛的粪便样品。取2 g样品,用1 mL生理盐水漂洗,静置10 min,取上清接种于5 mL LB液体培养基中,37℃空气振荡培养4 h。将1 mL菌液全部离心、重悬、水浴制备模板DNA,四重PCR检测。
1.2.7 病原菌分离
1.2.7.1 生物过滤法分离病原菌 取2 g腹泻犊牛的粪便样品,用1 mL生理盐水混悬,静置10 min,取200 μ L洗液腹腔注射小鼠,待小鼠死后,取其心血划线接种于麦康凯平板。挑取单菌落重悬于50 μ L的双蒸水,制备 PCR模板,多重 PCR检测。
1.2.7.2 直接分离病原菌 取2 g腹泻犊牛的粪便样品,用1 mL生理盐水混悬,静置10 min,取100 μ L样品重悬液,直接涂于麦康凯平板。挑取单菌落重悬于 50 μ L的双蒸水,制备PCR模板,多重PCR检测。
1.2.7.3 生化鉴定 选出PCR鉴定阳性的细菌菌株,用自动微生物鉴定仪做生化鉴定。
2 结果
2.1 多重PCR的反应体系和条件
2.1.1 不同退火温度 Ta对多重PCR的影响 多重 PCR 在 Ta 为 58、58.4、58.7 、59.3、60.1、60.8、61.4℃时,均能扩增出4个靶基因。但是在Ta为60.8℃时,效果最好。
2.1.2 不同引物浓度对多重PCR的影响 当引物stF/R、invAF/R、eaeF/R和ltF/R的浓度依次为:0.4、0.3、0.2、0.2 μ mol/L 时 ,多重 PCR 的扩增效果最好。
2.1.3 不同循环数对多重PCR的影响 当循环数为30时,多重PCR效果最好
2.1.4 多重PCR最优的反应体系和条件 经过条件优化,四重PCR体系为:模板DNA,1 μ L;TaqDNA聚合酶2.5 U;10×PCR buffer(T ris-HCl pH 8.3 100 mmol/L;KCl 500mmol/L;MgCl2 15 mmol/L),2 μ L;每种 dNTP 浓度 250 μ mol/L;引物stF/R、invAF/R、eaeF/R和ltF/R的浓度依次为 :0.4 、0.3 、0.2 、0.2 μ mol/L;反应体积20 μ L 。四重PCR反应的最佳条件为:95℃预变性40 s;95℃30 s,60.8℃30 s,72℃1 min,30个循环;最后延伸3 min。
2.2 多重PCR的特异性
2.2.1 参考菌株检测 对 C83922、EDL933、都柏林沙门菌和EWD299混合模板进行四重PCR(图1),条带特异、清晰。证明该四重PCR特异性强。
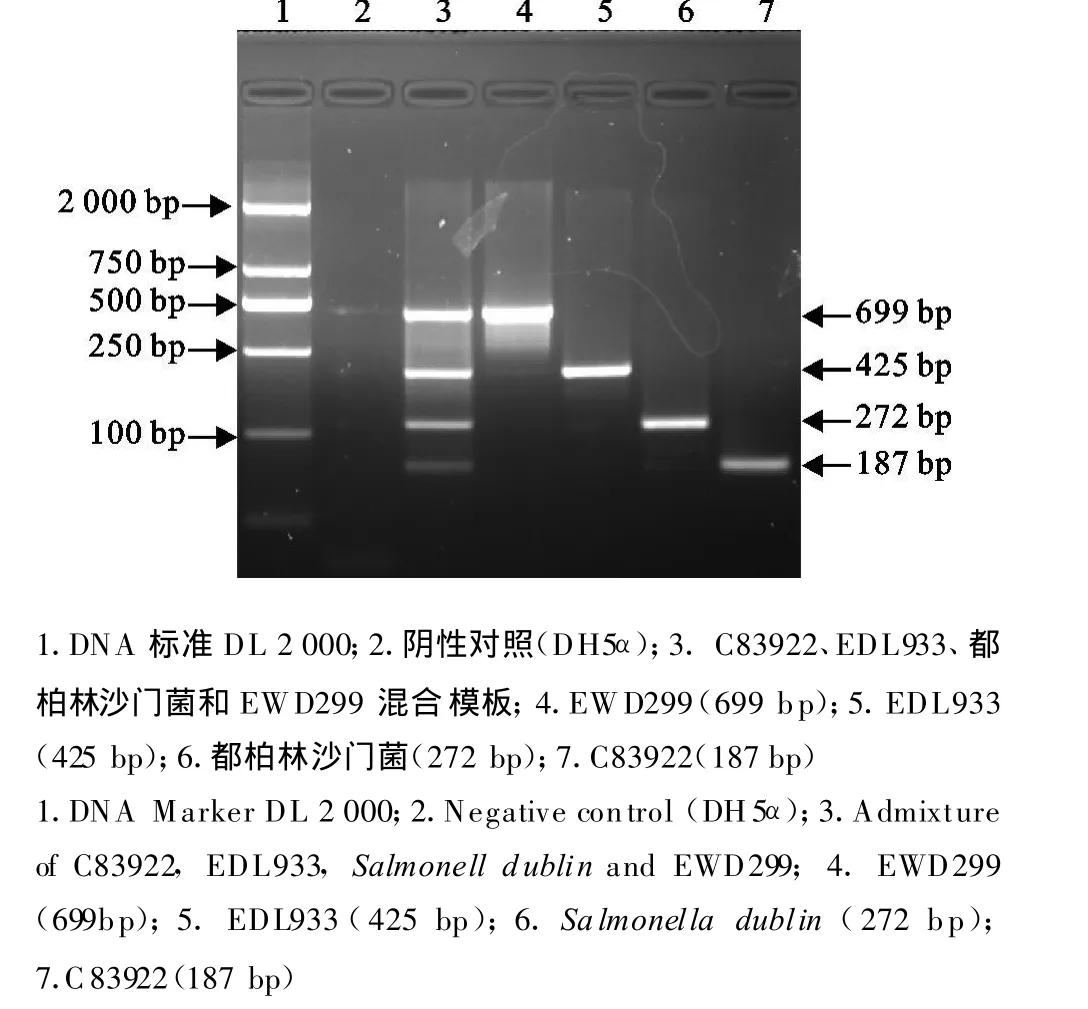
图1 C83922、EDL933、都柏林沙门菌、EWD299以及混合模板的四重PCRFig.1 Identification of C83922,EDL933,Salmonella dublin,EWD299 and the admixture by the multi-PCR
四重 PCR 对 C83923、C83915、C77-31、EHECO157∶H7 86-24、EPEC O127∶H6 E2348/69的检测结果与其已知的基因背景一致(表2)。
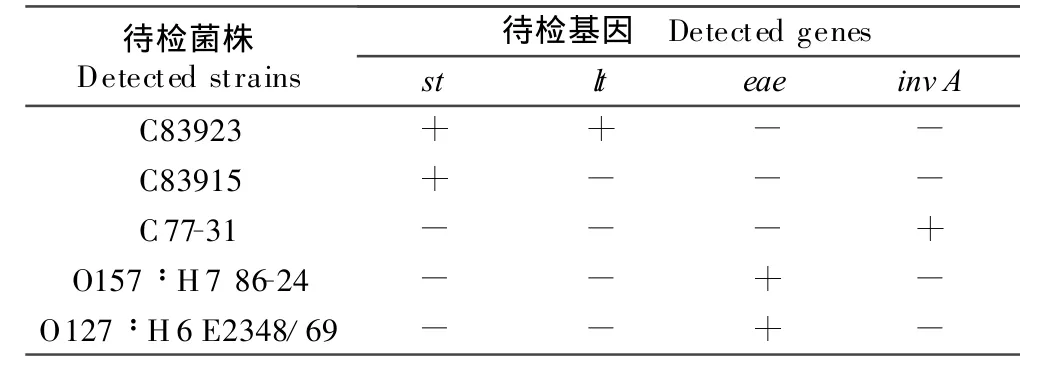
表2 实验室参考菌株的四重PCR检测结果Table 2 Results of the multi-PCR to identify reference strains
2.2.2 对照菌株检测 23株非ETEC和非AEEC大肠埃希菌、3株乳房链球菌、2株粪肠球菌的临床分离株经该四重PCR检测均为阴性,证明该多重PCR特异性好。
2.2.3 多重PCR反应特异性片段核酸序列 本试验所获得st序列,较GenBank:M25607.1(note=“heat-stable enterotoxin I”)同源性为 97%;eae序列,较 GenBank:FJ609808.1(gene=“eae”product=“intimin”)同源性为96%;inv A序列 ,较Gen-Bank:CP001144.1(locus_tag=“SeD_A3206”product=“invasion protein InvA”)同源性为 99%;lt序列,较 GenBank:M57244.1(gene=“LT-A”product=“heat-labile enterotoxin subunit A”)同源性为97%。证明四重PCR特异、结果真实。
2.3 多重PCR的敏感性
通过平板计数,确定多重 PCR反应中对C83922、EDL933、都柏林沙门菌、EWD299 和它们混合菌液能过检出的最小浓度分别为3×103、5×103、3×103、1×104、2×104cfu/mL 。试验证明该四重PCR敏感度高。
2.4 临床样本检测
用该四重PCR检测到22份临床样品中,T1、T2、T3、X2、X4、W1和 TX1 中含有eae;X1 和 X5中含有lt;X4中还含有st(图2)。
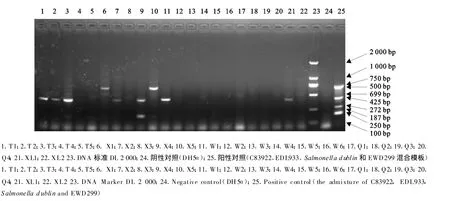
图2 22份犊牛腹泻样品的四重PCR检测结果Fig.2 Results of multi-PCR to identify 22 samples from diarrheal calves
2.5 病原菌分离
2.5.1 直接法和生物过滤法分离病原菌 通过直接分离和生物过滤法分离病原菌,得到相同的分离菌株 。在样品 T1、T2、T3、X2、W1和 TX1中分离到携带eae基因的菌株;在样品X1和X5中分离到携带lt的菌株;在样品X4中分离到同时携带eae基因和st基因的菌株。
2.5.2 生化鉴定 用自动微生物鉴定仪对分离到的菌株进行生化鉴定,所测28项指标均与大肠埃希菌生化指标相符。
3 讨论
ETEC在3种主要食用肉(牛肉、禽肉和猪肉)中的检出相当高[8],它分泌的两种肠毒素ST和LT,其中ST对热稳定,其基因主要存在于质粒上,少部分存在于转座子上,是ETEC引发人畜腹泻的主要毒力因子;LT对热不稳定,发现于人和动物源性ETEC,与腹泻有关,编码LT的基因都位于质粒上。以st、lt为PCR扩增靶序列,可以有效地检测ETEC。选取EHEC和EPEC在eae上的同源序列为PCR扩增靶序列,可以有效地同时鉴定两种致病性的 AEEC。沙门菌的invA基因位于致病岛-1(SPI-1),其所编码的吸附和侵袭上皮细胞表面的InvA蛋白是Ⅲ型分泌系统不可缺失的组件,该蛋白决定沙门菌对肠黏膜细胞的侵袭力[9],invA基因发生变异的菌株不会引起肠道上皮细胞的病变,不少学者通过检测该基因片段来显示沙门菌的存在[10-12],选取高度保守的invA基因为PCR扩增靶序列,可有效的鉴定致病性沙门菌。
试验中的22份样品中,有9份涉及到该四重PCR所选取的靶基因,这说明该四重PCR所选靶基因典型、具有很好的适用性。实验中分离到同时携带eae和st的大肠埃希菌,在犊牛腹泻样品中发现的这种新型大肠埃希菌的衍生及其与致病性的关系,有待进一步的研究。在22份样品中,没有检测到沙门菌,这可能与样品采集都是在春末时节有关,或许在这个时节中犊牛腹泻的主要病原菌以大肠埃希菌为主。
传统的分离培养、生化鉴定方法,费时费力,而且检测率不高。单一PCR方法,一次只能检测一种基因或一种病原菌,本实验中的四重PCR可同时检测3种病原菌、4种毒力基因,迅速、高效。整个PCR检测过程6 h左右,能够及时地进行犊牛腹泻的临床诊断。试验证明该四重PCR方法敏感性好、特异性高,具有可高通量检测的特点,可用于犊牛腹泻的快速检测。
[1]Kaper J B,Nataro J P,Mobley H L.PathogenicEscherichia coli[J].Nat Rev Microbiol,2004,2:123-140.
[2]Franck S M,Bosworth B T,Moon H W.Multiplex PCR for enterotoxigenic,attaching and effacing,and Shiga toxin-producingEscherichia colistrains from calves[J].J Clin Microbiol,1998,36(6):1795-1797.
[3]Zhang C,Rausch D,Zhang W.Little heterogeneity among genes encoding heat-labile and heat-stable toxins of enterotoxigenicEscherichia colistrains isolated from diarrheal pigs[J].Appl Environ Microbil,2009,75(19):6402-6405.
[4]Butler D G,Clarke R C.Diarrhoea and dy sentery in calves.Escherichia coliin domestic animals and humans[M].Wallingford,United Kingdom,1994:91-116.
[5]Mainil J G,Jacquemin E,Kaeckenbeeck A,et al.Association between the effacing gene(eae)and the Shiga-like toxin-encoding genes inEscherichia coliisolates from cattle[J].Am J Vet Res,1993,54(7):1064-1068.
[6]李俊生,李小丽,周 茹.犊牛腹泻病因探讨及治疗[J].陕西农业科学,2004(6):94-95.
[7]Sano T,Smith C L,Cantor C R.Immuno-PCR:very sensitive antigen detection by means of specific antibody-DNA conjugates[J].Science,1992,258(5079):120-122.
[8]Lee G Y,Jang H I,Hwang I G,et al.Prevalence and classification of pathogenicEscherichia coliisolated from fresh beef,poultry,and pork in Korea[J].Int J Food Microbiol,2009,15;134(3):196-200.
[9]Kidder M,Chan P J,Seraj I M,et al.Assessment of archived paraffin-embedded cervical condyloma tissues for mycoplasmaconserved DNA using sensitive PCR-ELISA[J].Gynecol Oncol,1998,71(2):254-257.
[10]Chevriver D,Rasmussen S R,Guesdon J L.PCR product quantification by non-radioactive hybridization procedures using an oligonucleotide covalently bound to microwells[J].Mol Cell Probe,1993,7(3):187-197.
[11]Heid C A,Steven J,Livak K J,et at.Real time quantitative PCR[J].Genome Research,1996,6(10):986-994.
[12]Nazarenko I A,Bhatnagar S K,Hohman R J.A closed tube fo rmat for amplification and detection of DNA based on energy transfer[J].Nucleic Acid Res,1997,25(2):2516-2521.
Multiplex PCR for Major Pathogenic Bacteria Causing Diarrhea in Calves
GAO Li-zhan1,LIU Jun1,ZHAO Xue-qian2,SUN Dong2,JIANG Li3,SUN Yang1,ZH U Ling-wei1,FENG Shu-zhang1
(1.Military Veterinary Institute,Academy of Military Medical Sciences,Changchun,Jilin,130062,China;2.Center for Animal Disease Control and Prevention,Tonghua County,J ilin,134100,China;3.Veterinary Research Institute of Jilin Prov ince,Changchun,Jilin,130062,China)
Abstrat:EnterotoxigenicEscherichia coli,attaching and effacingE.coli,andSalmonellaare major pathogenic bacteria causing diarrhea in calves.A multiplex PCR was developed to identify the bacteria by amplifying genes ofeaecarried by AEEC,invAcarried bySalmonella,standltcarried by ETEC.The multiplex PCR was verified by sequencing the products of PCR.The multiplex PCR was specific and sensitive and is efficient to detect the pathogenic bacteria.Nine of 22 clinical samples carrying related genes were detected by this multiplex PCR.
Escherichia coli;Salmonella;multiplex PCR
S854.43
A
1007-5038(2010)03-0030-05
2009-08-19
国家科技支撑计划课题(2007BAB55B05)
高立战(1985-),男,山东新泰人,硕士,主要从事分子细菌学研究。*通讯作者

