鼠伤寒沙门菌鞭毛蛋白与新城疫病毒F蛋白的融合表达及免疫原性分析*
游 猛,潘志明,耿士忠,马全刚,方 强,焦新安
(扬州大学江苏省人兽共患病学重点实验室,江苏扬州 225009)
鼠伤寒沙门菌鞭毛蛋白与新城疫病毒F蛋白的融合表达及免疫原性分析*
游 猛,潘志明*,耿士忠,马全刚,方 强,焦新安*
(扬州大学江苏省人兽共患病学重点实验室,江苏扬州 225009)
应用PCR技术分别扩增鼠伤寒沙门菌鞭毛蛋白fliC基因以及含有新城疫病毒F蛋白部分表位的基因片段,通过柔性肽(Gly4Ser)2编码序列将二者串联并克隆到质粒pET30a+上,获得重组原核表达质粒pET-fliC-F,将其转化入大肠埃希菌BL21(DE3)中表达。Western blot证实重组菌表达的fliC-F融合蛋白能与小鼠抗fliC和抗F蛋白两种多抗血清发生特异性反应。动物试验显示,fliC-F融合蛋白能够刺激C3H/HeJ小鼠产生针对F蛋白的特异性血清抗体,说明原核表达系统表达的fliC-F融合蛋白具有较好的免疫原性。
鼠伤寒沙门菌;鞭毛蛋白;新城疫病毒;融合蛋白;免疫原性
新城疫(Newcastle disease,ND)是危害养禽业的主要传染病之一,被世界动物卫生组织(OIE)确定为法定报告疾病,免疫预防是控制该病的重要手段。新城疫病毒(Newcastle disease virus,NDV)的融合蛋白(F)除了参与病毒的穿透、细胞融合,与病毒的致病性有关外,还具有良好的免疫原性,是NDV亚单位疫苗研究的主要目的抗原[1]。
Janeway C A[2]首次提出,机体对外来抗原物质如对病原微生物的识别是由细胞的特定受体介导的。目前已证实,这一识别主要是通过细胞表面的Toll样受体(T oll-like receptor,TLRs)家族分子来实现的。T LRs可识别病原微生物高度保守的结构基序,即所谓的病原相关分子模式(pathogen-associated molecular patterns,PAMPs),并诱导产生天然免疫应答[3]。特定的 TLRs可以识别相应的PAMPs,其中T LR5识别鞭毛蛋白[4]。鞭毛蛋白作为天然免疫应答的诱导剂,诱导产生的天然免疫应答可帮助建立针对外源抗原的获得性免疫应答,从而显示出鞭毛蛋白作为免疫佐剂的效应[5]。Cuadros C等[6]利用原核表达系统表达鼠伤寒沙门菌鞭毛蛋白与增强型绿色荧光蛋白(EGFP)的融合蛋白作用骨髓源抗原递呈细胞(BMDCs),可刺激BMDCs成熟并分泌前炎性因子。另外,该融合蛋白还可有效提高抗原递呈细胞(APCs)递呈EGFP抗原的能力,更为重要的是融合蛋白免疫小鼠后产生了特异性抗EGFP的T细胞免疫应答,而EGFP单独免疫组没有能够活化APCs,也没能诱导产生 T细胞免疫应答。根据上述结果Cuadros认为,重组鞭毛蛋白融合蛋白可能是适合的载体,作为佐剂或疫苗可用于新型免疫接种策略的开发,从而诱导和加强抗传染病和癌症的免疫应答。但迄今为止,针对鞭毛蛋白免疫佐剂效应的研究仍限于医学领域,在动物疾病方面的类似研究还未见报导。
为此,本研究利用重叠延伸PCR(overlap PCR)技术,通过柔性肽将鼠伤寒沙门菌鞭毛蛋白和NDV F蛋白部分基因片段串联,构建重组原核表达质粒,利用原核表达系统表达鞭毛蛋白与F蛋白的融合蛋白,并以C3H/HeJ小鼠为动物模型,初步探讨融合蛋白的免疫原性,以期为新城疫的免疫预防提供新方法。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和血清 含有NDV F48E8株全长F基因的重组质粒pVAX1-F、含有鼠伤寒沙门菌Ⅰ相鞭毛蛋白基因fliCi的重组质粒pET-fliC、原核表达载体 pET30a+;宿主菌 DH5α、BL21(DE3)均由江苏省人兽共患病学重点实验室保存;NDV F蛋白、野生型鼠伤寒沙门菌鞭毛蛋白,小鼠抗NDV F蛋白多抗血清和抗fliC蛋白多抗血清均由江苏省人兽共患病学重点实验室自制。
1.1.2 试剂 限制性内切酶EcoRⅠ、HindⅢ,高保真Taq酶,T4 DNA连接酶以及DNA回收试剂盒购自宝生物工程(大连)有限公司;异丙基硫代-β-D-半乳糖苷(IPTG)购自Promega公司;酵母抽提物、蛋白胨购自 Oxoid公司;HRP标记的羊抗鼠IgG酶标二抗购自Sigma公司;小牛血清购自兰州民海生物工程有限公司;其他化学试剂均为国产分析纯。
1.1.3 实验动物 6周龄~8周龄雌性C3H/HeJ小鼠购自扬州大学比较医学中心。
1.2 方法
1.2.1 引物的设计与合成 以重组原核表达质粒pET-fliC为模板,设计引物FF1和FF2扩增fliC基因。上游引物FF1引入EcoRⅠ酶切位点(下划线部分),下游引物FF2引入柔性肽(Gly4Ser)2上游序列(下划线部分);以重组真核表达质粒pVAX1-F为模板,设计引物FF3和FF4扩增F基因。上游引物FF3引入柔性肽(Gly4Ser)2下游序列(下划线部分),下游引物FF4引入HindⅢ酶切位点(下划线部分)及终止子(黑体表示)。引物由上海英骏生物技术有限公司合成,它们的序列如下所示:
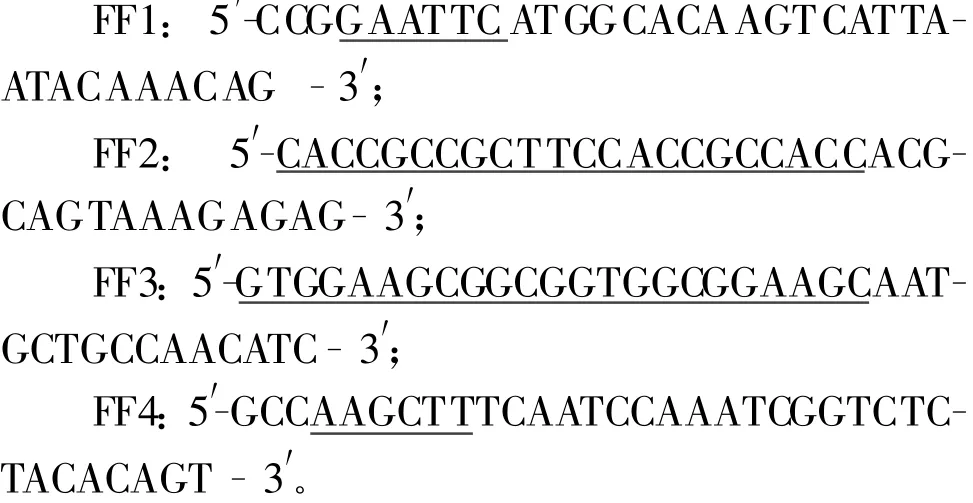
1.2.2 fliC-F基因的扩增及克隆 以pET-fliC为模板,用引物FF1、FF2扩增fliC基因。PCR反应程序为:94℃预变性5 min;94℃50 s,52.1℃55 s,72℃2 min,35个循环;72℃延伸10 min;4℃10 min。以pVAX1-F 为模板,用引物FF3、FF4扩增F基因部分片段。PCR反应程序为:94℃预变性5 min;94℃50 s,52.1℃50 s,72℃1 min,35个循环;72℃延伸10 min;4℃10 min。再以上述两种PCR产物为模板,用引物FF1、FF4通过 overlap PCR拼接和扩增fliC-F基因片段,预期片段大小为2 112 bp。PCR反应程序为:94℃预变性5 min;94℃30 s,68℃55 s,72℃2 min,35个循环;72℃延伸10 min;4℃10 min。将扩增的fliC-F基因经3 mol/L NaAc、无水乙醇沉淀后回收,用EcoRⅠ和HindⅢ双酶切目的片段以及载体pET30a+后,分别回收目的片段及载体,4℃过夜连接。将连接产物转化感受态DH5α,以卡那霉素抗性筛选,并经EcoRⅠ和HindⅢ双酶切鉴定,选酶切结果与预期相符的质粒送宝生物工程(大连)有限公司进行序列测定,测序正确的重组质粒命名为pET-fliC-F。
1.2.3 fliC-F基因的原核表达及可溶性鉴定
1.2.3.1 重组菌的构建 将鉴定正确的重组质粒pET-fliC-F转化大肠埃希菌(Escherichia coli)BL21(DE3),经卡那霉素抗性筛选后,挑取单个克隆进行PCR鉴定,将鉴定正确的重组菌命名为BL21(DE3)(pET-fliC-F)。
1.2.3.2 重组菌表达及目的蛋白表达形式的鉴定将 BL21(DE3)(pET-fliC-F)小量接种含50 μ g/mL卡那霉素的液体LB培养基,取过夜培养的新鲜菌液1∶100扩大培养,37℃振摇培养至OD600为 0.4~0.5,加入终浓度为 0.5 mmol/L IPTG进行诱导表达。诱导产物裂解后离心,取沉淀和上清。将诱导产物、诱导产物裂解沉淀和上清进行SDS-PAGE分析。
1.2.4 表达产物的提取及纯化
1.2.4.1 包涵体的获得 将600 mL诱导表达的重组菌BL21(DE3)(pET-fliC-F)培养物离心后收集沉淀。无菌PBS洗涤3次,用变性液(20 mmol/L T ris-HCl,50 mmol/L NaCl,1 mmol/L EDTA,1 mol/L尿素,5 mL/L Triton-100,pH 8.0)重悬 ,在冰浴条件下超声裂解,于4℃以10 000 r/min离心15 min,收集沉淀,即为粗制包涵体。用相同体积的变性液重悬,超声洗涤 20 min,于 4 ℃以10 000 r/min离心15 min收集沉淀。将包涵体按此步骤重复洗涤3次。
1.2.4.2 表达产物的变性复性 将包涵体溶解于变性缓冲液(6 mol/L盐酸胍,50 mmol/L Tris-HCl,5 mmol/L EDTA,50 mmol/L DT T,pH 8.5),37℃振摇4 h,12 000 r/min离心25 min,小心吸取上清液,弃去沉淀。在冰浴条件下将上清用复性缓冲液1(50 mmol/L Tris-HCl,1.5 mol/L尿素,50 mmol/L NaCl,1 mmol/L EDTA,50 mL/L甘油,pH 8.0)稀释;然后用复性缓冲液2(20 mmol/L T ris-HCl,50 mmol/L NaCl,1 mmol/L EDTA,50 mL/L甘油,pH 8.0)透析,每隔12 h换一次透析液,换 3次 ~4次即可。溶液充分透析后用PEG8000浓缩即可获得复性蛋白。
1.2.5 Western blot分析 将诱导表达的BL21(DE3)(pET30a+)和 BL21(DE3)(pET-fliC-F)经SDS-PAGE电泳后,将蛋白转印到PVDF膜上,用含100 mL/L小牛血清的PBST 4℃作用12 h;PBST洗涤3次后,将PVDF膜分为两组,分别以实验室自制的小鼠抗F蛋白多抗血清和fliC蛋白多抗血清作为一抗(均以1∶200稀释)作用1.5 h,充分洗涤后以 HRP标记的羊抗鼠IgG作为二抗(1∶1 000稀释)作用1 h,PBST洗涤3次后,DAB显色,蒸馏水终止反应,观察结果,拍照记录。
1.2.6 fliC-F融合蛋白的免疫原性检测
1.2.6.1 小鼠免疫 6周龄~8周龄雌性C3H/HeJ小鼠分为5组,每组5只,分别为F蛋白免疫组、fliC蛋白免疫组、F蛋白油乳剂免疫组、fliC-F蛋白免疫组和空白对照组。免疫途径为皮下注射,免疫分两次进行,首免后间隔10 d进行二免,蛋白免疫剂量均为100 μ g/只。F蛋白油乳剂免疫组首免加完全福氏佐剂,二免加不完全福氏佐剂进行免疫,空白对照组以PBS替代。
1.2.6.2 抗体测定 各免疫组在一免后第10天,二免后第14、21天分别眼眶静脉采血,收集血清样品,置-20℃保存备用。参照潘志明等[7]建立的ELISA 方法,纯化的NDV F蛋白每孔2 μ g包被,待检血清作1∶160稀释,酶标仪测定OD490值,各试验组OD490值(P)与空白对照组OD490值(N)的比值(P/N)大于2.1时判定为阳性。
2 结果
2.1 fliC-F基因的PCR扩增结果
按照1.2中PCR扩增方法,分别用相应模板及引物扩增出fliC、F、fliC-F片段,大小分别为1 507、620、2 112 bp,与预期结果相符(图1)。
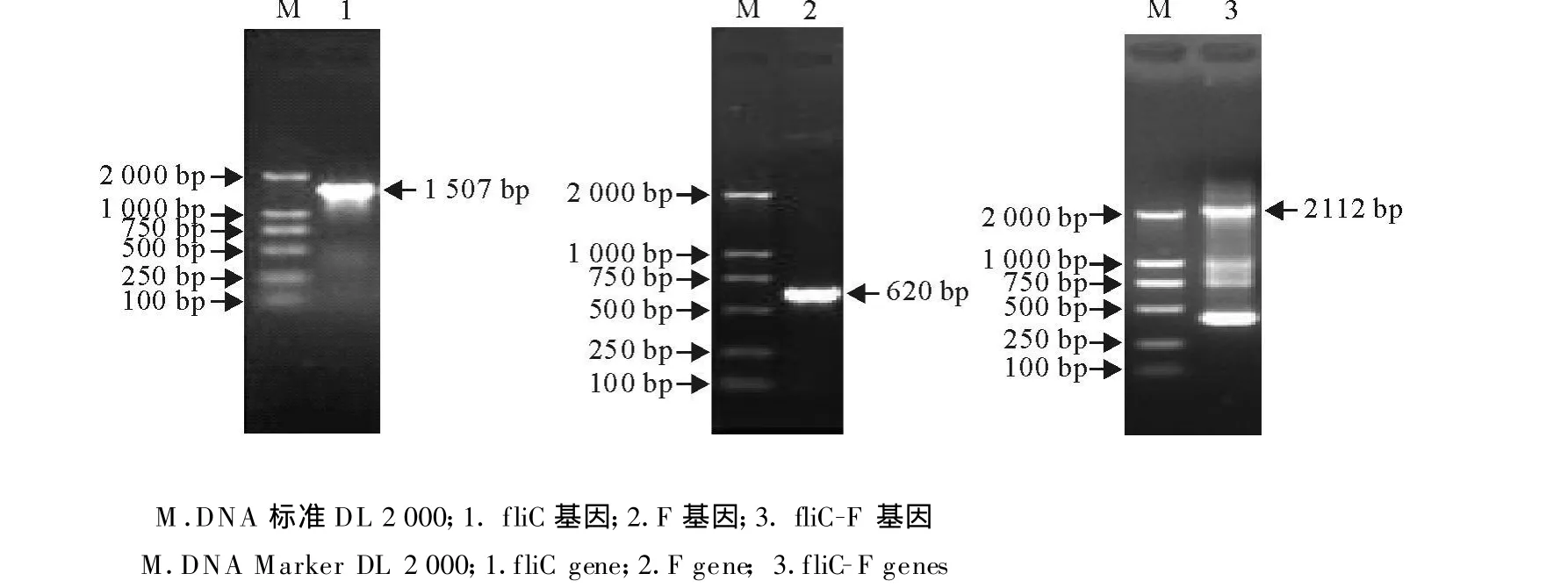
图1 fliC、F、fliC-F基因PCR扩增结果Fig.1 PCR amplification of fliC,F and fliC-F genes
2.2 重组原核表达质粒pET-fliC-F的构建结果
分别将fliC-F PCR产物及原核表达载体pET30a+用EcoR Ⅰ和HindⅢ进行双酶切,回收后连接,获得重组质粒pET-fliC-F。重组质粒再经EcoR Ⅰ和HindⅢ双酶切后电泳,出现约2 112 bp的插入片段和5 400 bp的载体片段(图2),与预期结果相符,说明fliC-F基因已被正确插入表达载体pET30a+。序列测定结果表明,扩增的fliC-F基因没有发生碱基突变。
2.3 重组菌BL21(DE3)(pET-fliC-F)的构建结果
将重组质粒 pET-fliC-F转化表达菌BL21(DE3),筛选的阳性转化子命名为BL21(DE3)(pET-fliC-F),经PCR扩增出的fliC-F基因片段大小约2 112 bp(图3),与预期结果相符,说明重组原核表达质粒pET-fliC-F已成功导入宿主菌BL21(DE3)。
2.4 fliC-F基因表达产物的鉴定结果
挑取重组菌BL21(DE3)(pET-fliC-F)单个克隆经IPTG诱导表达,诱导产物经SDS-PAGE分析,结果表明fliC-F基因在大肠埃希菌中获得较好表达,融合蛋白大小为79.3 ku,且可溶性和包涵体两种表达形式均存在(图4)。
2.5 包涵体的分离及变性、复性结果
按1.2.4方法对BL21(DE3)(pET-fliC-F)表达产物进行变性、复性、透析和浓缩后,测定蛋白含量为1.3 mg/mL,共获得复性蛋白9.1 mg。SDSPAGE结果显示,杂蛋白较少,纯化效果良好(图5)。

图2 重组质粒pET-fliC-F的酶切鉴定结果Fig.2 Identification of pET-fliC-F by endonuclease digestion
图3 重组菌BL21(DE3)(pET-fliC-F)的PCR鉴定结果Fig.3 Identification of BL21(DE3)(pET-fliC-F)by PCR

图4 重组菌BL21(DE3)(pET-fliC-F)的诱导表达分析Fig.4 Induced expression of recombinant pET-fliC-F in BL21(DE3)

图5 复性fliC-F蛋白检测Fig.5 Identification of the refolded fliC-F protein
2.6 Western blot分析结果
Western blot结果表明,小鼠抗F蛋白或抗fliC蛋白多抗血清均能识别经IPTG诱导表达的重组菌在79.3 ku位置的特异性条带,这与表达的融合蛋白fliC-F的大小相符(图6)。

图6 Western blot分析fliC-F融合蛋白Fig.6 Western blot analysis of the fusion protein fliC-F
2.7 F蛋白特异性血清抗体效价测定结果
一免后第10天fliC-F蛋白免疫组和F蛋白油乳剂免疫组与空白对照组的OD490值P/N<2.1,二免后第14、21天二者与空白对照组的P/N值大于2.1。而F蛋白免疫组和fliC蛋白免疫组在一免后第10天,二免后第14、21天与空白对照组的P/N值均小于2.1。试验数据表明,fliC-F蛋白免疫组和F蛋白油乳剂免疫组均产生了F蛋白特异性血清抗体(表1)。

表1 F蛋白特异性血清抗体效价测定结果Table 1 The values of serum antibody against F protein
3 讨论
近年,新城疫在全国范围内的发生仍然比较普遍,对于该病的预防控制主要是使用常规疫苗,如各种不同毒力的弱毒疫苗和油乳剂灭活疫苗。常规疫苗效果确实,但也存在一定隐患,如病毒毒力返强和灭活不彻底所带来的危害。除了常规疫苗外,亚单位疫苗也是一个有效的免疫预防手段。
鞭毛蛋白作为天然免疫应答的诱导剂,诱导产生的天然免疫应答可帮助建立针对外源抗原的获得性免疫应答。T LR5配体鞭毛蛋白作为免疫佐剂具有其优越性,如鞭毛蛋白对宿主不会产生超敏反应;低剂量即能发挥效应;活化APCs的功能显著,并可同时增强APCs对外源抗原的摄取、加工和递呈能力;预先存在的鞭毛蛋白抗体不会影响其佐剂活性等。应用沙门菌鞭毛蛋白与耶尔森菌、西尼罗病毒、单核增生李斯特菌、流感病毒、疟原虫等保护性抗原或表位构成的融合蛋白,以注射或黏膜途径免疫接种小鼠,小鼠均产生了显著的全身性免疫应答,并提供强毒攻击的免疫保护[8-13]。
在前期的研究中,我们已经证实了NDV F部分蛋白的免疫原性[14]。在此基础上,本文利用鞭毛蛋白的免疫佐剂效应的特点,融合表达鞭毛蛋白与F蛋白基因,以鞭毛蛋白作为佐剂,观察机体激发产生针对F蛋白特异性的免疫应答。
在本试验中,为了保证鞭毛蛋白与F蛋白在融合表达后可以独立折叠,形成互不干扰的空间结构,我们设计引物,通过重叠延伸PCR技术将二者基因片段通过一段氨基酸序列为GGGGSGGGGS的linker串联起来,插入原核表达载体pET30a+中,利用原核表达系统成功获得了表达。Western blot试验结果表明,小鼠抗F蛋白或fliC蛋白多抗血清均能特异性识别该表达产物,证实了二者能基本独立地形成各自的天然结构。
动物试验结果显示,fliC-F蛋白免疫组和F蛋白油乳剂免疫组二免后第14、21天与空白对照组在血清稀释度为1∶160时,OD490值P/N>2.1,而F蛋白免疫组和fliC蛋白免疫组的P/N值则小于2.1。由此可以推断,本试验原核表达的fliC-F蛋白能够发挥fliC蛋白的免疫佐剂活性,刺激C3H/HeJ小鼠产生针对F蛋白的特异性血清抗体。
本研究建立了 fliC-F融合蛋白的原核表达体系,并对表达蛋白的免疫原性做了初步的探索,表明该融合蛋白具有良好的免疫原性,下一步将探讨该融合蛋白对鸡NDV强毒攻击的免疫保护力,以期为新城疫疫苗的研究提供新思路。
[1]张桂芝,陈亚波,徐 程,等.新城疫病毒F蛋白结构域基因原核表达与抗原表位分析[J].浙江大学学报,2006,32(1):82-87.
[2]Janeway C A.Approaching the asymptote evolution and revolution in immunology[J].Cold Spring Harbor Symposium on Quant Biol,1989,54(1):1-13.
[3]Leulier F,Lemaitre B.Toll-like receptors taking an evolutionary approach[J].Nat Rev Genet,2008,9(3):165-178.
[4]Akira S,Uematsu S,Takeuchi O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-801.
[5]Iwasaki A,Medzhitov R.Toll-like receptor control of the adaptive immune responses[J].Nat Immunol,2004,5(10):987-995.
[6]Cuadros C,Lopez-Hernandez F J,Dominguez A L,et al.Flagellin fusion proteins as adjuvants or vaccines induce specific immune responses[J].Infect Immun,2004,72(5):2810-2816.
[7]潘志明,黄金林,程宁宁,等.稳定携带新城疫病毒DNA疫苗减毒沙门氏菌的构建及其免疫原性[J].病毒学报,2008,24(1):41-46.
[8]Honko A N,Sriranganathan N,Lees C J,et al.Flagellin is an effective adjuvant for immunization against lethal respiratory challenge withYersinia pestis[J].Infect Immun,2006,74(2):1113-1120.
[9]McDonald W F,Huleatt J W,Foellmer H G,et al.A West Nile virus recombinant protein vaccine that coactivates innate and adaptive immunity[J].J Infect Dis,2007,195(11):1607-1617.
[10]Huleatt J W,Jacobs A R,Tang J,et al.Vaccination with recombinant fusion proteins incorporating Toll-like receptor ligands induces rapid cellular and humo ral immunity[J].Vaccine,2007,25(4):763-775.
[11]Huleatt J W,Nakaar V,Desai P,et al.Potent immunogenicity and efficacy of a universal influenza vaccine candidate comprising a recombinant fusion protein linking influenza M2e to the T LR5 ligand flagellin[J].Vaccine,2008,26(2):201-214.
[12]Bargieri D Y,Rosa D S,Braga C J,et al.New malaria vaccine candidates based on thePlasmodium vivaxmerozoite surface protein-1 and the T LR-5 ag onistSalmonella ty phimuriumfliC flagellin[J].Vaccine,2008,26(48):6132-6142.
[13]潘志明,蔡雯婷,刘 萌,等.Toll样或非 Toll样配体佐剂研究进展[J].动物医学进展,2007,28(11):54-58.
[14]游 猛,潘志明,耿士忠,等.新城疫病毒F基因在大肠杆菌中的高效表达及其免疫原性分析[J].中国家禽,2009,31(20):21-24.
Coexpression of flic Protein ofSalmonella typhimuriumand F Protein of NDV and Its Immunogenicity Analysis in Mice
YOU Meng,PAN Zhi-ming,GENG Shi-zhong,MA Quan-gang,FANG Qiang,JIAO Xin-an
(J iangsu Key Laboratory of Zoonosis,Yangzhou University,Y angzhou,J iangsu,225009,China)
The fliC gene ofSalmonella ty phimuriumand the partial fragment of fusion protein(F)gene of Newcastle disease virus were amplified using PCR and ligated with a DNA sequence encoding a flexible peptide(Gly4Ser)2.The fusion gene was inserted into plasmid pET30a+to construct the recombinant prokaryotic expression plasmid pET-fliC-F.Then the recombinant plasmid was transformed intoE.coliBL21(DE3)and induced to express the desired fliC-F protein.Western blot analysis showed that the fliC-F protein could react with murinal antiserum against fliC or F protein,respectively.It indicated that the fusion protein could significantly elicit specific immune response in immunized C3H/HeJ mice.These results demonstrated that the fliC-F fusion protein expressed byE.colihad good immunogenicity.
Salmonella typhimurium;fliC protein;Newcastle disease virus;fusion protein;immunogenicity
S852.659.5;S852.612
A
1007-5038(2010)02-0020-06
2009-09-15
国家自然科学基金资助项目(30871860);高等学校科技创新工程重大项目(706032);江苏省自然科学基金项目(BK2007511,BK2008011);江苏省高校自然科学基础研究项目(07KJB230136);江苏省高校“青蓝工程”项目
游 猛(1985-),男,江苏姜堰人,硕士研究生,主要从事细胞与分子免疫学研究。*通讯作者

