基于对羟基桂皮醇的新型酶联荧光免疫传感系统测定布氏杆菌抗体
湛雪辉,周随安,龚福春,李飞,曹芬,李侠
(长沙理工大学 化学与生物工程学院,湖南 长沙,410076)
由于酶联免疫分析方法结合了酶的催化放大和免疫反应的特异性,具有分析灵敏度高和选择性好的特点,在实际中得到了广泛应用。基于辣根过氧化物酶(HRP)的酶联免疫分析是其中应用最成功的方法之一[1-5],该方法通常利用 HRP标记抗体/抗原,通过HRP催化H2O2氧化酶底物,生成不同二聚或多聚产物如醌式或偶氮类物质等。然后,采用分光光度、电化学或化学/电化学发光等方法测定酶催化产物的光/电信号,间接测定抗体/抗原或半抗原。因此,HRP酶底物体系决定了所选择方法的灵敏性、检测限及稳定性等性能。目前,HRP主要底物有苯二胺类[6]、氨基酚类[7]、联苯胺类[8]以及由苯胺类衍生出来的一些偶氮染料[9]等,但是,这些底物存在以下不足:(1) 稳定性差,多数见光或在空气中极易被氧化,底物保存困难,一般只能现配现用;(2) H2O2单独氧化底物的信号强,体系背景信号较强;(3) 有的底物或反应产物对人类身体有毒害作用[10-11],如偶氮染料、苯胺和苯二胺等。针对上述问题,本文作者对 HRP 底物进行研究。以兔布氏杆菌抗体为分析对象,建立了以对羟基桂皮醇为 HRP 底物的酶联荧光免疫分析方法。该方法由于将 ELISA方法的酶的积累放大作用与荧光检测相偶联,与电化学方法和紫外-可见光度法相比灵敏度有较大提高。这种方法初步用于血清样品测定,结果与其他方法所得结果相吻合,可以满足临床分析的要求。
1 实验
1.1 仪器
HITACHI F4500荧光光谱仪,用于荧光测定;江苏产蠕动泵,用于产生水流;重庆产CSS501型恒温水浴槽,用于控制培育温度。
1.2 试剂
辣根过氧化物酶(HRP,编号为EC 1.11.1.7, 比活力 RZ>3)和对羟基桂皮醇(4-hydroxylcinnamic alcohol,HCA),购于Sigma公司;微晶纤维素和石蜡,购于上海化学试剂公司;布氏杆菌抗原(BrAg)和布氏杆菌抗体(BrAb),由湖南省生物与机电职业技术学院提供;1.00 mmol/L 对羟基桂皮醇储备液:将2.31 mg对羟基桂皮醇(Sigma公司)溶于100 mL无水乙醇中,避光保存,使用时用pH=6.8的B-R 缓冲液稀释。本实验所用的其他溶液用二次蒸馏水制备。
1.3 酶标抗体(HRP-BrAb)的制备
在10 mL pH值为6.8的磷酸缓冲溶液(PBS)中加入适量的HRP(3.5 mg)和2 mL 体积分数为1%的戊二醛,充分混合,在室温下培育12 h。将得到的溶液在温度为4 ℃、浓度为10 mmol/L PBS和0.15 mol/L NaCl溶液(pH为7.2)中透析过夜。将溶解在1 mL pH值为9.6的由0.15 mol/L NaCl和0.1 mol/L Na2CO3组成的溶液中的BrAb(5 mg)与渗析过的HRP-戊二醛溶液混合,在4 ℃培育24 h。得到的溶液在10 mmol/L,pH值为7.2的PBS中透析。用Sephadose G-200柱凝胶过滤进一步纯化,即得HRP-BrAb连结物(0.48 g/L),于4 ℃储存备用。
1.4 布氏杆菌抗原的固定
取5.5 mg BrAg和12 mg牛血清白蛋白(BSA)溶解在1.5 mL pH值为7.0的冷PBS中(4 ℃),该溶液与0.9 g微晶纤维素粉充分混合,然后,将混合物置于干燥器中于4 ℃干燥。将吸附有BrAg-BSA的干粉与石蜡按质量比1∶1混合(石蜡事先溶解在乙醚中),待乙醚挥发后(约5 min),将得到的糊状物挤压进直径为6 mm的聚氯乙烯(PVC)管中,管另一端是旋转螺帽。生物组分—纤维素—石蜡支撑体的结构如图1(a)所示。
1.5 生物组分—纤维素—石蜡支撑体的再生
通过旋转螺帽使纤维素—石蜡—生物组分复合物层挤出约0.1 mm,用水润湿后在三氧化二铝砂纸(0.05µm)上抛光,用二次蒸馏水冲洗即可获得更新的表面。
1.6 测定步骤
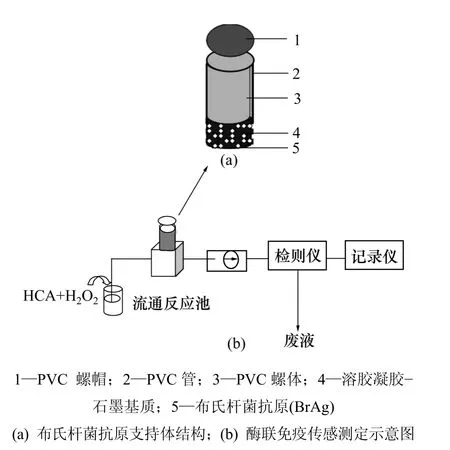
图1 布氏杆菌抗体测定传感体系Fig.1 Configuration of biocomposite support body and schematic diagram of injection system coupling with fluometry
酶联荧光免疫分析程序如图1(b)所示,操作步骤如下:第1步,将更新后的支撑体A放在5 mL含有100 µL HRP-BrAb(0.48 mg/L)和不同体积的 BrAb(分析物)组成的缓冲溶液(质量分数为 0.1% 的BSA,pH=7.5,0.1 mmol/L Tris-HCl)中培育30 min;第2步,培育后的支撑体用缓冲液(0.1 mol/L Tris-HCl-KCl,pH=7.5)充分冲洗,荧光测定前储存在相同的缓冲液中;将处理好的支撑体安装到流通反应池中。
含有2.5×10-7mol/L HCA底物溶液通过蠕动泵泵入反应池,测定激发光波长为315 nm 时467 nm 处HCA的荧光,加入一定量的 5×10-7mol/L H2O2于HCA溶液中,当含有HCA和H2O2的底物溶液流过支撑体表面时,连接在支撑体表面的 HRP-BrAb-BrAg复合物中的HRP催化H2O2氧化HCA,使一部分HCA转化为强荧光的物质。通过测定 HCA底物溶液荧光强度的变化可定量测定样品中的BrAb。
2 结果与讨论
2.1 酶催化反应机理及定量基础
对羟基桂皮醇(4-hydroxycinnamic alcohol,HCA)是广泛存在于植物体内的天然活性成分,其中以肉桂皮和紫苏油含量较高,它在植物体中通过氧化可以形成木脂素,还起到抗氧化作用[12-13]。本研究中将HCA用作HRP底物,在BrAb测定中起信号分子的作用,以HCA为底物的酶催化反应机理与文献[14-16]中报道的类似,可以表示为如图2所示机理:HCA只有很弱的荧光,当HRP催化H2O2氧化HCA时,生成自由基中间体,然后2个含自由基的中间体转化为二聚体产物(强荧光物质),体系荧光强度增加。
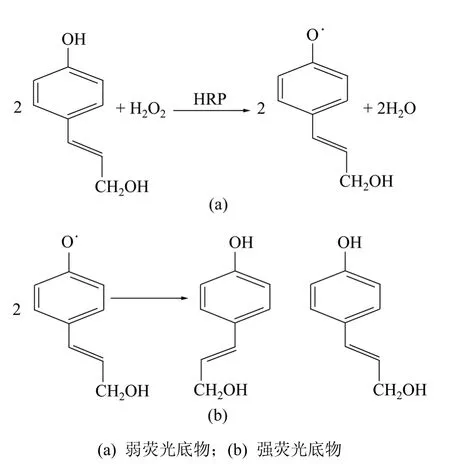
图2 酶催化反应机理Fig.2 Mechanism of HRP-catalyzed reaction
在竞争免疫反应分析过程中,分析样品中的BrAb和加入的标准溶液 HRP-BrAb竞争结合到固定的BrAg上。连接到支持生物组分表面的HRP-BrAb的量与分析样品中 BrAb的量成反比,因此,样品中BrAb(分析物)浓度与HCA溶液荧光强度增加成反比。这就是本方法进行免疫分析测定BrAb的基础。
对 HCA-HRP-H2O2反应体系的荧光特性进行研究,结果表明:底物HCA在312 nm处仅有1个极弱的荧光发射峰(激发峰为 299 nm)。图 3所示是HRP-BrAb催化H2O2氧化HCA的荧光光谱图,可以看出:在底物HCA溶液中加入HRP-BrAb和H2O2后,酶产物在467 nm处有1个较大的荧光发射峰(激发波长为315 nm),且在一定范围内荧光增加与HRP-BrAb呈线性相关。
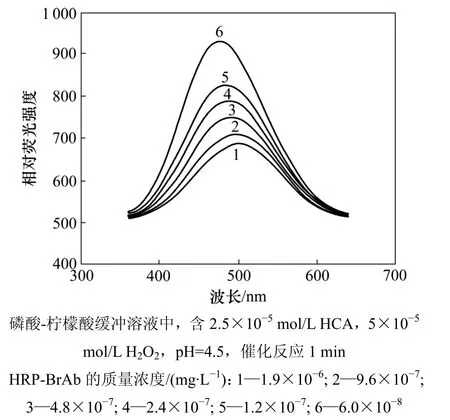
图3 HRP-BrAb催化H2O2氧化HCA的荧光光谱Fig.3 Fluorescence spectra of HCA solution catalyzed by HRP-BrAb
2.2 降低支撑体表面非特异性吸附方法
因抗原抗体间的结合力较强,免疫传感体系实际应用的主要障碍之一是生物反应表面再生困难。使用微纤维素-石蜡吸附和包埋 BrAg除了有利于保持活性外,支持体表面可通过简单的抛光得到更新。为了降低HRP-BrAb与支持体表面的非特异性吸附,加入BSA可以占据微纤维素-石蜡基质多余的位点。微纤维素对HRP-BrAb和BrAb生物分子有相容性,有利于免疫反应。对微纤维素(Cellulose)与石蜡(paraffin)的质量比进行研究,表1所示是采用不同比例的纤维素和石蜡制备生物组分支持体获得的荧光强度。由表1可知:在生物复合物中加入质量分数为 0.1% BSA能降低HRP-BrAb在支持体表面的非特异性吸附,表明BSA能与BrAb和 HRP-BrAb竞争占据基质表面的多余位点。实验还表明:增加纤维素含量有利于提高一定量HRP-BrAb引起的荧光响应,但所记录的信号不稳定。故本研究中纤维素/石蜡的质量比选定为1∶1。

表1 BSA对荧光强度的影响Table 1 Effect of BSA on fluorescence intensity
2.3 溶液pH的影响
除 HCA溶液本身的荧光强度易受 pH影响外,HRP-BrAb的活性和HRP-Ab-Ag复合物增加值的稳定性也受pH的影响。对pH对HCA溶液本身的荧光强度的影响进行研究,结果显示:pH<6时,荧光强度随pH增加而增加,pH>6时,呈下降趋势。这可能是pH影响了HCA基态和激发态的平衡的原因。
对pH对HRP-BrAb的催化作用及HRP本身的影响也进行了研究,结果如图4所示。可见:HCA酶催化反应的产物在可见区315 nm处有吸收峰,通过测定315 nm处的吸收峰可以估计酶催化反应活性;HRP-BrAb催化产物对紫外光的吸收随 pH增加而增加,至pH=5.5时趋于稳定,在更高pH下,吸收趋于下降,表明催化反应的最佳pH为5.5,这与HRP直接催化反应的最佳pH略有不同(pH=5.0),可能是HRP与带电荷的BrAb交联后使HRP-BrAb带更多正电致使 pH低于酶反应的原始pH的缘故。但pH太低不利于BrAb与BrAg的紧密结合,当底物溶液流过生物复合物的表面时,将导致HRP-BrAb损失。因此,本研究中采用的pH为5.5。
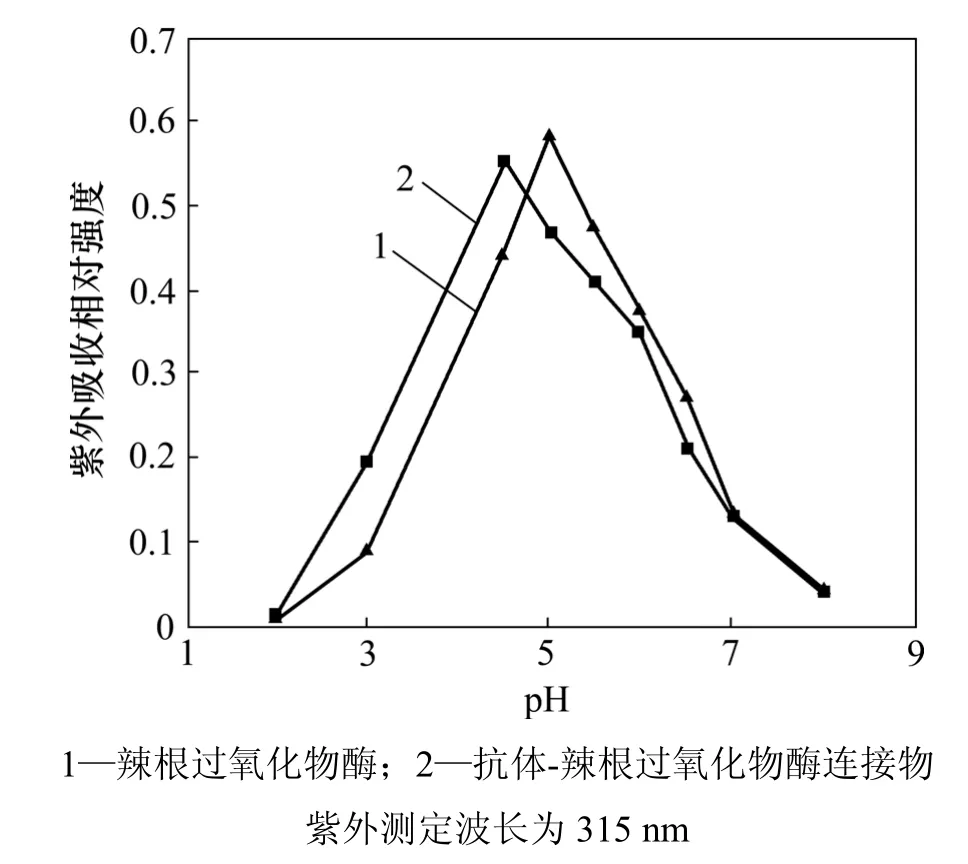
图4 pH对酶活性的影响Fig.4 Effect of pH on activity of HRP
2.4 流速对荧光强度的影响
当HCA和H2O2被连续传送到流通反应池中时,HCA和H2O2与HRP-BrAb接触并发生反应,使测量体系荧光信号发生变化,底物的流动速度直接影响HCA和H2O2与HRP-BrA接触机会。如图5所示:底物溶液流速越低,荧光信号增加越大,但流速过低会使分析时间延长。本实验中采用的流速为30 mL/h。
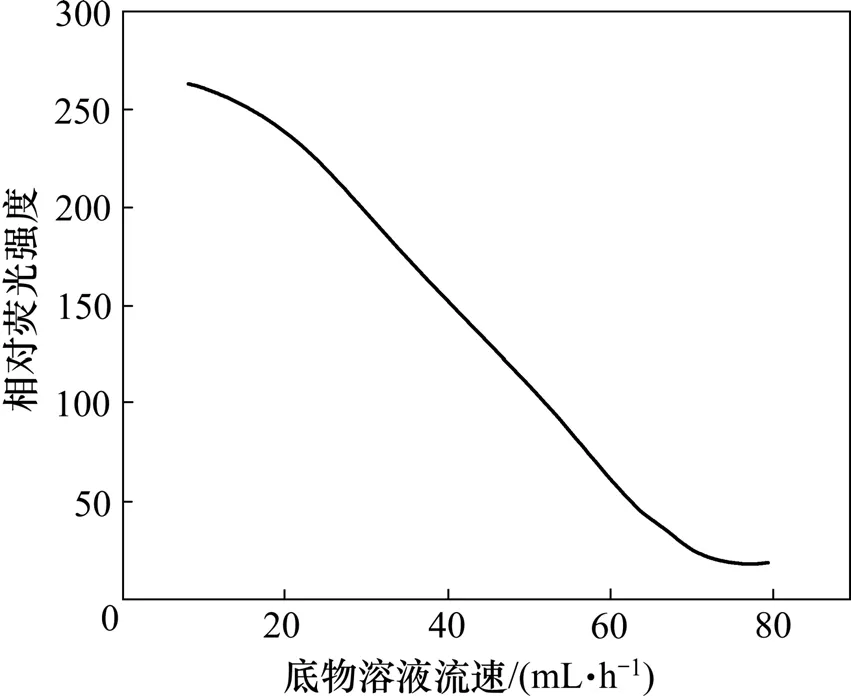
图5 底物溶液流速对荧光的影响Fig.5 Effect of flow rate of substrate carrier solution on fluorescence
2.5 实验参数的优化
图6 所示为HRP-BrAb的用量对荧光强度的影响。可见:在5 mL包含有不同浓度的HRP-BrAb的培育液中,响应随HRP-BrAb用量的增加而增加,至100 µL HRP-BrAb(0.48 mg/L)后趋于饱和。这是因为免疫传感器表面抗原结合位点的量是有限的。因此,本实验采用在5 mL培育液中加入100 µL HRP-BrAb为基本工作液。实验表明:最佳培育温度为 27 ℃,最佳培育时间为30 min。
2.6 传感装置的应用
图7为测定BrAb的校正曲线。由图7可知:底物溶液荧光强度和培育液中的 BrAb呈相关性,线性范围为2.7~90 μg/L,检测限为2.7 μg/L。此方法的检测限低于用压电免疫传感方法的检测限(7.2 μg/L)。
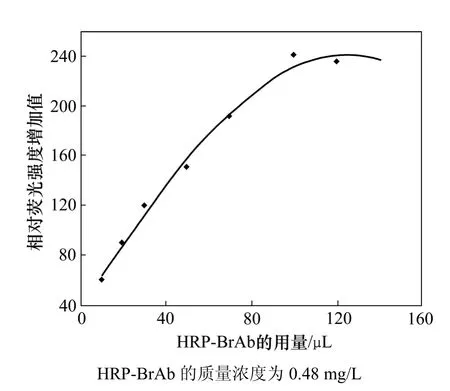
图6 HRP-BrAb用量对荧光强度的影响Fig.6 Effect of amount of HRP-BrAb on fluorescence strength

图7 BrAb测定的工作曲线Fig.7 Calibration curve for BrAb determination obtained by competitive immunoassay
以质量浓度为55 mg/L的BrAb作标准溶液测定此方法的重现性,结果和标准偏差见表2。由表2可知:该免疫传感体系的重现性较高。

表2 免疫传感方法的重现性Table 2 Reproducibility of immunosensing system
表2 Ⅰ组中的每一个数值代表1个生物组分支持体表面经过抛光、培育和荧光测定步骤后所测得的荧光增加值;培育中BrAb 的质量浓度为0.055 g/L。表2 Ⅱ组为用不同生物组分支持体的测定值。即用过的支持体在存放时间为1.5月后的更新表面的测定值。使用次数为68次,累计使用时间79 h(温度为27 ℃)。
制备的免疫传感装置用于检测被感染的兔血清样品(湖南生物机电职业技术学院提供),结果见表3。由表3可知:用此方法测定的结果与ELISA法测定的结果较吻合。所以,此法可用于检测血清样品中的BrAb。
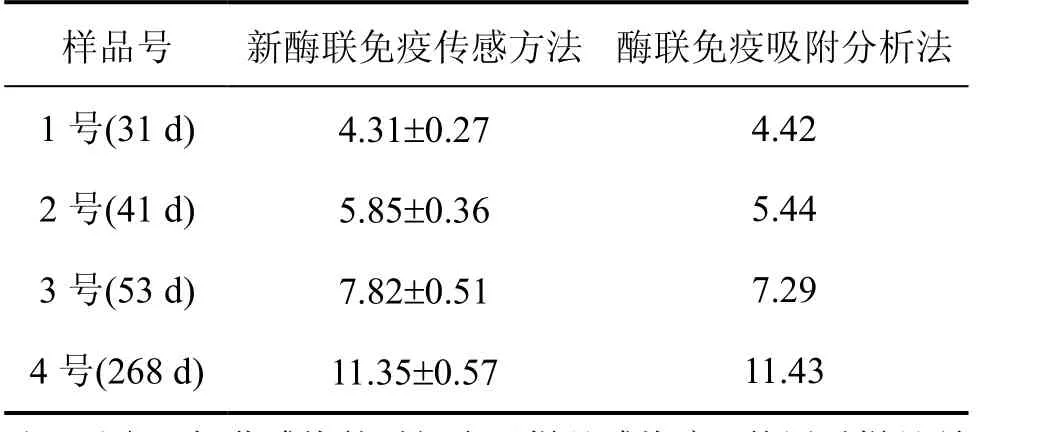
表3 兔血清样品中BrAb含量的测定Table 3 BrAb determination in rabbit serum samples µg/L
3 结论
基于新底物对羟基桂皮醇的酶联荧光免疫分析方法与传统测定 BrAb的免疫分析方法相比,具有较大优势:
(1) 实现了酶联荧光免疫传感测定BrAb,灵敏度提高,实验步骤大大简化。
(2) 可进行支持生物组分表面更新,分析成本降低。
(3) 微纤维素-石蜡基质直接包埋完整细菌方法简单,有利于布氏杆菌抗原活性的保持。
(4) 新底物为天然产物,对人体无毒害作用。这种方法对其他免疫试剂测定也有借鉴作用。
[1] Engvall E, Perlmann P. Enzyme-linked immunosorbent assay(ELSIA) quantitative assay of immunoglobulin G[J].Immunochemistry, 1971, 8(5): 871-874.
[2] Carlo M D, Mascini M. Enzyme immunoassay with amperometric flow-injection analysis using horseradish peroxidase as a label. Application to the determination of polychlorinated biphenyls[J]. Anal Chim Acta, 1996, 33(6):167-174.
[3] Takatoshi S, Masanori Y, Hiroya I, Kiyoshi M. Flow injection analysis of amitrole by chemiluminescent immunosensor using alkaline phosphatase and adamantyl methoxyphosphoryloxy phenyldioxetane[J]. Anal Sci, 2001, 17(5): 1407-1410.
[4] Hossein S, Martin G S, Oliver H, et al. Development of enantioselective chemiluminescece flow- and sequential injection immunoassays for α-amino acids[J]. J Biochem Biophys Methods, 2002, 53(1): 1-14.
[5] Villarta R L, Guilbault G G, Suleiman A A. Flow injection analysis of glucose by fibre optic chemiluminescence measuremen[J]. Anal Lett, 1993, 26(4): 1493-1503.
[6] Lonergan G, Mew E, Schliephake K, et al. Phenolic substrates for fluorometric detection of laccase activity[J]. FEMS Microbiol Lett, 1997, 153(2): 485-490.
[7] Ci Y X, Chen L, Wei S. Fluorescence reaction of the system mimetic peroxidase [Mn-T(4-TAP)P]-homovanillic acidhydrogen peroxide. Spectrofluorimetric determination of H2O2[J].Fresenius’ J Anal Chem, 1989, 33(4): 124-129.
[8] Gong F C, Zhou Z J, Shen G L, et al. Schistosoma japonicum antibody assay by immunosensing with fluorescence detection using 3,3’,5,5’-tetramethylbenzidine as substrate[J]. Talanta,2002, 58(2): 611-618.
[9] Chen L, Chang W B. Studies on the structure of substrate for peroxidase[J]. Chemical Research in Chinese Universities, 1995,16(5): 683-687.
[10] Tatyana V V, Ian J R. Detection of hydrogen peroxide with Amplex Red: interference by NADH and reduced glutathione auto-oxidation[J]. Archives of Biochemistry and Biophysics,2004, 43(1): 138-144.
[11] Michel P E, Rooij de N F, Koudelka-Hep, et al. Redox-cycling type electrochemiluminescence in aqueous medium. A new principle for the detection of proteins labeled with a ruthenium chelate[J]. J Electroanal Chem, 1999, 47(4): 192-194.
[12] Lee H S. Tyrosinase inhibitors of Pulsatilla cernua root-derived materials[J]. J Agri Food Chem, 2002, 50(6): 127-132.
[13] Zapata J M, Calderón A A, Muñoz R, et al. Oxidation of natural hydroxybenzoic acids by grapevine peroxidases: kinetic characteristics and substrate specificity[J]. Am J Enol Vitic, 1992,43(1): 134-138.
[14] Beier R C, Young C R, Stanker L H. USDA agricultural research service, detection of bacteria from a cecal anaerobic competitive exclusion culture with an immunoassay electrochemiluminescence sensor[J]. Proc SPIE, 1991, 35(44): 10-20.
[15] Tuuminen T, Palomaki P, Rakkolainen A, et al. 3-phydroxyphenylpropionic acid-a sensitive fluorogenic substrate for automated fluorometric enzyme immunoassays[J].Immunoassay, 1991, 12(1): 29-46.
[16] Limoges B, Degrand C, Brossier P, et al. Homogeneous electrochemical immunoassay using a persulfonated ionomermodified electrode as a detector for a cationic labeled hapten[J].Anal Chem, 1993, 65(3): 1054-1060.

