抗bFGF抗体对肺纤维化模型的干预作用*
穆建琴 ,魏路清
(1.武警医学院附属医院呼吸科,天津 300162;2.新疆阿克苏武警兵团指挥部,阿克苏 843000)
肺纤维化是以肺间质炎性细胞浸润、成纤维细胞增生和胶原蛋白沉积为特征的慢性炎症性疾病。发病机制尚不十分清楚,临床上缺乏有效的治疗手段。因此,探索新的治疗方法或治疗途径是目前亟待解决的问题。目前肺纤维化的研究已经趋向于多因子,多因素的综合研究。研究发现肺纤维化的起始阶段表现为肺泡炎,此时大量炎性细胞向肺内浸润、活化,释放多种细胞因子,形成瀑布效应,激活多种细胞,诱导肺成纤维细胞活化、增殖和分泌胞外基质,最终形成肺纤维化。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是一种重要的多肽生长因子,也是FGF家族中原型成员之一。随着对细胞因子在特发性肺纤维化发病中作用认识的逐渐深入,有研究[1]发现bFGF在纤维化的肺组织、血清、肺泡灌洗液中有高表达并呈正相关,这提示bFGF表达增强与肺纤维化关系密切,本研究采用博莱霉素气管内注入,复制肺纤维化动物模型,抗bFGF抗体进行干预,通过HE染色观察肺泡炎和Masson染色观察肺纤维化 ,检测肺组织、血清及肺泡灌洗液(BALF)中bFGF的变化,探索抗纤维化作用的机制与抗bFGF抗体中和bFGF抑制其表达的关系。
1 材料与方法
1.1 动物和试剂
Wistar大鼠购自军事医学科学院动物所。盐酸氯胺酮(福建古田药业有限公司),0.1 g。博莱霉素(A5,批号051003,天津太河制药有限公司生产),8 mg。抗bFGF抗体(购于北京赛驰生物公司),0.5 ml(效价1∶12500)。bFGF定量酶免疫测定(ELISA)试剂盒,购于河北博海生物公司。
1.2 动物模型的建立[2]和实验分组
选择雌性Wistar大鼠30只,体重180~250g,按照随机数字表法将大鼠随机分为3组(n=10):(1)对照组(C组);(2)模型组(M组);(3)抗bFGF抗体组(K组)。以盐酸氯胺酮(100mg/kg,0.1 g)腹腔内注射麻醉大鼠后,经颈正中切口,M组、K组给大鼠气管内注入博莱霉素复制肺纤维化模型,C组气管内注入同等剂量的生理盐水作对照,K组于造模后1,2,3,8,12,19,25 d 腹腔内注射抗 bFGF 抗体 。上述各组均于注药后第1周、第4周各宰杀5只。
1.3 实验方法
1.3.1 标本的采集 大鼠麻醉后称体重、开腹,用盐水纱布钝性分离暴露腹主动脉,采集动脉血分别行血气分析检查及留取血清标本,离心后于-70℃冻存,待测bFGF。处死动物后开胸,于颈部切断主气管,向下剥离,取出全肺称重,以便计算肺系数,计算公式为肺系数=肺重(mg)/体重(g)×100%。结扎左肺门,切除左全肺,于-70℃冻存留作其他检查。经气管置人12号钝性针头,结扎后以无菌生理盐水灌洗右肺,每次5 ml,灌洗 3次,回收灌洗液,BALF离心后上清液分装于无菌离心管中,置于-70℃冻存,待测bFGF。经气管向右肺注入10%的中性福尔马林4~6 ml使胸膜展开,结扎气管,再置于10%福尔马林中固定,制备石蜡切片供组织学检查。
1.3.2 肺泡炎、肺纤维化程度 观察方法参照文献的严重程度分级方法进行累积评分,统计学处理后加以比较。具体步骤如下:(1)进行HE染色,参照Szapiel[3]等方法,观察肺泡炎程度。(2)参照Fulmer[4]方法 ,利用Masson氏三色染色的切片观察肺纤维化的情况。
1.3.3 免疫组化法检测肺组织bFGF表达 肺组织石蜡切片常规脱蜡至水,然后按ELISA试剂盒说明书进行操作。应用图像分析,每张片子取5个视野,bFGF阳性表达产物为棕黄色细颗粒状,分别测定其在本视野的面积百分比的均值,作为该大鼠的测定值。
1.3.4 ELISA测定血清和肺泡灌洗液的bFGF含量将离心后的血清和肺泡灌洗液的上清液置于-70℃冻存,依照bFGF ELISA试剂盒说明书的步骤操作。
1.4 统计学处理
2 结果
2.1 肺系数变化
1、4周时M组肺系数高于C组(P<0.05),K组低于M组(P<0.05)。
2.2 肺组织病理学改变
C组肺组织结构正常(图1A,2F)。1周时M 组表现为肺泡炎及肺间质炎症(图1B,2G),K组肺泡炎较M组减轻(图1C,2H);4周时M组肺泡结构破坏,间质纤维组织增生,形成广泛性纤维化,但仍有肺泡炎存在(图1D,2I),K组肺组织结构部分破坏,肺泡腔有少量炎细胞渗出,肺泡间隔轻度增厚,间质纤维组织增生不明显,无明显纤维化改变(图1E,2J,图1,2见下页)。其累积评分见表1。
Tab.1 Changes of lung coefficients,histopathology and arterial oxygen tension(,n=5)

Tab.1 Changes of lung coefficients,histopathology and arterial oxygen tension(,n=5)
C:Control group;M:Model group;K:Anti-bFGF group;1 mmHg=0.1333 kPa*P<0.05,**P<0.01 vs control;#P<0.05 vs M group
Group First week Lung coefficients Alveolar catarrh degree(score) PaO2(mmHg)Fourth week Lung coefficients Pulmonary fibrosis degree(score) PaO2(mmHg)C 9.6±1.7 1.2±0.4 96.8±13.8 9.7±1.5 1.0±0.0 97.0±10.3 M 13.3±1.7* 3.6±0.5** 61.5±20.7* 14.2±1.8* 4.2±0.8** 57.5±13.6*K 12.3±2.7* 2.8±0.9* 64.3±13.7* 11.8±1.7* 2.7±0.8** 76.8±12.6
2.3 各组大鼠PaO2变化
1周时M组低于C组(P<0.05),K组与M组差异无显著性(P>0.05),4周时M组PaO2低于C组(P<0.05),K组的PaO2高于M组(P <0.05,表1)。
2.4 各组大鼠肺组织免疫组化bFGF的变化
1周时M组(图3L)的bFGF表达高于C组(图3K,P<0.01),K组(图3M)的bFGF表达低于M组(P<0.01);4周时M 组(图3N)的bFGF表达高于C组(P<0.01),K组(图3O)的bFGF表达低于M 组(P<0.01,表2)。
Tab.2 bFGF concentration changes in lung,serum and BALF of the rats(,n=5)

Tab.2 bFGF concentration changes in lung,serum and BALF of the rats(,n=5)
C:Control group;M:Model group;K:Anti-bFGF group*P<0.05,**P<0.01 vs control;#P<0.05 vs M group
Group Lung First week Fourthweek Serum First week Fourth week BALF First week Fourth week C 0.167±0.031 0.155±0.016 0.182±0.014 0.170±0.115 0.711±0.039 0.711±0.039 M 0.276±0.017** 0.294±0.027** 0.457±0.034** 0.368±0.032 0.655±0.039 0.799±0.013**K 0.203±0.051## 0.205±0.052## 0.265±0.167# 0.174±0.012## 0.204±0.030## 0.169±0.031##
2.5 各组大鼠血清及肺泡灌洗液bFGF的变化
血清中bFGF的表达:1周时M组的表达高于C组(P<0.01),K组表达低于M 组(P<0.05);4周时M组的表达高于C组(P<0.01),K组表达低于M组(P<0.01)。肺泡灌洗液(BALF)中bFGF的表达:1周时M组的表达与C组比较,差异无统计学意义(P>0.05),K组表达低于M组(P<0.01);4周时M组的bFGF表达高于C组(P<0.01),K组表达低于M 组(P<0.01,表2)。
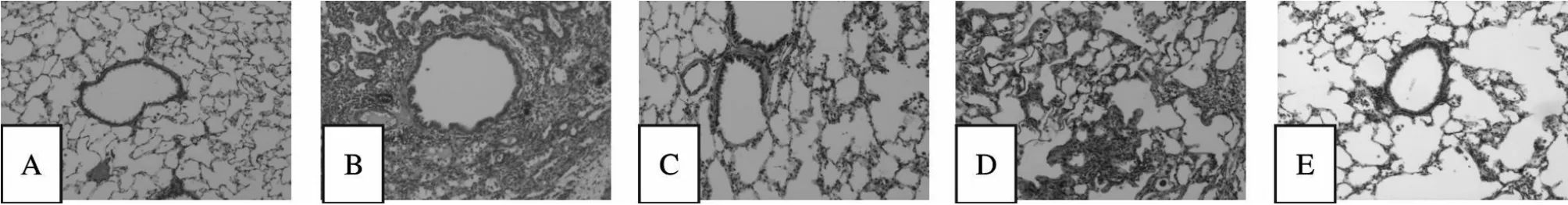
Fig.1 Light micrographs of rat lung on 1,4 week in each group(HE ×100)

Fig.2 Light micrographs of rat lung on 1,4 week in each group(Masson ×100)

Fig.3 Light micrographs of rat lung on 1,4 week in each group(immunohistochemistry ×100)
3 讨论
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是指原因不明并以炎性细胞的聚集、胶原蛋白的过度沉积及成纤维细胞的异常增殖和分化为主要特征的一种慢性炎症性间质性肺疾病。本实验采用博莱霉素气管内注入复制肺纤维化动物模型,选择模型的肺泡炎高峰期(1周)、肺纤维化形成稳定期(4周)作为观察点,通过腹腔注射抗bFGF抗体进行干预。结果发现,1、4周时M组肺系数高于C组(P<0.05),K组低于M 组(P<0.05)。肺系数的改变显示抗bFGF抗体干预后肺纤维化程度减轻;各组大鼠PaO2变化:1周时M 组低于C组(P<0.05),K组与M组差异无显著性(P>0.05),4周时M组PaO2低于C组(P<0.05),K组的PaO2高于M组(P<0.05)。血气分析检查亦显示K组PaO2比M组改善;M组1周病理改变肺泡炎及肺间质炎症,4周时M组肺泡结构破坏,间质纤维组织增生,形成广泛性纤维化,但仍有肺泡炎存在;K组1周时肺泡结构存在,肺泡间隔增生程度轻,肺泡炎范围小,胶原纤维增生程度轻。K组4周肺组织结构部分破坏,肺泡腔有少量炎细胞渗出,肺泡间隔轻度增厚,间质纤维组织增生不明显,无明显纤维化改变。本实验从M组病理结果可以看出,博莱霉素气管内注入复制肺纤维化动物模型是成功的,此模型作为目前国际上IPF研究的动物模型,依据是病理改变符合药物性肺纤维化。以上结果表明抗bFGF抗体干预后,K组大鼠的肺纤维化程度明显较M组减轻,故可以证明抗bFGF抗体干预后可减轻博莱霉素诱导的肺纤维化。
细胞因子中和抗体有着广阔应用前景,不但可以单纯阻断单个细胞因子的作用,而且由于其相互作用网络的存在,这些抗体的使用必然会为揭示网络结点之间的数理关系提供有用的线索。已在实验中得到证实[5,6]抗纤维化细胞因子IFNγ可明显减轻博莱霉素或二氧化硅诱发的肺纤维化。国外[7]最近发现肺纤维化时,内皮素的表达增加,内皮素受体拮抗剂可减轻博莱霉素诱发的肺纤维化。本研究就是基于上述理论依据,采用腹腔注射抗bFGF抗体进行干预,通过检测肺组织、血清及BALF中bFGF的变化,探索肺纤维的发病机制。结果提示,从免疫组化图片可以看出,bFGF主要表达于大气道壁和血管壁的平滑肌细胞,正常组仅在气管平滑肌少量表达;M组1周时bFGF免疫组化呈阳性反应,K组的bFGF表达较M组减少;M组4周时bFGF免疫组化呈强阳性反应,K组的bFGF表达与同期的M组相比,免疫组化反应有较明显的减弱。K组1,4周经过bFGF抗体与抗原结合后,肺纤维化程度明显较M组减轻。从上述结果中可以看出,肺纤维化的程度与bFGF表达呈正相关。此结果与文献[8]报道一致。1周时K组的血清及BALE中bFGF的表达与C组比较,差异无统计学意义,4周时差异有统计学意义。说明1周时为肺泡炎症期,bFGF的表达不高,Osaki等[1]发现bFGF and TGF-β通过分别诱导成纤维细胞增殖和分化而在肺纤维的不同阶段分别起关键性的作用,常发现bFGF在肺纤维化期(4周)高表达并起促纤维化作用,方向群[9]等发现bFGF在肺纤维化模型的14天后水平开始升高。结合本实验结果,4周时K组的肺组织、血清及BALE中bFGF的表达与C组比较,差异有统计学意义,与文献[9]报道一致。
近年来,随着bFGF及其抗体研究的深入,发现通过抑制bFGF生物活性从而抑制某些组织病变,阻断疾病的发生发展。bFGF由于可以促进成纤维细胞的增生和胶原纤维的合成而被认为是一个与肺纤维化有关的细胞因子。在肺纤维化的发展中,成纤维细胞增殖和胶原纤维的形成是病变发生发展的关键,而成纤维细胞的调控受巨噬细胞分泌的bFGF的影响,两者关系密切。Rcily等[10]研究证明,抗bFGF抗体中和bFGF,抑制bFGF与成纤维细胞表面的受体结合,从而抑制其发挥生物学效应。bFGF的分泌方式是自分泌或旁分泌,通过细胞损伤或死亡释放出来而起作用。bFGF的受体广泛分布于胶质细胞、平滑肌细胞、成纤维细胞和内皮细胞等多种细胞中。bFGF与其受体结合,能产生广泛的细胞效应,促进细胞增生分化和血管生成,阻止细胞凋亡,刺激和调节血管内皮细胞、上皮细胞、成纤维细胞、成骨细胞和神经胶质细胞等多种细胞分化增殖。成纤维细胞生长因子通过作用细胞表面酪氨酸激酶受体发挥它们的生物活性。本实验的结果再次可以证实,bFGF在肺纤维化期起作用并与肺纤维化程度呈正相关,应用抗bFGF抗体中和bFGF,把病变控制在肺泡炎阶段,抑制bFGF与成纤维细胞表面的受体结合,从而阻止了成纤维细胞增殖与纤维化的发展。这为临床肺纤维的发病机理提供了理论依据,为肺纤维化的治疗提供了一个新的方法。
[1]Osaki T,Yoneda K,Tatemoto Y,et al.Peplomycin,a bleomycin derivative,induces myofibroblasts in pulmonary fibrosis[J].Int J Exp Pathol,2001,82(4):231-241.
[2]Yuji S ,Motohiro T ,Teizo Y.Kinetics of macrophage subpopulations and expression of monocyte chemoattractant protein-1(MCP-1)in bleomycin-induced lung injury of rats studied by a novel monoclonal antibody against rat MCP-1[J].J Leukoc Biol,1994,56(6):741-750.
[3]Szapiel S V,Elson N A,Fulmer J D,et al.Bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-899.
[4]Fulmer J D,Bienkowski R S,Cowan M J,et al.Collagen concentration and rates of synthesis in idiopathic pulmonary fibrosis[J].Am Rev Respir Dis,1980,122(2):289-301.
[5]Zia S,Hyde D M,Giri S N.Effects of an interferon induces bropirimine on bleomycin-induced lung fibrosis in hamsters[J].Pharmacol Toxicol,1992,71(1):11-18.
[6]Gurujeyalakshmi G,Giri S N.Molecular mechanisms of antifibrotic effect of interferongamma inbleomycin-mouse model of lung fibrosis:down-regulation of TGF-beta and procollagen Ⅰ and Ⅲ gene expression[J].Exp LungRes,1995,21(5):791-808.
[7]Park S H,Saleh D,Giaid A,et al.Increased endothelin-1 in bleomycin-induced pulmonary fibrosis and the effect of anendothelin receptor antagonist[J].Am J Respir Crit Care Med,1997,156(2 pt 1):600-608.
[8]刘凯珊,司徒锐,廖剑辉,等.抗碱性成纤维细胞生长因子对家兔实验性矽肺发生发展的影响[J].中华结核和呼吸杂志,1995,18(6):351-353.
[9]方向群,朱元珏,胡晓玲,等.氯沙坦对大鼠肺纤维化模型的干预作用及对MCP1和bFGF表达的影响[J].中华结核和呼吸杂志,2002,25(5):268-272.
[10]Reily T M ,Taylor D S,Herblin W F.Monoclonal antibodies directed against basic fibroblastgrowth factor which inhibit its biological activity invitro and in vivo[J].Biochem Biophys Res Commun,1989,164(2):736-743.

