NF-κB“圈套”抑制PC12细胞中NF-κB活性模型的建立*
王冬梅,宫德正,殷盛明,于德钦,徐 红,徐 静,赵 杰,孙艺平,△
(1.大连医科大学机能学实验室,辽宁 大连 116044;2.大连医科大学生理教研室,辽宁 大连 116044)
核转录因子(NF-κB)的激活可高效诱导靶基因的转录,在炎症和免疫反应中起着调控作用。目前有关抑制NF-κB活化的“圈套”策略已在心脏再灌注损伤、肾小球性肾炎等炎症性疾病的动物实验中显示疗效[1]。本研究将利用具有神经元细胞模型特点的PC12细胞,以脂多糖(lipopolysaccharide,LPS)作为NF-κB的活化剂 ,观察κB-decoy 对NF-κB的抑制作用 ,以建立NF-κB“圈套”对PC12细胞中NF-κB抑制的模型,为探讨由NF-κB过度活化导致的神经系统某些疾病的基因防治措施提供实验依据。
1 材料与方法
1.1 κB-decoy的设计与合成
根据NF-κB增强子的特定序列5'-GGGACTTTCC-3',设计包含2个拷贝的NF-κB特异结合序列的哑铃形圈套寡核苷酸和与其碱基数相同的随机序列(大连宝生物公司)。
1.2 载体包裹寡核苷酸
按比例以每孔(6孔板)15μl LF2000(Invitrogen)溶于 375μl无血清的 Opti-MEM I Reduced Serum Medium(Invitrogen)中室温充分混匀5 min;将DNA(6μg/well)溶于 375μl无血清的 Opti-MEM I Reduced Serum Medium中;将以上两种溶液混合,室温孵育20min。
1.3 PC12细胞处理
转染前24h,将7.5×105个PC12细胞溶于2 ml生长培养基中,之后接种于6孔板中(用于免疫细胞化学染色实验的需铺盖玻片),最终使接种浓度达到90%;细胞24h贴壁后换液(正常1640无双抗培养液,2 ml/well);将细胞分3组进行处理,实验组:LF2000+κB-decoy;对照组 :LF2000+错配-decoy;正常组:LF2000;每孔加入1.2中的混合液750μl混匀;将6孔板放于37℃的CO2培养箱,细胞转染24h后更换正常无双抗培养液(2 ml/well),继续培养24h。
细胞转染48 h后,稀释LPS(200ng/ml),作用0.5~4h。
用于Western blot方法检测的细胞:吸去培养液,1×PBS洗2遍,1×Loading Buffer刮板收集细胞,加入 200μl 1 ×Loading Buffer/well,漩涡振荡,煮样10min,12000×g 4℃离心10min,-20℃保存备用。
用于免疫细胞化学染色实验的细胞,将爬满细胞的盖玻片以0.01 mol/L PBS漂洗5 min×3次后,冷丙酮固定20min,-20℃保存。
1.4 免疫细胞化学染色
将爬满细胞的盖玻片以0.01 mol/L PBS漂洗5 min×3次,用1%H2O2作用10min,5%羊血清(含有0.3%triton-100的PBS)封闭20min,加一抗NF-κBp65(Santa Cruz)1∶100,在湿盒中 4 ℃过夜,0.01 mol/L PBS漂洗5 min×3次,再分别与二抗(1∶400)室温孵育1 h,0.01 mol/L PBS漂洗5 min×3次,与卵白素-生物素复合物室温孵育2 h,0.01 mol/L PBS漂洗5 min×3次,DAB显色 5~10min,显微镜下观察适时终止反应,常规脱水、透明、中性树胶封片。
1.5 Western blot分析
按照蛋白提取试剂盒说明书提取PC12细胞内总蛋白采用 Bradfold法进行蛋白定量,以 100μg蛋白质为标准,算出所需原液体积,补加1×PBS使总体积为15μl,再向每个样品管中加 5μl的 4×Loading Buffer混匀,蛋白于100g/L聚丙烯酰胺凝胶电泳分离后转膜,加NF-κB p65抗体(1∶500),4℃过夜,将PVDF膜在33℃条件下结合二抗(1∶3000)1 h,ECL显色,照片采用凝胶成像系统进行密度分析。
1.6 图像分析
使用Nikon显微摄影系统及NIS-Elements F2.30分析软件对其免疫反应产物进行平均光密度(Mean density)测定,以细胞为单位(n=30),选择图像中棕黄色区域。
1.7 统计学分析
使用Excel、SPSS 13.0软件进行数据分析,计量资料数据以平均值±标准差()表示,两组间差异显著性采用t检验(t-TEST),多组间差异采用单因素方差分析。
2 结果
2.1 免疫细胞化学染色
正常组:基础水平时,细胞胞浆无色或呈微棕色、胞核无棕色染色;经LPS刺激4h后,胞浆呈浅棕色或棕色,胞核呈棕色或深棕色染色,NF-κB活化明显(P<0.01)。对照组(转染错配-decoy):基础水平时NF-κB p65表达水平与正常培养的PC12细胞相似;以LPS刺激0.5~4h,随着时间的延长,细胞中胞浆染色由浅棕色逐渐增加至深棕色、胞核由无或浅棕色逐渐增加至棕黄色,2 h时NF-κB p65的表达至最高水平,4h时有所下降;实验组(转染κB-decoy):基础水平时胞浆与胞核均无棕黄色染色,以LPS刺激0.5~4h,随着时间的延长,胞浆与胞核染色均逐渐增加至浅棕或微棕色,2 h时达最高水平,4h时有所下降;与相应时间点的对照组相比,NF-κB p65的表达水平明显降低(P<0.01),2~4h最为明显(图1)。
2.2 Western blot分析
正常组与对照组的 PC12细胞中 NF-κB p65 Western blot分析的阳性信号较弱;实验组与正常组和对照组相比明显降低(P<0.01);正常组细胞经LPS刺激 4h 后,NF-κB p65 Western blot分析的阳性信号比基础水平明显增强(P<0.01);对照组的PC12细胞经LPS刺激4h后比基础水平明显增强(P<0.01),与正常组相似;实验组的PC12细胞经LPS刺激4h后比基础水平明显增强(P<0.01),与对照组相比明显降低(P<0.01,图2)。
3 讨论
NF-κB作为一种普遍存在的转录因子,是多种信号传导途径的汇聚点。近年来的研究发现,NF-κB过度活化与神经系统某些疾病的炎症反应有着密切关系[2-4],因此探讨和研究抑制NF-κB的活化对神经系统某些疾病的炎症反应,特别是对神经退行性疾病中的脑保护作用具有一定意义。
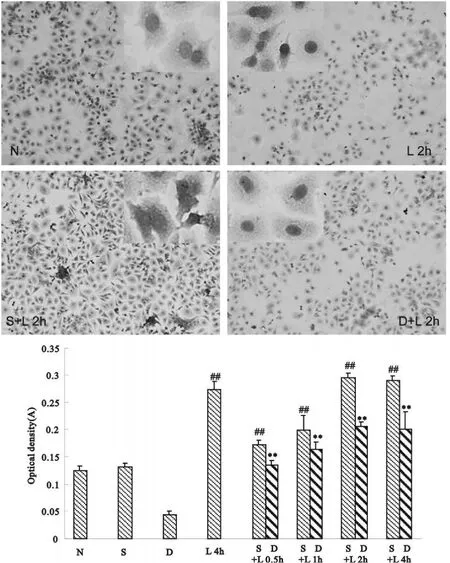
Fig.1 Immunocytochemistry of NF-κB in PC12 cells(×100,×400)

Fig.2 Western blot analysis of NF-κB expression in PC12 cells A:Western blot;B:Relative optical density of the Western blot analysis
PC12细胞株最早是由Greene和Tischler从大鼠移植的嗜铬细胞瘤(肾上腺)中获得[5],在神经生长因子(nerve growth factor,NGF)诱导下,PC12细胞能长出大量轴突、分化成交感神经样细胞,而且神经样分化的PC12细胞具有大多数神经元的形态、生化和生理特性[6],因其具有可传代培养的特点,作为神经元细胞模型,可用于神经生理、病理及药理方面的研究。近年来,PC12细胞作为神经系统损伤的细胞模型,已被广泛应用于神经元的毒性损害的研究[7,8]。
拮抗 NF-κB的策略有多种,只有对NF-κB与DNA顺式元件的结合实施直接干预措施,才能达到真正的特异性。“圈套”策略则是合成与顺式元件相一致的双链寡聚脱氧核苷酸转染入细胞,竞争性抑制反式因子(转录因子)与顺式元件的结合,干扰转录因子的DNA结合活性及其后续基因的表达,所以“圈套”策略已成为拮抗NF-κB活性的最佳选择之一。自1996年第一个经美国药品和食品管理局(FDA)批准的转录因子E2F“圈套/诱骗”策略用于治疗血管旁路移植伤后新生内膜增生患者以来,许多研究已报告了该策略作为体内基因治疗效果[1]。目前有关NF-κB“圈套”策略已应用于与NF-κB过度活化相关疾病,如心脏再灌注损伤、肾小球性肾炎等炎症性疾病的治疗,其动物实验已显示出确切而显著的疗效[9,10]。
在本研究中,依据NF-κB增强子的特定序列5'-GGGACTTTCC-3'设计包含2个拷贝的NF-κB特异结合序列的哑铃形圈套寡核苷酸转染PC12细胞后,可明显降低NF-κB的基础表达水平,再以LPS刺激PC12细胞活化NF-κB,可明显抑制NF-κB的活化;提示κB-decoy可以降低生理状态下PC12细胞中NF-κB的正常表达水平,抑制病理状态下PC12细胞中NF-κB的活化。此细胞模型的建立为我们深入探讨NF-κB对下游基因表达调控奠定了基础,也为抑制脑内NF-κB活化基因疗法提供了实验依据。
[1]Tomita N,Morishita R,Tomita T,et al.Potential therapeutic applications of decoy oligonucleotides[J].CurrOpin Mol Ther,2002,4(2):166-170.
[2]Schneider A,Martin-Villalba A,Weih F,et al.NF-kappaB is activated and promotes cell death in focal cerebral ischemia[J].Nat Med,1999,5(5):554-559.
[3]孙艺平,赵永顺,于德钦,等.匹罗卡品致痫大鼠脑内NF-κB及COX-2的表达[J].神经解剖学杂志,2008,24(4):421-424.
[4]Mogi M,Kondo T,Mizuno Y,et al.p53 protein,interferon-gamma,and NF-kappaB levels are elevated in the parkinsonian brain[J].Neurosci Lett,2007,414(1):94-97.
[5]Greene L A,Tischler A S.Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor[J].Proc Natl Acad Sci USA,1976,73(7):2424-2428.
[6]邢文英,史学义,丁 一,等.传代培养PC12无丝分裂与细胞分化的观察[J].河南医科大学学报,2001,36(3):284-286.
[7]Tischler A S,Riseberg J C,Hardenbrook M A,et al.Nerve growth factor is a potent inducer of proliferation and neuronal differentiation for adult rat chromaffin cells in vitro[J].J Neurosci,1993,13(4):1533-1542.
[8]Abu-Raya S,Tabakman R,Blaugrund E,et al.Neuroprotective and neurotoxic effects of monoamine oxidase-B inhibitors and derived metabolites under ischemia in PC12 cells[J].Eur J Pharmacol,2002,434(3):109-116.
[9]Morishita R,Higaki J,Tomita N,et al.Application of transcription factor“decoy” strategy as means of gene therapy and study of gene expression in cardiovascular disease[J].Circ Res,1998,82(10):1023-1028.
[10]Tomita N,Morishita R,Lan H Y,et al.In vivo administration of a nuclear transcriptionfactor-kappa B decoy suppresses experimental crescentic glomerulonephritis[J].J Am Soc Nephrol,2000,11(7):1244-1252.

