mTOR/S6K 1信号通路与胰岛素抵抗的关系及有氧运动对其影响的研究*
牛燕媚,苑 红,张 宁,傅 力,2,△
(1.天津体育学院健康与运动科学系、天津市运动生理与运动医学重点实验室,天津 300381;2.天津医科大学康复与运动医学系,天津 300070;3.天津市基础医学研究中心,天津 300070)
雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)属于磷脂酰肌醇相关蛋白激酶(phosphatidylinositol kinase-related protein,PIKK)家族,是磷酸肌醇3激酶/蛋白激酶B(phosphoinositide 3-kinases,PI3-kinase/protein kinase B,PI3K/PK B)信号通路下游的一个效应蛋白,具有丝/苏氨酸激酶活性。研究认为mTOR具有感受细胞外营养成分含量、能源物质水平变化以及生长因子等信号的能力并通过激活其下游效应蛋白对细胞的生长、分化、生存以及蛋白合成等机体代谢过程进行调节。当细胞外营养物质过剩时可通过激活mTOR信号传导通路,活化后的核糖体S6激酶1(ribosomal protein S6 kinase,S6K1)可通过磷酸化胰岛素受体底物1(insulin receptor substrate 1,IRS1)而抑制胰岛素的信号传导,使PI3K/PK B信号通路失活,引起胰岛素抵抗(insulin resistance,IR)的发生。以高脂饮食喂养的S6K1-/-小鼠在体研究以及用siRNA技术去除S6K1基因表达在细胞水平研究都表现出PK B磷酸化增加而保持胰岛素敏感。有氧运动可以促进机体能量代谢以提高机体组织对胰岛素的敏感性,已经广泛用于临床预防和治疗代谢综合征的辅助手段。但到目前为止,对其产生作用的分子生物学机制还不完全清楚。尤其对有氧运动后mTOR/S6K1信号通路影响的研究多以急性单次运动为主。有报道显示在一次性抗阻运动后,mTOR和S6K1的活性均呈显著性增强;而对长期有氧耐力运动后的研究甚少。因此,本研究采用C57BL/6小鼠,通过喂饲高脂饮食8周以建立IR动物模型,并通过观察不同饮食条件(正常饮食和高脂饮食)下mTOR/S6K1的表达情况。同时对动物施以6周75%VO2max的跑台训练以观察在不同饮食条件下mTOR/S6K1的表达情况,分析mTOR/S6K1在IR的发生中的作用以及有氧运动对IR进程的调节作用,以期探究其分子生物学机制。
1 材料与方法
1.1 动物及分组
本实验选用40只8周龄雄性C57BL/6小鼠,体重为(24.6±0.75)g,由军事医学科学院实验动物中心提供。小鼠在本实验室随机分笼饲养,自由进食饮水,光照12 h/d。动物室室温20~25℃,湿度为30%~40%。
将实验动物进行适应性喂养后随机分为正常饮食组(20只)和高脂饮食组(20只)。分别喂以正常饲料和高脂饲料8周,经空腹血清胰岛素(fasting insulin,FINS)值具有显著变化和口服葡萄糖耐量试验评价后确定IR模型成功。随后将正常饮食组随机分为正常饮食安静组(10只)和正常饮食运动组(10只),高脂饮食组分为高脂饮食安静组(10只)和高脂饮食运动组(10只)。
1.2 动物饲料配方
正常饮食组喂以标准饲料;高脂饮食组喂以高脂饲料,其成分蛋白20%KCal、碳水化合物35%KCal、脂肪45%KCal;以上饲料均购于中国医学科学院实验动物研究所。
1.3 运动方案
运动组进行跑台训练,正式运动前对小鼠进行适应性训练,以使其适应试验跑台。后进行每天1次,每次以12 m/min(相当于75%VO2max)的速度运动60min,每周5次,训练期为6周。
1.4 IR模型的建立
采用高脂饮食方式建立 IR模型,8周龄雄性C57BL/6小鼠10只经14周高脂饮食后检测空腹血清中胰岛素水平、糖耐量及观察胰岛形态学变化来鉴定IR模型的成立。与对照组相比,小鼠FINS水平呈显著性升高,同时糖耐量明显受损 (灌注葡萄糖后30,60,90和120min血糖值与对照组呈显著性升高)即可确定该小鼠已发生IR,若胰岛β细胞团面积增大可确定已进入IR失代偿期。
1.5 检测指标
1.5.1 口服糖耐量(OGTT)及空腹血浆胰岛素的测定在14周时,将各组小鼠禁食14~16 h,鼠尾静脉取血。采用One T ouch小型血糖仪测定小鼠空腹(T=0min)血糖值。然后迅速给小鼠按体重 (10μl/g)灌注20%葡萄糖溶液 (Sigma),分别在灌注后T15、T30、T60、T90、T150、T180min 进行鼠尾静脉取血,检测各点的血糖值。经鼠尾静脉取血采用ELISA法测空腹血浆胰岛素。胰岛素ELISA试剂盒购于LINCO公司。
1.5.2 标本采集 14周时将各组小鼠禁食12 h,进行麻醉,随后分离骨骼肌组织,置于液氮保存以备提取总RNA和蛋白质。同时取小鼠胰腺组织以10%福尔马林固定,以备石蜡切片。
1.5.3 胰岛β细胞形态学观察 将甲醛固定的胰腺经乙醇梯度脱水,再经丙酮、二甲苯脱水透明后,用石蜡包埋,切片,HE法染色。高倍镜下观察单一视野下胰岛β细胞团面积,统计分析各组间差异。
1.5.4 Northern blot法测定骨骼肌中mTOR和S6K1 mRNA表达 采用 Trizol(Invitrogen)方法提取骨骼肌中总RNA,分光光度计测定总RNA的浓度和纯度。配制甲醛变性凝胶,取等量总RNA(10μg)上样,35 V电压电泳过夜。采用Turboblotter将RNA转至尼龙膜,后紫外交联固定。探针制备采用TOPOTA克隆法:PCR采用引物序列为 mTOR上游5’-GCGGCCTGG AAATGCGG AAGTGG-3’,下游5’-AAAGCCCCAAGG AGCCCCAACA-3’;S6K1 上游 5’-GGCGGG ACGGCTTTTACCT-3’,下游 5’-ACCTTTCCATAGCCCCCTTTACC-3’。将PCR产物克隆到TOPO载体 (Invitrogen)内,转化细菌,扩增重组质粒DNA,并用EcoRⅠ酶切回收DNA片断,DNA测序鉴定克隆的DNA片段。使用Stratagene随机引物标记试剂盒和α-32PdCTP标记探针,45℃杂交过夜。次日,取出杂交膜,洗膜后放入装有增感屏的暗盒中,曝光48 h。使用Typoon-9400图像扫描仪分析结果。
1.5.5 Western blot测定骨骼肌中 mTOR、S6K1和pS6K1-Thr389蛋白表达 采用NP-40(sigma)法提取骨骼肌中总蛋白,在垂直电泳仪上用等量蛋白质样品经8%SDS-PAGE分离后,转移于PVDF膜上。用5%BSA(Amresco)按1∶1000比例稀释一抗 (cell signal technology),4℃孵育过夜。次日1×TBST洗涤5 min×3次,用5%脱脂奶粉按1∶7500比例稀释二抗 (Invitrogen),室温孵育1 h,1×TBST充分洗涤5 min×3次后,使用 ECL试剂盒(Pierce公司,美国)发光显影,胶片曝光,扫描定量各条带的相对灰度值。
1.6 统计学处理
2 结果
2.1 小鼠体重、FINS值、OGTT和胰岛β细胞形态学的变化
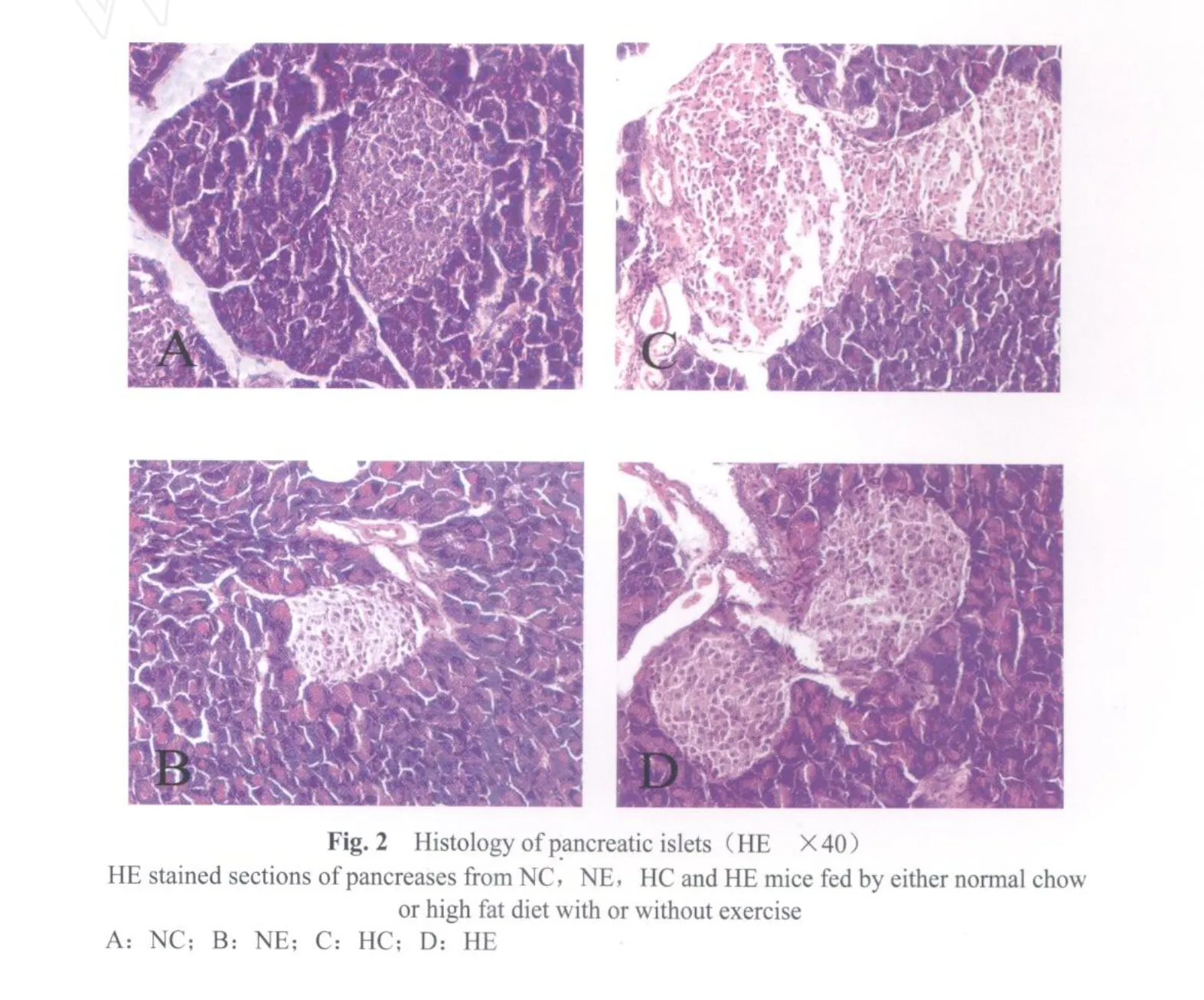
与NC组相比,HC组小鼠体重升高了21.99%(P<0.05),FINS升高了181.82%(P<0.01,表1);OGTT曲线峰值明显升高,峰值出现的时间点明显后移,血浆中葡萄糖清除率明显低于正常对照组,且3 h后血糖仍不能恢复到基础水平,并明显高于基础水平(图1见彩图页Ⅲ)。从HE染色图亦可见HE组胰岛β细胞面积增大的同时胰岛炎性浸润表现明显,边缘轮廓清晰程度较差(图2见彩图页Ⅲ)。
经过6周有氧运动后,HE组与 HC组相比,小鼠体重降低了22.75%(P<0.01),FINS降低了41.9%(P<0.05,表1)。从OGTT曲线可以看到(图1见彩图页Ⅲ),HE组与 HC组相比,峰值明显下降,峰值出现的时间点前移,血浆中葡萄糖清除率已得到明显改善且高于高脂安静组,但3 h后血糖值仍高于基础水平。从HE染色图亦可见HE组胰岛β细胞面积减少的同时胰岛炎性浸润表现轻于HC组,且边缘轮廓较清晰(图2见彩图页Ⅲ)。

Tab.1 Body weight and lipid level(,n=10)

Tab.1 Body weight and lipid level(,n=10)
NC:Normal chow control group;NE:Normal chow exercise group;HC:Highfat diet control group;HE:Highfat diet exercise group*P<0.05,**P<0.01vsNC;#P<0.05vsHC
Group Body weight(g)14-week Insulin(ng/ml)14-week NC 31.78±0.69 0.22±0.04 NE 30.28±1.71 0.26±0.04 HC 38.77±5.48* 0.62±0.26**HE 29.95±1.12# 0.30±0.04#
2.2 骨骼肌mTOR mRNA和蛋白表达的变化

Fig.3 Effect of aerobic exercise on skeletal muscle mTOR mRNA(A)and protein expression(B)
骨骼肌mTOR mRNA和蛋白表达经统计结果表明(图3),骨骼肌mTOR mRNA和蛋白表达的趋势基本一致,高脂饮食后HC组骨骼肌mTOR mRNA和蛋白分别较NC组升高了25.61%(P<0.05)和37.41%(P<0.01);有氧运动后,HE组骨骼肌mTOR mRNA和蛋白分别较 HC下降了16.27%(P<0.05)和19.22%(P<0.05)。由此可见,高脂饮食可以显著性增加骨骼肌mTOR mRNA和蛋白的表达水平,而有氧运动又可以明显降低HE组骨骼肌mTOR mRNA和蛋白的表达水平。
2.3 骨骼肌S6K1 mRNA和蛋白表达及 pS6K1-Thr389蛋白表达变化

Fig.4 Effect of aerobic exercise on skeletal muscle S6K1 mRNA(A)and protein expression(B)
骨骼肌S6K1 mRNA和蛋白及pS6K1-Thr389蛋白表达结果表明(图4),高脂饮食喂养后HC组小鼠骨骼肌S6 K1 mRNA和蛋白较NC组分别升高了54.98%(P<0.01)和37.36%(P<0.01),pS6K1-Thr389蛋白表达水平比NC组高了671.20%(P<0.01);有氧运动后 HE比 HC小鼠骨骼肌中S6K1 mRNA和蛋白分别降低了22.02%(P<0.05)和25.37%(P<0.05),pS6K1-Thr389蛋白表达在有氧运动后下降了53.98%(P<0.05)。由此可见,高脂饮食可以明显增加了骨骼肌总S6K1蛋白表达,而有氧运动又可以明显降低高脂饮食组其蛋白的表达。
3 讨论
mTOR目前被认为是一种营养素水平变化感受器,具有感受细胞外营养成分含量、能源物质水平变化以及生长因子等信号的能力。目前最受关注的是在营养过剩或高脂饮食时极易导致IR发生,且经研究发现mTOR/S6K1信号通路可能参与了IR的发生过程。
当机体营养素水平过剩时,高浓度的氨基酸/葡萄糖长期刺激,使得Insulin/PI3K/PK B通路下游的mTOR/S6K1通路长期处于激活状态,引起mTOR/S6K1过度表达而使 IRS1-Ser312、IRS1-Ser636/639或IRS1-Ser307发生过度磷酸化后抑制胰岛素的信号传导[1,2],从而严重干扰 Insulin/PI3K/PK B的胰岛素信号传导功能,引发机体产生 IR。而且这一过程依赖于mTOR/S6K1途径的存在及过度表达。体外研究观察发现,在高胰岛素浓度下,氨基酸可以刺激细胞引起IR,且还发现在氨基酸孵育过的细胞内葡萄糖转运能力下降,可能是mTOR通路起着重要的调节作用[3]。由此可以推断,mTOR通路的激活在 IR的发生中也起着重要作用。
Leila等人[4]的研究发现4周高脂饮食诱导 IR的大鼠空腹时肝脏和骨骼肌中 mTOR-Ser2448及S6K1-Thr421/Ser424磷酸化表达明显高于正常饮食的大鼠。在本研究中,经 14周高脂饮食喂养后,HC组FINS值显著升高,且发现机体对葡萄糖的耐受能力明显降低,并伴有体重的增加,结果表明小鼠存在着明显的高胰岛素血症。同时发现HC组小鼠骨骼肌组织中mTOR及S6K1的mRNA NC组有明显上调,而且还发现HC组S6K1磷酸化蛋白表达明显高于NC组。因此说明,高脂饮食激活了mTOR能量感受器,从而调节下游的 S6K1基因和蛋白的表达,从而使得机体产生了严重的IR症状。
目前的研究已证实,有氧运动在预防和治疗IR等相关疾病中发挥着重要的作用。本实验对高脂饮食所诱导的 IR小鼠施以6周强度为75%VO2max的有氧跑台训练,结果发现高脂饮食小鼠在运动后体重降低了22.75%(P<0.01),FINS水平也降低了41.9%(P<0.05),此时说明机体已改善了高胰岛素血症,同时发现机体对葡萄糖的耐受能力也明显增强,从形态学分析,运动减轻了胰岛β细胞的增生和炎性浸润症状。由此可见强度为75%VO2max的6周有氧耐力运动能够明显改善 IR状态。
关于mTOR和S6K1在有氧运动改善IR过程中的作用,多数学者已证明有氧运动是通过激活腺苷酸活化蛋白激酶 (AMPK)后抑制mTOR和S6K1活性来实现的。主要表现为运动后AMPK活性显著增高[5~8],活化后的AMPK可使mTOR-Ser2446发生磷酸化,从而抑制mTOR-Ser2448发生磷酸化,降低S6K1磷酸化的能力[9]。David[10]等人在对8月龄大鼠皮下注射AICAR(AMPK激动剂)或生理盐水 (对照)40min后,对趾长伸肌进行高频电刺激使其处于伸长状态达22 min,结果发现用AICAR处理后,趾长伸肌在伸长后细胞内AMPK-Thr172和ACC-Ser79均呈显著性升高的同时却明显抑制了pS6K1-Thr389蛋白的表达。在长期有氧运动也得到了同样的结果,我们的实验已经证实在长期有氧运动后磷酸化蛋白AMPK-Thr172和ACC-Ser79均呈显著升高。本实验小鼠在进行6周有氧跑台训练后其骨骼肌pS6K1-Thr389蛋白表达也呈显著性下降趋势。提示我们,AMPK活性增强抑制了pS6K1-Thr389蛋白表达。
长期营养过剩可以过度激活mTOR和S6K1信号通路从而使得IRS-1丝氨酸残基磷酸化增加,导致Insulin/PI3K/PK B的胰岛素信号通路受损。然而长期耐力训练可以提高IR骨骼肌对胰岛素的敏感性[1]。本实验发现mTOR、S6K1和pS6K1-Thr389蛋白表达在长期有氧运动后呈显著性下降。总之,本实验证实IR小鼠在有氧运动后mTOR和S6K1及其磷酸化蛋白的表达下降,说明长期的有氧训练可能通过调节mTOR/S6K1信号通路来改善IR症状。
[1]Harrington L S,Findlay GM,Gray A,et al.The TSC1-2tumor suppressor controls insulin-PI3Ksignaling via regulation of IRS proteins[J].J Cell Biol,2004,166(2):213-223.
[2]Um S H,D’Alessio D,Thomas G.Nutrient overload,insulin resistance,and ribosomal protein S6 kinase 1,S6K1[J].Cell Met,2006,3(6):393-402.
[3]Tremblay F R,Marette A.Amino acid and insulin signaling viathe mTOR/p70S6 kinase pathway[J].J Biol Chem,2001,276(41):38052-38060.
[4]Khamzina L,Veilleux A,Bergeron S,et al.Increased activation of the mammalian target of rapamycin pathway in liver and skeletal muscle of obese rats:possible involvement in obesity-linked insulin resistance[J].Endocrinol,2005,146(3):1473-1481.
[5]Fujii N,Hayashi T,Hirshman M F,et al.Exercise induces isoform-specific increase in 5’AMP-activated protein kinase activity in human skeletal muscle[J].Biochem Biophys Res Commun,2000,273(3):1150-1155.
[6]Stephens TJ,Chen Z P,Canny B J,et al.Progressive increase in human skeletal muscle AMPK alpha 2 activity and ACC phosphorylation during exercise[J].Am J Physiol Endocrinol Metab,2002,282(3):688-694.
[7]Wojtaszewski J F,Mac Donald C,NielsenJ N,et al.Regulation of 5’AMP-activated protein kinase activity and substrate utilization in exercising human skeletal muscle[J].Am J Physiol Endocrinol Metab,2003,284(4):E813-E822.
[8]Coffey V G,Zhong Z,Shield A,et al.Early signaling responses to divergent exercise stimuli in skeletal muscle from well-trained humans[J].FASEB J,2006,20(1):190-192.
[9]Cheng S W,Fryer L G,Carling D,et al.Thr2446 is a novel mammalian target of rapamycin(mTOR)phosphorylation site regulated by nutrient status[J].J Biol Chem,2004,279(16):15719-15722.
[10]Thomson D M,Fick C A,G ordon S E.AMPKactivation attenuates S6K1,4E-BP1,and eEF2 signaling responses to high-frequency electrically stimulated skeletal muscle contractions[J].J Appl Physiol,2008,104(3):625-632.

