草莓果胶裂解酶RNA干扰表达载体构建
钱春 何桥 翟军鹏 宋波 夏蓓蓓 张兴国 梁国鲁
(西南大学园艺园林学院,重庆 400715)
草莓(Fragaria ananassa Duch.)果实色泽鲜红、柔软多汁,营养丰富,老少皆宜。防止草莓果实成熟软化,延长草莓果实货架寿命,是草莓生产中亟需解决的问题。草莓属典型的非跃变型果实(Knee et al.,1977;Perkins-Veazie et al.,1988),许多研究表明这类果实成熟软化与细胞壁结构的变化及多糖(果胶、纤维素、半纤维素)的降解密切相关,软化主要是由于皮层薄壁组织细胞壁胞间层的降解增加果胶释放所致(Neal,1965;Knee et al.,1977;Abeles & Takeda,1990),果胶裂解酶(pectate lyase,PL)是新发现的一种降解果胶物质从而导致果实软化的酶,被认为是通过分子改良果实硬度、阻止草莓果实软化的优秀候选基因(Yoder et al.,1993)。目前国内外对草莓硬度改良多采用传统的杂交育种,基因工程主要是利用反义 RNA技术(Wooley &James,2001;Jimenez-Bermudez et al.,2002;Palomer et al.,2006),国内外尚没有利用双链 RNA干扰(RNA interference,RNAi)技术改良草莓硬度方面的报道。
本试验构建了草莓PL基因的RNAi表达载体,并通过农杆菌介导成功转入到草莓植株中,为基因工程手段培育硬肉型草莓提供新种质和育种材料开辟了新途径。
1 材料与方法
1.1 材料
试验于2008年12月~2009年7月在重庆市蔬菜学重点实验室进行。供试材料为本实验室保存的丰香草莓无菌苗;大肠杆菌菌株DH5α、植物表达载体p2024(抗Kan,GFP标记基因)、农杆菌菌株LBA4404由本实验室保存。 pMD18-T载体及所有内切酶均购自TaKaRa公司,琼脂糖凝胶回收试剂盒、植物基因组DNA提取试剂盒、质粒小量制备试剂盒均购自北京索莱宝科技有限公司;卡那霉素(Kan)、氨苄青霉素(Amp)、羧卞青霉素(Cb)、链霉素(Str)、利福平(Rfp)购自北京天根生化科技有限公司。
1.2 方法
1.2.1 PL基因片段克隆 根据已发表的草莓PL基因的cDNA序列(GenBank登录号为U63550),利用Clustalx1.83和Genedoc2.0软件,与其他物种的PL基因同源序列进行分析比较,确定PL基因的保守片段。根据RNA干扰所需的双链发夹结构要求,利用Primer Premier5.0,设计合成特异引物,上游引物 sp1:5’GTGGATTGTGTTCAAGCGTGACATGG 3’;下游引物 sp2:5’CAGCATAACCTGTTCCAATAAACC 3’。对草莓DNA进行PCR扩增,PL基因保守片段长度382 bp的外显子作为发夹结构的茎(sense-PL,s-PL)及紧邻的106 bp内含子(intron)作为发夹结构的环,构成PL基因RNA干扰载体的长片段。
PCR反应参数:98 ℃预变性1 min,98 ℃ 10s,55.3 ℃ 15 s,72 ℃ 30s,30个循环,最后72 ℃ 10min。扩增完毕,1 %琼脂糖电泳检查。
1.2.2 PCR产物的克隆与测序 由于采用 Pfu高保真酶扩增,扩增产物3’端为平末端,胶回收PCR平末端产物,进行3’- 末端加A反应,然后连接到克隆载体pMD18-T上,连接产物转化大肠杆菌DH5α感受态细胞,涂布在含Amp 50mg·L-1的X-gal/IPTG的LB培养基上,37 ℃培养16 h。挑选白色单菌落,PCR扩增鉴定阳性克隆并确定方向,重组质粒送上海生工生物工程技术服务有限公司测序,获得阳性克隆载体pMD-siPL。

将pMD-siPL用HindⅢ/SalⅠ双酶切,回收目标片段siPL,与上述回收的r-PL进行连接,连接产物转化大肠杆菌DH-5α感受态细胞,培养方法同上,挑选单菌落进行PCR扩增,获得RNA干扰克隆载体pMD-sirPL(图1)。
用XbaⅠ/PmaCⅠ对pMD-sirPL双酶切回收小片段,用Ecl136/XbaⅠ对表达载体p2024(图2)双酶切回收大片段,连接及转化大肠杆菌DH-5α感受态细胞,涂板,PCR检测阳性克隆,对有目标片段的阳性克隆,挑菌,在含Kan 100mg·L-1的LB培养基摇菌培养,提取质粒,重组质粒采用PCR法和限制性内切酶酶切法鉴定。最后获得RNA干扰表达载体p2024-sirPL(图3)。

图1 草莓RNA干扰克隆载体pMD-sirPL
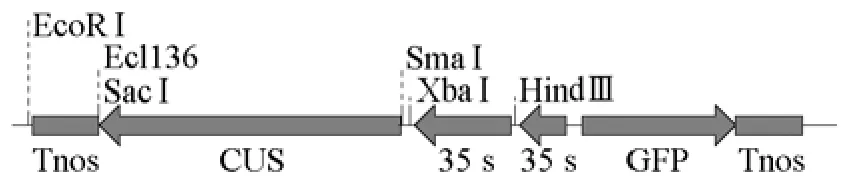
图2 植物表达载体p2024基因片段及酶切位点
1.2.4 草莓PL RNAi基因的转化 重组质粒用冻融法转化农杆菌LBA4404感受态细胞,在含Rfp 100mg·L-1、Kan 100mg·L-1及 Str 100mg·L-1的 YEP平板上筛选培养,利用引物sp2/p44、sp4/p45对阳性克隆进行PCR鉴定(引物p44、p45为植物表达载体上的一段碱基序列,序列是p44:ATGACGCACAATCCCACTATC;p45:ATCGCAAGACCGGCAACAG)。将鉴定正确的阳性农杆菌单菌落摇菌,用于草莓叶片转化。
1.2.5 草莓外植体的转化 对草莓的转化采用叶盘法。选取丰香草莓无菌苗幼嫩叶片(培养25 d左右),切成0.5 cm×0.5 cm小块,浸泡在培养好的农杆菌液(OD600值0.6)中8~10min,用无菌滤纸吸干多余菌液,共培养2~3 d,至农杆菌生长刚好覆盖伤口表面,转入抗性芽筛选培养基:MS+TDZ 2.0mg·L-1+NAA 0.1 mg·L-1+Kan 45 mg·L-1+Cb 300mg·L-1;增殖培养基为:MS+6-BA 0.3 mg·L-1+NAA 0.01 mg·L-1+Kan 45 mg·L-1+Cb 100mg·L-1;生根培养基:MS+Kan 45 mg·L-1+Cb 100mg·L-1。提取转基因植株叶片DNA,利用引物sp2/p44、sp4/p45进行PCR扩增,检测干扰基因是否整合到草莓植株,并利用引物 p144/p256进行 PCR扩增,排除假阳性的可能(p256为干扰载体左边界外一段引物序列:AACCCGGCAGCTTAGTTGCCGT;p144为干扰载体上一段序列:TTCAGGGAGTCACGTTATGAC)。

图3 草莓RNA干扰载体p2024-sirPL构建
2 结果与分析
2.1 草莓PL基因的克隆与序列分析
用sp1/sp2引物对草莓提取的DNA进行PCR扩增,获得的产物经1 %琼脂糖凝胶电泳,获得488 bp左右的扩增片段(图4),与设计扩增片段基本一致。
凝胶回收PCR扩增片段,并与pMD18-T载体连接,质粒经测序,其结果与发表的草莓DNA序列(GenBank登录号为AF339024.1)进行对比,只有一个碱基不同,同源性达到99.8 %。利用引物 p240/sp2、sp1/p264(引物 p240、p264是克隆载体上的碱基序列,序列为 p240:AGCGGATAACAATTTCACACAGG;p264:GTAACGCCAGGGTTTTCCCA),对筛选获得的阳性克隆质粒pMD18- siPL进行正反PCR验证,结果均有目标片段。
用sp3/sp4对质粒pMD18-siPL进行PCR扩增,获得328 bp的PL基因RNA干扰载体的反向重复序列r-PL(图5)。

图4 PL基因长片段克隆

图5 PL基因RNA干扰载体的反向重复序列扩增
2.2 植物RNA干扰表达载体的构建及鉴定
siPL与r-PL基因片段通过连接、转化,获得的重组质粒pMD18-sirPL经过XbaⅠ/PmaCⅠ双酶切鉴定,获得预期的870bp目标片段(图6)。
草莓RNAi表达载体p2024-sirPL重组质粒用引物sp2/p44进行PCR扩增,获得550bp左右的目标片段(图7),同时用EcoRⅠ/HindⅢ双酶切质粒p2024-sirPL,获得1980bp的目标片段(图8),说明RNA干扰载体构建成功。
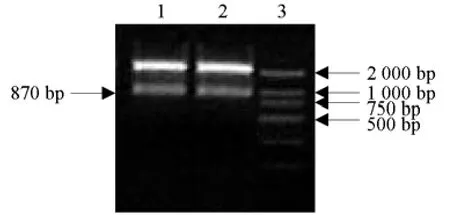
图6 草莓克隆载体pMD18-sirPL酶切鉴定

图7 草莓RNAi表达载体PCR检测
2.3 农杆菌PCR鉴定
将p2024-sirPL导入LBA4404,对培养的农杆菌液用两对特异引物sp2/p44、sp4/p45分别能扩增出约550bp和480bp的两条片段,表明双元质粒载体p2024-sirPL已导入根癌农杆菌中(图9)。

图8 草莓RNAi表达载体酶切鉴定
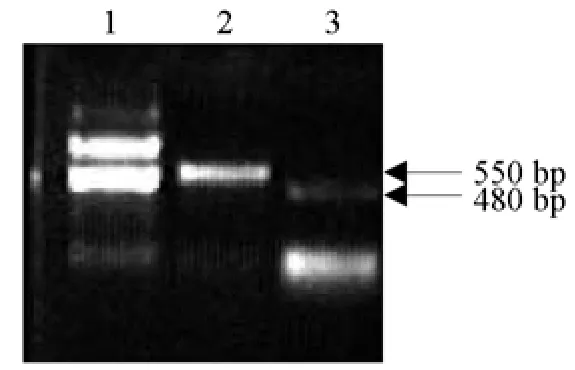
图9 含RNAi目的片段的农杆菌PCR检测
2.4 对草莓的转化
经农杆菌液浸泡的丰香草莓叶盘,在进行Kan筛选培养时,大量叶盘开始培养出少量愈伤,后变白死亡,少量叶盘愈伤可以继续膨大,分化出绿色芽点(图10)。通过在Kan筛选培养基上增殖生根培养,获得2个转基因株系(图11),利用sp2/p44和sp4/p45两对引物进行PCR扩增,均能扩增出理想的目标片段(图12),利用引物p144和p256进行PCR扩增,排除了转基因株系假阳性(图13),说明外源RNA干扰PL基因已经整合到草莓植株中。
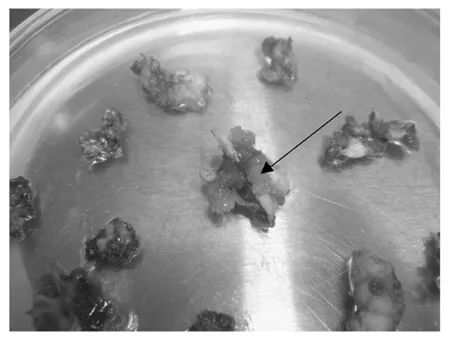
图10 草莓叶片Kan筛选培养获得不定芽

图11 草莓抗性芽增殖

图12 转基因草莓的PCR检测
3 讨论
RNA干扰是广泛存在真核生物中,通过正反义RNA形成双链RNA特异性地抑制靶基因的转录后表达的现象。RNAi具有特异、高效、放大的特点,双链RNA的抑制作用要比单独用反义RNA的抑制作用高出10倍以上(Davenport,2001)。本试验成功构建了草莓果胶裂解酶的RNA干扰载体,并已转入草莓植株中,但对草莓果实硬度的影响还需进一步将转基因草莓生根,转入大田栽培,对相关指标进行分析后获得。同时由于35 s是组成型启动子,基因的表达会在草莓的各个组织中得到表达,试验获得的干扰载体是否会显著影响草莓的生长及代谢,还需要对转基因草莓相关生理指标进行测定后获得结论。
Abeles F B,Takeda F.1990.Cellulase activity and ethylene in ripening strawberry and apple fruit.Sci Bot,42:269-275.
Davenport R J.2001.Gene silencing:a faster way to shut down genes.Science,292:1469-1471.
Jimenez-Bermudez S,Redondo-Nevada J,Munoz-Blanco J.2002.Manipulation of strawberry fruit softening by antisense expression of a pectate lyase gene.Plant Physiol,128(2):751-759.
Knee M,Sargent J A,Oshorne D J.1977.Cell wall metabolism in developing strawberry fruit.J Expt Bot,8:377-396.
Neal G E.1965.Changes occurring in the cell walls of strawberries during ripening.J Sci Food Agr,16:604-611.
Palomer X,Llop-Tous I,Vendrell M,Krens F A,Schaart J G,Boone M J,van der Valk H,Salentijn E M J.2006.Antisense down-regulation of strawberry endo-β-(1,4)-glucanase genes does not prevent fruit softening during ripening.Plant Science,171:640-646.
Perkins-Veazie P,Huber D J,Brecht J K.1988.Ethylene synthesis in developing strawberry fruit.Plant Physiol,86:155.
Woolley L C,James D J.Manning K.2001.Purification and properties of an endo-β-1,4-glucanase from strawberry and down-regulation of the corresponding gene,cell.Planta,214:11-21.
Yoder M D,Keen N T,Jurnak F.1993.New domain motif:the structure of pectate lyase C,a secreted plant virulence factor.Science,260:1503-1507.

