紫草素对增生性瘢痕中VEGF亚型mRNA表达的影响*
彭旦明 蔡紫光 张瑾楠 余泽军
(1江西省中医药研究院 南昌330046;2江西中医学院2007级研究生 南昌330004;3江西中医学院2008级研究生 南昌330004)
随着分子生物学和细胞生物学的研究进展,近年来人们对增生性瘢痕形成的分子机制进行了大量研究,认为增生性瘢痕的形成与瘢痕内血管密度及血管内皮生长因子 (vascular endothelial growth factor,VEGF)等细胞因子过度表达有关。针对VEGF在增生性瘢痕形成中的作用,我们采用紫草素对兔耳增生性瘢痕动物模型进行外用治疗实验研究,以便为增生性瘢痕治疗提供理论依据。
1 材料和方法
1 主要试剂与药物 Trizol提取液(威格拉斯生物技术有限公司),PCR试剂盒(Fermentas)。紫草素由石油醚冷浸提取所得,由江西省中医药研究院中药所提供。
1.2 增生性瘢痕模型的制备 选取20只健康的新西兰大耳白兔 (南昌大学医学院动物实验中心),体重2.0~2.5kg。采用 20%乌拉坦(1mL/kg)兔耳缘静脉注射,动物麻醉后于兔双侧耳腹侧分别做3个边长为1cm的正方形切口,切口间距2cm,完整切除全层皮肤及软骨膜,创面压迫止血后,创面暴露,无须包扎[1]。术后第1天开始观察伤口愈合及瘢痕形成情况,3周后选择每只耳朵至少有2个明显增生瘢痕的动物10只,共取20个瘢痕,10个为给药组,10个为模型对照组。给药组瘢痕外用紫草素治疗,每日2次。给药24d后在同样麻醉条件下切取瘢痕组织制作成常规石蜡切片,检测预设指标。
1.3 大体组织情况和组织学观察 术后21d及45d,取各组兔耳瘢痕组织,用游标卡尺直接测量其最大瘢痕厚度。术后45d的瘢痕组织经40g/L多聚甲醛固定,常规石蜡切片(厚度为4μm),脱蜡至无水,HE染色,常规脱水、透明、封片后,于光学显微镜下观察。
1.4 采用逆转录聚合酶链反应 (RT-PCR)检测VEGF121、VEGF165、VEGF189mRNA 的表达
1.4.1 引物的设计 应用oligo6.67设计VEGF165和β-actin的引物,由上海生物工程技术服务有限公司合成。VEGF165的上游引物为:5'-GAGTCC AACATCACCATGCAG-3',下游引物为:5'-TCAC CGCCTTGGCTTCTCACA-3',扩增产物长度为286bp;β-actin 的 上 游 引 物 为 :5'-TCAGGTCAT CACTATCGGCAAT-3',下游引物为:5'-AAAGAA AGGGTGTAAAACGCA-3',扩增产物长度为432bp;VEGF121的上游引物为:5'-ATCTTCAAGCC ATCCTGTGTGC-3', 下 游 引 物 为 :5'-TCGGCT TGTCACATTTTTCTTG-3',扩增产物长度为223bp;VEGF189的 上 游 引 物 为 :5-ATCTTCAAG CCATCCTGTGTGC-3',下游引物为:5'-CACAGGG AACGCTCCAGGAC-3',扩增产物长度为 289bp[2]。
1.4.2 标本采集 取瘢痕区域软骨膜上层的皮肤约0.5cm×0.5cm迅速存入液氮,取出后剪碎置于匀浆器,加入Trizol提取液碾碎,吸取匀浆液置于EP管中备用。
1.4.3 总RNA的提取和cDNA的合成 取准备好的组织,按Trizol试剂盒说明书提取组织总RNA,取1μg细胞总RNA为模板逆转录合成cDNA。反应条件为:42℃逆转录60min,70℃、5min灭活逆转录酶。
1.4.4 PCR反应 取2μL逆转录产物进行PCR扩增。条件为 94℃预变性 3min,94℃ 变性 30s,VEGF165和β-actin(57℃)、VEGF121(56℃)、VEGF189(60℃)退火 30s,72℃延伸 45s,共 35 个循环,72℃再延伸10min。PCR产物经2.0%琼脂糖凝胶电泳观察结果、照相,用凝胶图像分析系统分析产物经溴化乙锭染色后强度(用公式表示:VEGF各亚型的相对含量=VEGF各亚型密度/β-actin密度)。
2 结果
2.1 大体情况观察 术后3周,创面基本上皮化,有凸出皮面的瘢痕形成,色淡红,质较硬,明显增厚。45d后,模型组瘢痕仍明显高于正常皮面,色淡红。而给药组瘢痕处与正常皮肤基本平齐,色变淡,质软。两组兔耳瘢痕厚度的变化见表1。
表1 紫草素对兔耳瘢痕组织厚度的影响 (±S)mm
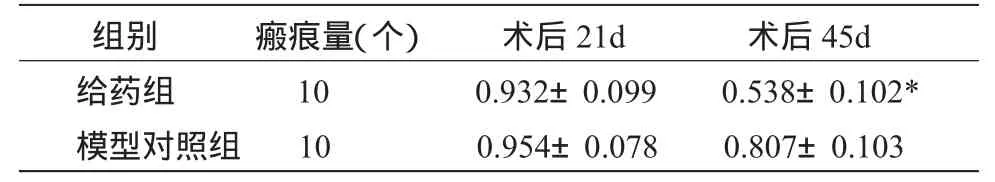
表1 紫草素对兔耳瘢痕组织厚度的影响 (±S)mm
注:两组比较,*P<0.01。
组别 瘢痕量(个) 术后21d 术后45d给药组 10 0.932±0.099 0.538±0.102*模型对照组 10 0.954±0.078 0.807±0.103
2.2 组织学观察 术后45d各组兔耳瘢痕组织外周均有一层纤维结缔组织包膜包绕。通过HE染色,给药组瘢痕组织内血管、成纤维细胞较少,胶原纤维较少,呈淡红色,稀疏,排列较整齐;模型组的瘢痕组织内有大量成纤维细胞,贴近包膜处有大量血管,胶原纤维较多,呈淡红色,粗大,漩涡状排列,细胞核呈蓝黑色。
2.3 VEGF121、VEGF165和 VEGF189mRNA 的 定 量检测结果 见表2。瘢痕组织和正常皮肤中均有不同程度的 VEGF121、VEGF165及 VEGF189mRNA 的表达。模型组较正常皮肤组 VEGF121、VEGF165及VEGF189相对含量均增高,给药组和正常皮肤组均无明显差异;与模型组比较,给药组中VEGF121、VEGF165及VEGF189mRNA的表达明显降低(P<0.05)。
表2 紫草素对增生性瘢痕组织中VEGF121、VEGF165及VEGF189相对含量的影响 (±S)
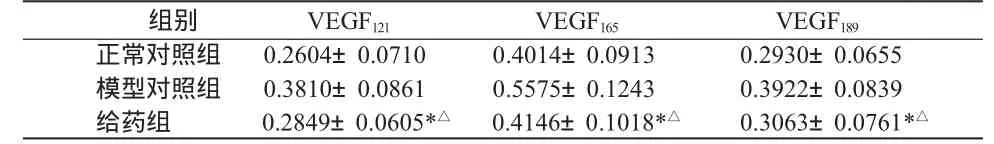
表2 紫草素对增生性瘢痕组织中VEGF121、VEGF165及VEGF189相对含量的影响 (±S)
注:与正常对照组比较,*P>0.05;与模型组比较,△P <0.05。
组别 VEGF121 VEGF165 VEGF189正常对照组 0.2604±0.0710 0.4014±0.0913 0.2930±0.0655模型对照组 0.3810±0.0861 0.5575±0.1243 0.3922±0.0839给药组 0.2849±0.0605*△ 0.4146±0.1018*△ 0.3063±0.0761*△
3 讨论
增生性瘢痕是皮肤受到深度烧(创)伤后,以胶原纤维过度沉积为特征的皮肤纤维化疾病。其发生机制仍不十分清楚[3],目前缺乏行之有效的防治手段。近年来生长因子在瘢痕形成过程中的作用越来越受到重视。它是一类刺激细胞分裂的生物活性多肽,在创面的愈合及瘢痕形成中发挥着重要的作用,参与修复细胞的增殖、分化、迁移及血管形成。VEGF是最重要的促进血管生长因子,具有促血管新生的作用,它与血管内皮细胞上其特异性受体VEGFR-1或VEGFR-2结合,通过一系列反应改变内皮细胞通透性,引起血浆蛋白外渗,为血管新生提供基质。VEGF作用于血管内皮细胞特异性有丝分裂,可促进其增殖、分化,同时也可促进内皮细胞的运动、迁移[4]。人体的许多细胞和部分肿瘤细胞都分泌VEGF,增生性瘢痕中的VEGF主要由角细胞、成纤维细胞产生。研究表明,VEGF及VEGFR在增生性瘢痕中大量表达,且其表达量与瘢痕血管增生程度、瘢痕成熟程度密切相关[5]。增生性瘢痕组织内血管生长因子的大量表达可能对瘢痕内大量血管的形成起支持作用,较多数量的血管可能为瘢痕提供充足的氧气和养分,以促进瘢痕成纤维细胞合成过量的胶原纤维。促进血管生成的生长因子不但能促进内皮细胞增殖、迁移及黏附,而且能抑制血管内皮细胞的凋亡[6]。有研究表明,VEGF有促进血管形成的作用,与增生性瘢痕形成有关[5,7]。
手术切除瘢痕或联合植皮术是目前治疗增生性瘢痕的首选方法,但易复发,其他的治疗方法还有加压、放射、冷冻及基因治疗等,也不尽理想。增生性瘢痕与肿瘤类似,表现为大量血管存在,某些促血管生长的细胞因子往往过度表达。VEGF有促进血管新生和瘢痕生长的作用,是治疗的目的靶点。本实验采用兔耳增生性瘢痕模型,以紫草素提取物外用治疗,观测瘢痕组织中胶原纤维的排列状况及其 VEGF121、VEGF165、VEGF189mRNA 的表达,结果显示:与模型组相比,给药组瘢痕厚度减小,微血管减少,成纤维细胞减少,且胶原纤维排列较整齐,VEGF121、VEGF165、VEGF189mRNA 的表达也明显降低。由此表明,紫草素可以抑制VEGF的表达,进而抑制胶原纤维合成和增生性瘢痕生长,具有重要的临床应用价值,值得进一步研究。
[1]曹毅,郭建辉,陶茂灿.中药制剂对兔耳增生性瘢痕组织的影响[J].中华中医药学刊,2008,26(1):96-97
[2]Eleni Zygalaki,Aliki Stathopoulou,Christos Kroupis,et al.Real-Time Reverse Transcription-PCR Quantification of Vascular Endothelial Growth Factor Splice Variants[J].Clinical Chemistry,2005,51(8):1 518-1 520
[3]李荟元,刘建波,夏炜,等.增生性瘢痕动物实验模型的建立与应用[J].中华整形外科杂志,2001,17(5):276-278
[4]Zhu KQ,Engrav LH,Armendariz R,et a1.Changes in VEGF and nitric oxide after deep dermal injury in the female,red Duroc pig-further similarities between female,Duroc scar and human hypertrophic scar[J].Burns,2005,31:5-10
[5]钱利,赵柏程,皮立,等.瘢痕组织中微血管数和血管生成因子表达的研究[J].中国烧伤创疡杂志,2003,15(4):285-289
[6]Nissen NN,Polverini PJ,Koch AE,et a1.VEGF mediate angiogenic activty during the proliferative phase of wound healing[J].Am J Pathol,1998,152:1 445-1 452
[7]Schwarz ER,Speakman MT,Patterson M,et a1.Evaluation of the efects of intramyocardial injection of DNA expressing vascular endothelial growth factor(VEGF)in a myocardial infarction in the rat-angiogenesis and angioma formation [J].J Am Coil Cardiol,2000,35:l 323-1 330

