加替沙星pH敏感眼用原位凝胶体外释放的研究
徐亚静,胡容峰,尹 辉,高 宇
(1.安徽中医学院 药学院,安徽 合肥 230031;2.安徽省中药研究与开发重点实验室,安徽 合肥 230038)
加替沙星(gatifloxacin)是第4代喹诺酮类抗菌药,不仅保持了前三代氟喹诺酮类药物对革兰阴性菌的抗菌作用,还增强了对包括MRSA等革兰阳性菌、厌氧菌、支原体及分枝杆菌的抗菌作用,具有抗菌谱广、抗菌活性强、口服吸收好、组织分布广、消除半衰期长、光敏性低等特点[1],能有效地治疗细菌性结膜炎,临床上主要为滴眼剂与凝胶剂。但是滴眼剂作用时间短、生物利用度低,需频繁滴眼,患者依从性差;凝胶剂黏度大,分剂量不准确,给药不方便。原位凝胶这一新剂型近年来已受到国内外药剂学者的重视,FDA批准了马来酸噻吗洛尔离子敏感型凝胶,还有两个采用F127制备的人工泪液原位凝胶在澳大利亚和日本上市。目前国内尚未见这类制剂上市。
pH敏感凝胶(in situ pH-sensitive gel),其以溶液状态给药,可在用药部位因pH环境的改变立即发生相转变形成半固态凝胶。将其应用于眼部给药,能延长药物在眼表的滞留时间,同时还具有制备简单、使用方便、与用药部位尤其是黏膜组织亲和力强、给药剂量准确等优点。Gumy等[2]制备的以醋酸纤维素酞酸酯(CAP)为基质的毛果芸香碱pH敏感眼用原位凝胶、Lin等[3]制备的以0.3%卡波姆(Carbopol)和14%泊洛沙姆407为基质的盐酸毛果芸香碱pH敏感原位凝胶、Ganguly等[4]制备的3%壳聚糖和3%单油酸甘油酯为基质的柠檬酸pH敏感原位凝胶,在用药部位的滞留时间均延长,生物利用度均较原有剂型增加。卡波姆属丙烯酸类聚合物,能够通过改变聚合物周围环境的pH值而诱发胶凝。当pH值小于4时,卡波姆在水中分散并溶胀,但不溶解,表现出很低的黏性,pH值为6~12时,卡波姆形成的凝胶黏度最大,但卡波姆酸性较强,不仅刺激眼部组织而且很难被泪液中和,所以不适于单独用作原位凝胶的基质[5]。本文以卡波姆和羟丙甲纤维素(HPMC)联合作为凝胶基质制得加替沙星pH敏感眼用原位凝胶,并对其体外释药特性与释放机制进行研究。
1 仪器与试药
Spectrumlab型紫外分光光度计(上海棱光技术有限公司);THZ-82A型气浴恒温振荡器(江苏金坛市金城国胜实验仪器厂);ZRS-8G型智能溶出试验仪(天津大学无线电厂)。
加替沙星原料药(批号:20080318),江苏吴中医药集团有限公司;卡波姆(980NF,Lubrizol)、HPMC(K4M),上海卡乐康包衣技术有限公司;其它试剂均为分析纯。
2 方法与结果
2.1 加替沙星pH敏感眼用原位凝胶的制备
将处方量的卡波姆和HPMC于搅拌条件下撒在蒸馏水液面上,放置过夜,使其充分水化溶胀后将处方量的加替沙星(3 mg/mL)、甘露醇(5%)、苯扎溴铵(0.01%)于搅拌条件下缓慢加入,使完全溶解,再用0.1 mol/L的NaOH溶液调节pH至5.5,制成加替沙星pH敏感眼用凝胶。
2.2 加替沙星含量测定
2.2.1 人工泪液的配置 根据泪液的电解质组成,每1000 mL模拟泪液包括碳酸氢钠2.18 g、氯化钠6.78 g、二水氯化钙0.084 g和氯化钾1.38 g。该模拟泪液的渗透压约290 mOsm/L,pH为7.8[6]。
2.2.2 测定波长的选择 精密称取加替沙星适量,用人工泪液配制成质量浓度约为30 μ g/mL的溶液,在200~400 nm范围内进行紫外扫描,选择最大吸收波长为测定波长。按处方比例称取辅料,用等量人工泪液溶解,配成不含主药的辅料溶液,进行紫外扫描,考察处方辅料对主药测定的干扰情况。结果显示,加替沙星在285 nm处有最大吸收,在此波长处辅料无吸收。
2.2.3 标准曲线的制备 精密称取加替沙星对照品适量,用人工泪液配制成0.3~12.0 μ g/mL的加替沙星标准溶液,在285 nm波长处测定吸光度(A)值,以A对质量浓度(C)进行线性回归,得到标准曲线方程:A=0.0666 C+0.0239(r=0.9999),表明加替沙星在0.3~12.0 μ g/mL范围内吸光度与浓度有良好的线性关系。
2.3 改良桨法
向小烧杯中加入加替沙星pH敏感眼用凝胶,调节pH值7.4使其形成凝胶。将小烧杯放入溶出杯底部,沿溶出杯壁小心倒入预热至35℃的人工泪500mL作为释放介质[7]。调节转速50 r/min,温度35℃。分别于10,20,40,60,90,120,140 min取样5 mL(同时补充人工泪液5 mL),经0.45 μ m微孔滤膜滤过滤,在285 nm波长处测定A值。释药曲线分别进行Noexponential零级动力学、Monoexponential一级动力学、Higuchi方程拟合,以相关系数(r)对方程拟合度加以判断,得:Noexponential零级动力学(r=0.9965)>Higuchi方程拟合(r=0.9635)>Monoexponential一级动力学(r=0.9250)。
通过零级释药模型,一级释药模型,Higuchi方程拟合,结果发现加替沙星pH敏感原位凝胶药物释放以零级释药模型拟合最佳,该制剂属于控释制剂。
2.4 无膜溶出法
将加替沙星pH敏感眼用凝胶加入到圆柱形的容器中,调节pH至7.4,使聚合物完全形成凝胶,保持液面平整。加入35℃预热的模拟人工泪液2 mL作为释放介质,在一定频率下恒温振荡20 min,立即倒出全部释放介质,将容器内外表面用滤纸吸干,迅速称量并纪录,重新放入振荡器内平衡15 min后,再小心加入预热的模拟人工泪液并继续振荡。如此反复操作,直至剩余凝胶量不足加入量的10%。每次试验重复3次,取平均值。以凝胶累积溶蚀量对时间作图,得到凝胶经时溶蚀曲线。考察凝胶的溶蚀动力学的同时考察凝胶的药物释放,用紫外分光光度法测定药物浓度。以药物累积释放量对时间作图,得药物经时释放曲线[8]。
2.4.1 释放面积对凝胶溶蚀和药物的释放的影响
2.4.1.1 释放面积对凝胶溶蚀的影响 精密称取优化处方凝胶分别置于截面面积为5.31,2.83,1.13 cm2的圆柱形容器中,在35℃,振荡频率为150次/min的空气浴振荡器中,进行凝胶的溶蚀试验,将凝胶累积溶蚀量对时间作图,考察释放面积对凝胶溶蚀的影响。由图1可得出,凝胶累计溶蚀量和溶蚀速率随着释放面积的增大而增大,且与时间呈良好的线性关系,显示出零级动力学特征。释放面积的改变不影响凝胶溶蚀动力学特征。
2.4.1.2 释放面积对药物释放的影响 将2.4.1.1项下所得的溶出液稀释到适宜浓度后,采用紫外分光光度法测定药物的释放,将药物累积释放量对时间作图,考察释放面积对药物释放的影响。由图2可得出,药物累积释放量和释放速率随着释放面积的增大而增大,且与时间呈良好的线性关系,显示出零级动力学特征。释放面积的改变不影响药物释放动力学特征。
2.4.1.3 不同释放面积下药物释放与凝胶溶蚀相关性 将药物累积释放百分率对凝胶累积溶蚀百分率作图,考察不同释放面积下药物释放与凝胶溶蚀相关性。由图3可得出,不同释放面积下的凝胶累积溶蚀百分率与药物累积释放百分率呈较好的线性关系。由于卡波姆和HPMC有较强的吸湿性,导致溶出与释放开始时累积溶蚀百分率偏小,甚至在某些情况(凝胶溶蚀速率较小)时,累积溶蚀百分率出现负值,导致凝胶溶蚀百分率一直小于药物累积释放百分率,但是各拟合方程的斜率接近1,所以总体看来,在面积1.13~5.31 cm2内凝胶溶蚀与药物释放以相似的速度进行,凝胶溶蚀是决定药物释放的主要因素。



图3 不同释放面积下凝胶溶蚀与药物释放的相关性Fig.3 Correlation between drug release and gel erosion
2.4.2 振荡频率对凝胶溶蚀和药物的释放的影响
2.4.2.1 振荡频率对凝胶溶蚀的影响 精密称取优化处方凝胶置于截面面积为2.83 cm2的圆柱形容器中,在35℃,振荡频率为100,150,200次/min的空气浴振荡器中,进行凝胶的溶蚀试验,将凝胶累积溶蚀量对时间作图,考察振荡频率对凝胶溶蚀的影响。由图4可得出,凝胶累积溶蚀量和溶蚀速率随着振荡频率的增大而增大,且与时间呈良好的线性关系,显示出零级动力学特征。振荡频率的改变不影响凝胶溶蚀动力学特征。

图4 振荡频率对凝胶溶蚀的影响Fig.4 The effect of shaking frequency on the gel erosion
2.4.2.2 振荡频率对药物释放的影响 将2.4.2.1项下所得的溶出液稀释到适宜浓度后,采用紫外分光光度法测定药物的释放,将药物累积释放量对时间作图,考察振荡频率对药物释放的影响。
由图5可得出,药物累积释放量和释放速率随着振荡频率的增大而增大,且与时间呈良好的线性关系,显示出零级动力学特征。振荡频率的改变不影响药物释放动力学特征。

图5 振荡频率对药物释放的影响Fig.5 The effect of shaking frequency on the drug release
2.4.2.3 不同振荡频率下药物释放与凝胶溶蚀相关性 将上述试验的药物累积释放百分率对凝胶累积溶蚀百分率作图,考察不同振荡频率下药物释放与凝胶溶蚀相关性。
由图6可得出,不同振荡频率下的凝胶累积溶蚀百分率与药物累积释放百分率呈较好的线性关系,由于卡波姆和HPMC有较强的吸湿性,所以导致溶出与释放开始时累积溶蚀百分率偏小,甚至在某些情况(凝胶溶蚀速率较小)时,累积溶蚀百分率出现负值,导致凝胶溶蚀百分率一直小于药物累积释放百分率,但各拟合方程的斜率接近1,所以总体看来,在振荡频率100~200次/min内凝胶溶蚀与药物释放以相似的速度进行,凝胶溶蚀是决定药物释放的主要因素。
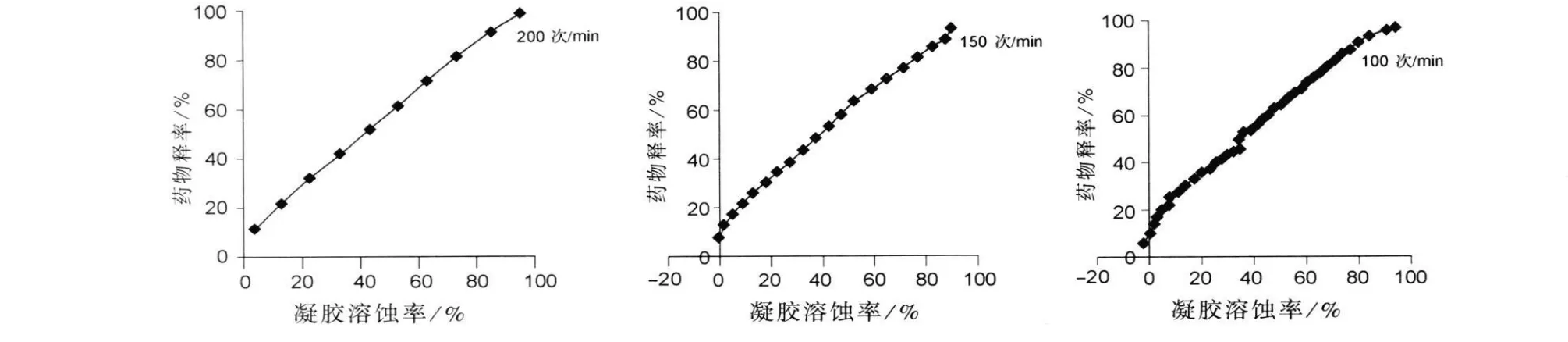
图6 不同振荡频率下凝胶溶蚀与药物释放的相关性Fig.6 Correlation between drug release and gel erosion
3 讨 论
本文以卡波姆和HMPC为基质设计了pH敏感原位凝胶,其在非生理条件下(pH 5.5)为流动的液态,在生理条件下(pH 7.4)胶凝成为半固态。其在体给药后受眨眼剪切作用铺展于角膜表面,其铺展状态与眨眼频率将极大程度地影响药物的释放速率,所以本文考察了药物的释放面积与振荡频率对凝胶中药物释放的影响。
研究凝胶中的药物释放行为,通常有两种方法:Franz扩散池法[9]和透析袋法[10]。制备凝胶所应用的聚合物多具有较高的相对分子质量,在上述实验条件下,由于半透膜的截留作用,聚合物不能扩散进入到释放介质中,也阻碍了药物的释放。对于用作经皮药物传递系统的凝胶制剂,上述方法是了解其药物释放规律的理想实验模型,但却不适用于眼部给药的情况。本研究首次将改良桨法与无膜溶出法结合起来,综合研究凝胶中药物的释放行为:改良桨法用于考察原位凝胶的释药规律,无膜溶出法用于研究其释药机制。
对不同释放面积、不同振荡频率下加替沙星的累积释放百分率与凝胶溶蚀百分率相关性分析表明,药物释放与凝胶溶蚀以相似的速率进行;当凝胶与释放介质接触时,水分子渗入到凝胶中导致聚合物胶束解缠结,并松散地堆砌于凝胶表面形成边界层。而静态条件下的溶出实验证实,溶蚀的聚合物集结在凝胶表面形成的边界层极大地延缓了药物释放,此时的释放行为遵循Fick扩散模式。但是由于眨眼作用,凝胶表面边界层的厚度变薄,药物释放行为不遵循Fick扩散模式,而是随着凝胶的溶蚀而释放,改良桨法与无膜溶出法两法相互印证,凝胶溶蚀是决定药物释放的主要因素。
[1]蔡兴俊.氟喹诺酮类药物(加替沙星)的基础研究及临床应用[J].中国误诊学杂志,2006,6(2):227-229.
[2]Gumy R,Boye T,Ibrahim H.Ocular therapy with nanoparticulate systems for controlled drug delivery[J].J Controlled Release,1985,2:353-361.
[3]Lin H R,Sung K C.Carbopol/pluronic phase change solutions for ophthalmic drug delivery[J].J Controlled Release,2000,69(3):379-388.
[4]Ganguly S,Dash A K.A novel in situ gel for sustained drug delivery and targeting[J].Int J Pharm,2004,276(1-2):83-92.
[5]李素侠,曹德英.眼用即型凝胶的研究进展[J].中国医院药学杂志,2008,28(3):228-230.
[6]Helene H,Mattias P,Katarina E.Evaluation of mucoadhesion for two polyelectrolyte gels in simulated physiological conditions using a rheological method[J].Eur J Pharm Sci,2000,9:301-309.
[7]刁雨辉,周建平.眼用温敏凝胶释放度及其影响因素研究[J].广东药学院学报,2008,24(6):561-577.
[8]Bhardwaj R,Blanchard J.Controlled-release delivery system for the α-MSH analog melanotan-Ⅰ using poloxamer 407[J].J Phar m Sci,1996,85(9):915-919.
[9]Rathapon A,Anuvat S,Panida V.Viscoelastic properties of Carbopol 940gels and their relationships to piroxicam diffusion coefficients in gel bases[J].Pharm Res,2005,22(12):2134-2140.
[10]Srividya B,Cardoza R M,Amin P D.Sustained ophthalmic delivery of ofloxacin from a pH triggered in situ gelling system[J].J Controlled Release,2001,73(2):205-209.

