中草药饲料添加剂发酵菌种的筛选与发酵条件研究
湖南农业大学生物科学技术学院 兰时乐 李立恒 胡 超 林元山 谢达平
中草药饲料添加剂属于天然药物,大量研究表明,中草药饲料添加剂具有促进动物生长发育、提高饲料利用率、改善畜禽产品质量、增强动物免疫功能等作用(李洪龙等,2007;刘根新等,2007;王丽辉等,2007;李宗辉等,2002;唐建安等,2000),其研究和应用已受到国内外研究工作者的广泛关注。但由于中草药饲料添加剂的应用和研究存在用药成分复杂、含量低、适口性差、效果不稳定、用量大且难以掌握、毒副作用等问题,阻碍了中草药饲料添加剂的规模化推广应用。微生物发酵中草药饲料添加剂是利用微生物的降解作用,将中草药中的有效成分、活性物质最大限度地释放出来,并对中草药活性成分进行修饰产生新的活性物质。微生物在生长代谢过程中,可以产生各种各样的防病助生长的次生代谢产物,可将动物难以消化吸收的大分子物质转化成易于吸收的小分子物质,还可产生各种不同的酶,从而促进动物生长发育,缩短饲养周期,提高饲料报酬率,增强药效和降低饲养成本等。本文采用从不同中草药中分离能够发酵中草药的微生物,对中草药复方进行发酵,并测定了中草药复方发酵前后抑菌活性和纤维素酶、酸性蛋白酶活力的变化规律,以期为开发发酵型中草药饲料添加剂提供依据。
1 材料与方法
1.1 材料 中药:青蒿、鱼腥草、地骨皮、黄岑、贯众、胆草、石菖蒲、夏枯草、紫草、金银花、板蓝根等中草药,购于长沙市汽车东站中药材市场,无霉变和虫蛀。低温烘干,粉碎后,过40目筛,备用。
供试菌株:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、鼠伤寒沙门氏菌 (Salmonella typhimurium)、普通变形杆菌(Proteus vulgaris)。
1.2 培养基
1.2.1 中草药饲料添加剂浸煮液的制备 称取适量的中草药饲料添加剂复方,加入20倍的蒸馏水,煎煮30 min后粗过滤,取滤液于8000 r/min离心15 min,取上清液,减压浓缩5倍,备用。
1.2.3 霉菌分离培养基 马丁氏固体培养基 (沈萍和陈向东,2007)中加入0.8%去氧胆酸钠和5%中草药饲料添加剂水煮液,pH自然。
1.2.4 液体种子培养基 葡萄糖5%,豆饼粉1.5%,酵母粉 0.5%,KH2PO40.2%,MgSO4·7H2O 0.1%,CaCO30.4%。
1.2.5 发酵培养基 中草药饲料添加剂复方90%,麦麸5%,葡萄糖 3%,(NH4)2SO41.5%,KH2PO40.3%,MgSO4·7H2O 0.2%。
1.3 方法
1.3.1 中草药饲料添加剂发酵菌种筛选 分别称取10 g粉碎至40目的青蒿、鱼腥草、地骨皮、黄岑、贯众、胆草、石菖蒲、夏枯草等不同中草药于90 mL带有玻璃珠的无菌水中,振荡15 min后,适当稀释。分别取0.1 mL不同稀释度的中草药稀释液于细菌和霉菌分离培养基平板中央,涂布均匀。细菌平板在37℃培养48 h,霉菌平板在28℃恒温培养3~5 d进行初筛。将初筛得到的菌株采用平板划线法分离纯化后,分别接种于加有20%中草药饲料添加剂浸煮液的细菌和霉菌培养基中进行复筛,将复筛得到的菌株于4℃冰箱中保存待用。
1.3.2 培养 菌种活化:将供试菌株和Y-1接种于牛肉膏蛋白胨和PDA培养基斜面上,分别置于37℃和28℃恒温培养箱中培养48~72 h,备用。
液体种子培养:将培养成熟的斜面菌种Y-1接种于液体种子培养基中,28℃,180 r/min条件下培养72 h。
2)退出控制电源、储能电源后,继保人员手动复归,两信号消失。投分一次控制电源后,“告警”信号又出现,且无法复归。保护装置掉电重启后,告警信号可手动复归。再次分投一次控制电源,告警信号再次无法手动复归。
中草药饲料添加剂的发酵:按配方称取中草药饲料添加剂发酵培养基30 g于250 mL三角瓶中,自来水调节含水量50%,充分拌匀,110℃灭菌 30 min后,按10%(V/m)的接种量接种培养好的液体种子,28℃培养96 h,50℃烘干。同时以接种无菌水为对照。
1.3.3 发酵条件的研究 培养方法同1.3.2,替换不同的条件,如中药与麦麸的不同比例、碳源的种类、氮源的含量、起始pH值、含水量、温度等,考察Y-1霉菌发酵中草药饲料添加剂后对抑菌效果的影响及Y-1霉菌的产酶规律。
1.3.4 抑菌试验及酶活测定 发酵样品处理:称取10 g不同菌种的发酵物和各组对照物,加入200 mL蒸馏水,煮沸15 min后,3000 r/min离心15 min,收集上清液,残渣加入200 mL蒸馏水提取后,离心,合并上清液,真空减压浓缩至每毫升含1 g生药。
抑菌试验:取培养16~18 h的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和鼠伤寒沙门氏菌新鲜培养液5 mL,分别加入100 mL冷却至50℃左右的牛肉膏蛋白胨培养基中,混合均匀后,在直径为9 cm的标准培养皿中准确吸入15 mL含菌培养基,冷却成含菌平板。每个平板上放置3个灭菌的牛津杯,牛津杯中加入40 μL中草药饲料添加剂发酵浸提液。37℃培养24 h,测定抑菌圈的大小。每处理设3次重复。同时以未接种的为对照。
酶活测定:(1)粗酶液制备:称取经低温烘干的固体中草药发酵剂1.00 g于100 mL pH 4.8的磷酸缓冲液中,40℃ 浸提2 h,滤纸过滤,4000 r/min离心15 min,4℃冰箱保存备用。(2)纤维素酶活力测定:参照Vallander和Erik(1985)提供的方法并略作修改进行测定。(3)羧甲基纤维素酶(CMCase)活力测定:于25 mL具塞试管中加入浓度为 1%CMC-Na-醋酸缓冲液(pH 4.8)1.8 mL,加入0.2 mL粗酶液,50℃保温30 min后,加入3.0 mL DNS试剂,水浴煮沸5 min,冷却后用蒸馏水定容,摇匀,于540 nm处测定光密度值。酶活定义:在反应条件下,30 min水解羧甲基纤维素钠产生1 mg葡萄糖的酶量为一个酶活力单位(U);(4)FPA活力测定: 于 25 mL具塞试管中加入pH 4.8的醋酸缓冲液1.8 mL、新华滤纸50.0 mg以及酶液0.2 mL,50℃保温60 min后,加入3.0 mL DNS试剂,其他同CMCase酶活测定。酶活定义:在反应条件下,每60 min水解滤纸产生1 mg葡萄糖的酶量为一个酶活力单位(U)。(5)酸性蛋白酶活力测定:参照姜锡(1999)提供的方法进行测定。
2 结果与分析
2.1 中草药饲料添加剂发酵菌种的筛选 从青蒿、鱼腥草、地骨皮、黄岑、贯众、胆草、石菖蒲、夏枯草等中草药中共分离出22株微生物菌株,其中细菌14株,霉菌8株。将纯化的菌株点种在含药浓度逐步递增的固体培养基平板上,通过多次反复筛选,得到一株在中药复方中生长良好、发酵能力较强的菌株,初步鉴定为米曲霉Y-1。
2.2 中草药饲料添加剂与麦麸比例对Y-1霉菌产酶的影响及抑菌效果的影响 分别配制中药与麦麸不同比例(9∶1、8∶2、7∶3、6∶4)的发酵培养基,按10%(V/W)接种量接种Y-1种子培养液,28℃恒温培养72 h,测定酶活,同时提取发酵液进行抑菌实验,结果见表1、图1。
从表1可以看出,中草药饲料添加剂中添不同比例的麦麸发酵后对四种供试菌的抑菌效果都有不同程度的增加。当中草药饲料添加剂与麦麸的比例为7∶3时,发酵物料的蒸煮液对S.aureus、S.tyhimurium、E.coli、P.vulgaris的抑菌效果分别增加38.61%、22.32%、27.93%和11.4%。从产酶效果来看(如图1),在一定范围内,随着麦麸比例的增加,纤维素酶的活力增强,当中草药饲料添加剂与麦麸的比例为7∶3时,CMCase酶活达9870 U/g,FPA酶活为892 U/g,主要原因为中草药中含有大量的纤维素,能够诱导真菌纤维素酶的分泌,高纤维素酶活力可以破坏中草药的细胞壁,导致中草药有效成分的充分释放,从而提高了中草药发酵后的抑菌效果。而蛋白酶的酶活随着麦麸含量的增加而增加,主要原因为麦麸中含有一定量的蛋白质,可以诱导蛋白酶的合成和分泌。综合抑菌效果和各种酶的含量,以下试验均选择中草药饲料添加剂和麦麸的比例为7∶3。

表1 中草药饲料添加剂与麦麸比例对抑菌效果的影响

图1 中草药饲料添加剂与麦麸比例对酶活的影响
2.3 不同碳源对Y-1霉菌产酶的影响及抑菌效果 在其他条件相同的情况下,向培养基中分别加入1%的蔗糖、可溶性淀粉、麦芽糖、葡萄糖,以不加其他碳源为对照,28℃恒温培养120 h,测定纤维素酶和蛋白酶的酶活,并测定抑菌活力。结果分别见表2和图2。
从表2中可知,发酵培养基中添加适量的不同碳源,可以明显提高发酵中草药饲料添加剂的抑菌效果。在添加的四种碳源中,以添加葡萄糖的处理,发酵物料蒸煮液的抑菌效果最好,其次是蔗糖。与对照相比,添加葡萄糖对S.aureus、S.tyhimurium、E.coli、P.vulgaris 的抑菌效果分别提高了18.6%、24.79%、31.48%、17.6%。从图2中可以看出,葡萄糖为碳源时,发酵后物料的CMCase酶、FPA酶和蛋白酶的活力最高,分别达到9017、1062 U/g和7793 U/g,蔗糖次之。说明在发酵培养基中添加适量葡萄糖,可以促进霉菌Y-1的生长和酶的分泌。
2.4 培养温度对抑菌效果和酶活力的影响 将中草药饲料添加剂培养物分别置于不同的温度(28、30、32、35 ℃和 37 ℃) 下恒温培养 120 h,测定酶活和抑菌活性。结果分别见表3和图3。

表2 不同碳源对抑菌效果的影响

图2 不同碳源对酶活的影响
从表3可知,培养温度在28~32℃时,随着温度的升高,发酵物料的抑菌作用也随之提高,当培养温度为32℃时,发酵物料对S.aureus、S.tyhimurium、E.coli、P.vulgaris的抑菌活性较 28 ℃发酵时分别提高 19.08%、16.94%、9.42%和12.6%。但培养温度超过32℃,抑菌作用随着培养温度的升高而下降。不同培养温度对纤维素酶和蛋白酶的酶活影响也很大,CMCase酶活和蛋白酶酶活在32℃时最高,随着培养温度升高,酶活降低较为明显;FPA酶活在28~35℃变化不是很明显,但培养温度超过37℃,酶活同样降低(见图3)。因此确定培养温度为32℃。2.5 起始pH对抑菌效果和酶活的影响 在上述的基础上,选择不同的起始pH(5.0、5.5、6.0、6.5、7.0、7.5)进行发酵,考察不同起始 pH 条件下抑菌效果及酶活变化规律。结果见表4和图4。
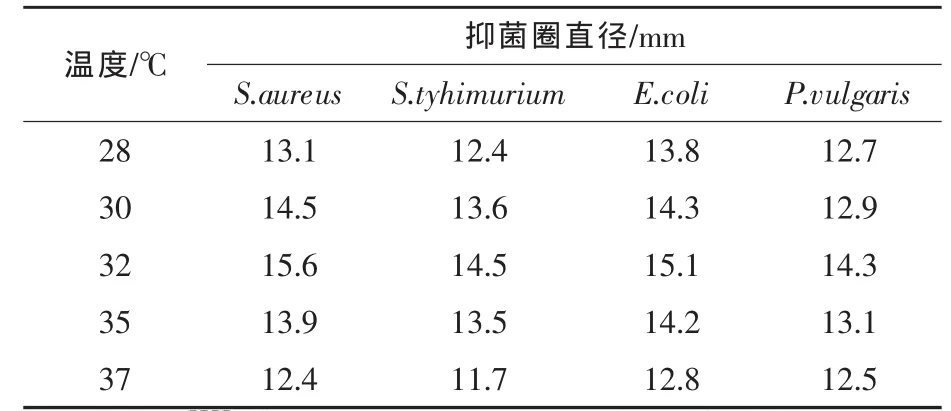
表3 不同培养温度对抑菌效果的影响

图3 培养温度对酶活的影响
表4和图4表明,发酵物料的初始pH值在6.0~7.0,对供试菌的抑菌效果变化不显著;而纤维素酶和蛋白酶酶活在pH 6.0~6.5保持较高的酶活力。因此,在发酵前可不需调节发酵物料的pH值,采用自然pH值即可。2.6 物料含水量对抑菌效果和酶活的影响 分别调节发酵培养基的含水量为30%、40%、50%、60%、70%,其他条件不变,考察不同含水量发酵条件下的抑菌效果和酶活变化。结果见表5和图5。

表4 起始pH值对抑菌效果的影响
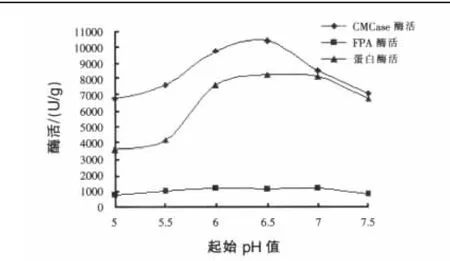
图4 起始pH值对酶活的影响
水是任何生物在生命活动过程中不可缺少的物质。固体基质中水分含量太少,会影响微生物对物质的分解利用和微生物的代谢活动;水分含量太高,会影响原料颗粒之间的松散性,使原料颗粒成团,影响氧的传递和发酵热的散失,并容易造成厌氧环境。从表5可以看出,当发酵物料的含水量为50%时,对四种供试菌的抑菌活性最高;从产酶的变化规律分析,CMCase酶和蛋白酶酶活力在含水量为60%时,酶活最高,分别达到8107 U/g和3158 U/g,而FPA酶活在含水量为50%时最高,达到1857 U/g(见图5)。为生产实际考虑,发酵物料的含水量控制在50%~60%为宜。
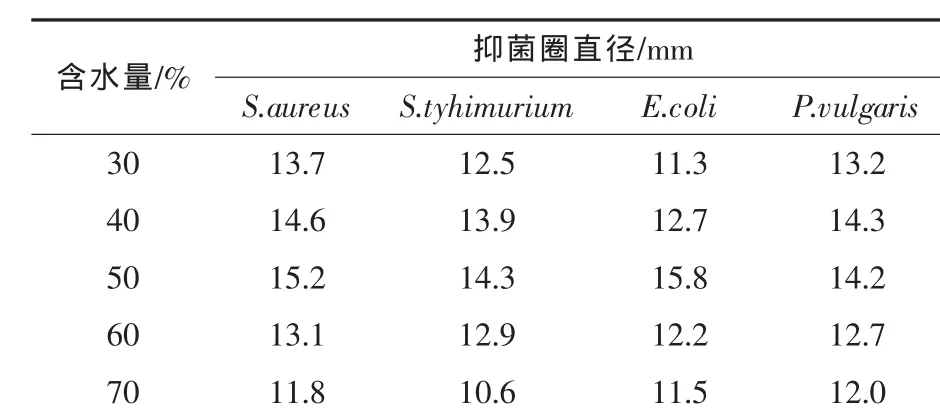
表5 含水量对抑菌效果的影响
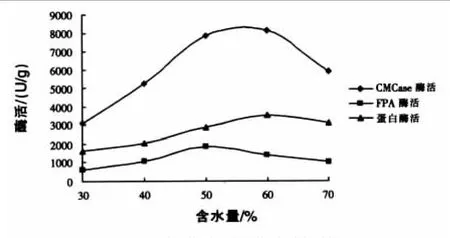
图5 含水量对酶活的影响
2.7 发酵时间对抑菌效果及酶活的影响 将中草药饲料添加剂发酵培养基分别培养不同时间(24、48、72、96、120 h),其他条件不变,取样低温干燥后测定抑菌效果和酶活。结果见表6、图6。
从试验结果可以看出,发酵时间对酶的产量和抑菌效果影响较大。发酵前期,主要是微生物生长阶段,随着培养时间的延长,微生物酶特别是纤维素酶合成量加大,中草药细胞壁破坏程度加剧,使中草药中有效成分逐步释放出来,到发酵72 h,中草药饲料添加剂发酵物料对四种供试菌的抑制效果较发酵前分别增加60.83%、41.32%、36.03%和27.64%,但发酵时间超过72 h,抑菌活性下降,原因可能为部分中草药有效成分被微生物酶修饰或被微生物转化为其他产物。从发酵时间对产酶规律的影响分析,发酵第96 h产酶达到高峰,CMCase、FPA酶和蛋白酶酶活分别达到9653、971 U/g和6357 U/g。综合发酵物料的抑菌活性,确定发酵时间为72 h。
3 结论
3.1 通过在分离培养基中加入中草药提取液,从中草药青蒿、鱼腥草、地骨皮、黄岑、胆草、夏枯草等中草药中筛选到1株能发酵中草药饲料添加剂的菌株,初步鉴定为米曲霉Y-1。
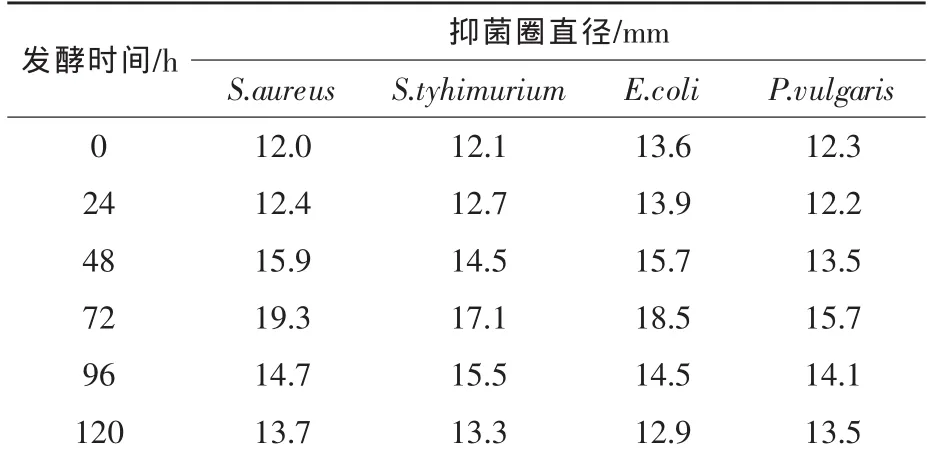
表6 发酵时间对抑菌效果的影响

图6 发酵时间对酶活的影响
3.2 通过对中草药饲料添加剂发酵条件的研究,确定了中草药饲料添加剂合适的发酵条件为:中草药饲料添加剂与麦麸的比例为7∶3、葡萄糖1%、发酵温度32℃、初始pH自然、物料含水量50% ~60%、发酵周期为72 h。在此条件下,发酵料蒸煮液对大肠杆菌、金黄色葡萄球菌、普通变形杆菌和鼠伤寒沙门氏菌的抑菌活性分别较对照提高 36.03%、60.83%、27.64%、41.32% ,CMCase、FPA酶和蛋白酶酶活分别达到9653、971 U/g和 6357 U/g。
[1]王丽辉,吴德峰,郑真珠.中草药调节剂对生态兔的抗菌和免疫作用研究[J].中国养兔杂志,2007,2:13.
[2]唐建安,张翠平.复方中草药添加剂促进仔猪生长试验及机制探讨[J].四川畜牧兽医,2000,27(12):18 ~ 19.
[3]沈萍,陈向东.微生物学实验,第四版 [M].北京:高等教育出版社,2007.241~242.
[4]李宗辉,张春桂.自拟中草药饲料添加剂饲喂生长猪的效果[J].青海畜牧兽医杂志,2002,32(2):9 ~ 10.
[5]李洪龙,官丽辉,孙明梅,等.中草药饲料添加剂对生长肥育猪生长性能的影响[J].黑龙江畜牧兽医,2007,1:57 ~ 58.
[6]刘根新,王福厚,李勇生,等.中草药添加剂促进蛋鸡生产性能的试验研究[J].饲料广角,2007,11:12.
[7]姜锡.酶制剂应用手册[M].北京:中国轻工业出版社,1999.40~50.
[8]Vallander L,Erik K E.Enzymic Saccharification of pretreated wheat straw[J].Biotechnology and Bioengineering,1985,17:639 ~ 650.

