实验性小鼠肺纤维化过程中 IL-31mRNA的动态表达及意义△
江苏大学附属医院呼吸内科(镇江 212001) 郑金旭 徐丽娜 范利娟
肺间质纤维化是多种细胞和细胞因子参与的免疫炎症相关疾病,其发病机制尚未完全明了。目前,细胞因子网络在介导其早期肺泡炎及以后的纤维化过程中所起的作用日益受到重视。白细胞介素 31(Interleukin-31,IL-31)是 2004年新报道的细胞因子,属于白细胞介素 6(Interleukin-6,IL-6)家族成员[1],通过诱导某些趋化因子表达,发挥促脏器炎症的作用。本研究通过动态观察 IL-31 mRNA在肺纤维化发展各阶段的变化规律,在国内率先探讨 IL-31在肺纤维化发病机制中的作用,进一步完善细胞因子网络结构在肺纤维化中的调控。
材料与方法
1 动物与试剂 实验用 6周龄雄性昆明种小鼠40只,体重 18~22g,由江苏大学实验动物中心提供。随机分为两组,即:对照组:24只,仅给予生理盐水;实验组 24只,给予博莱霉素溶液。博莱霉素(Bleomycin,BLM)15mg/支(1mg=1U),由日本化药株式会社生产。DEPC购自 Sigma公司。Trizol试剂购自Invitrogen公司。
2 实验方法
2.1 肺纤维化动物模型的建立 实验小鼠用4%水合氯醛(0.01ml/g)腹腔注射麻醉,仰卧于手术台上,固定头部及四肢,无菌条件下切开颈部皮肤,暴露气管,经气管一次性注入配制好的博莱霉素溶液 (5 mg/kg),注射后立即将小鼠直立旋转 2min,尽量使药液在肺内均匀分布。对照组在相同条件下经气管注入等体积生理盐水。
2.2 标本的处理 给药后第 7、14、21、28天经颈椎脱臼法每组分别处死 6只小鼠。无菌条件下分离出气管和双肺,右侧肺组织用于检测 IL-31mRNA,左侧完整肺叶置于 4%多聚甲醛中固定,常规切片,HE染色。
2.3 检测项目及方法
2.3.1 病理观察 左肺石蜡切片行 HE染色,由病理科医师在光学显微镜下观察肺组织病理学改变。
2.3.2 Real-time PCR测定肺组织中 IL-31mRNA的相对表达 取 40~ 50mg新鲜组织立刻加入 DEPC处理过的 1.5ml离心管中,加入 1ml Trizol,匀浆破碎组织,室温静止 5min,加入 200 μ l氯仿,剧烈震荡 15s,12000G 4℃低温离心 15min,小心吸取上清液 400 μl置于另一 1.5ml离心管中,加入 600 μ l异丙醇,轻轻颠倒混匀,室温静止 10min,12000G 4℃低温离心 10min,去处上清液,加入 1ml DEPC处理过的水配置的 75%乙醇,7500G 4℃低温离心 10min,去处上清液,室温干燥 RNA约 5min后加入 20 μ l DEPC处理过的水溶解,样品置于-70℃保存。此即小鼠总 RNA。逆转录反应按试剂盒说明进行操作。将逆转录得到的cDNA进行 PCR反应,检测 IL-31mRNA的表达。反应体系为 25 μ l,包括:10×定量 PCR缓冲液 2.5μ l、1 μ l cDNA 模板、1 μl dNTP(10 mmol/L)、2.5 μlMgCl2(25mmol/L)引物各 1 μl(5pmol/μ l)及 5U/μ l定量 Taq聚合酶 0.2 μl,Sybergreen I(20× )0.25 μ l,用 dd H2O补足至 25 μ l。 PCR循环参数为:94℃预变性 3min,使用 3步法,具体为 94℃45s,IL-31 60℃ /GAPDH 55℃ 45s,72℃ 60 s,35个循环扩增。 取 10 μl PCR产物行琼脂糖凝胶电泳分析。
基因引物序列和片段长度如下:①IL-31基因引物:正义链为:5'-TTCCACAC AGGAACAACGAA-3'(201bp),反义链为:5'-TGAT TCGTCTGCTGACA TCC-3';②GAPDH基因引物:正义链为:5'-GCTGGT CATCAACGGGAAA(105bp),反义链为:5'-ACGCC AGT AGACTCCACGACA-3'。
3 统计学处理 采用 SPSS13.0软件处理系统,实验数据以均数±标准差)表示,多组均数间采用单因素方差分析,两两比较采用 LSD-t检验,以 P<0.05为有显著性差异,P<0.01为有极显著性差异。
结 果
1 肺组织病理学变化 见图 1~ 5。实验组动物第 7天时肺泡间隔增厚,肺内可见广泛炎性细胞浸润,并可见成纤维细胞增生,其中可见少量纤维组织。第14~ 28天肺泡炎逐渐减轻,纤维化病变逐渐加重,第28天时肺实质内可见大片纤维结缔组织沉积,肺泡结构多数破坏。而对照组肺内结构正常。

图1 对照组小鼠肺组织镜下变化(HE染色 10×10)

图2 BLM干预后第 7天小鼠肺组织镜下变化(HE染色 10× 10)
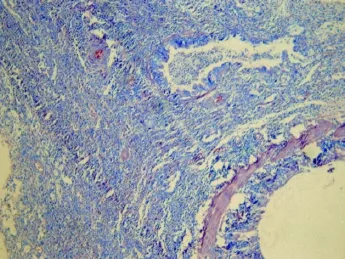
图3 BLM干预后第 14天小鼠肺组织镜下变化(HE染色 10× 10)
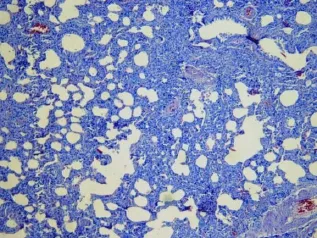
图4 BLM干预后第 21天小鼠肺组织镜下变化(HE染色 10×10)

图5 BLM干预后第 28天小鼠肺组织镜下变化(HE染色 10× 10)
附表 两组肺组织中 IL-31m RNA表达情况比较±s,IL-31/GAPDH)

附表 两组肺组织中 IL-31m RNA表达情况比较±s,IL-31/GAPDH)
注:与对照组比较,# P<0.05,* P<0.01
?
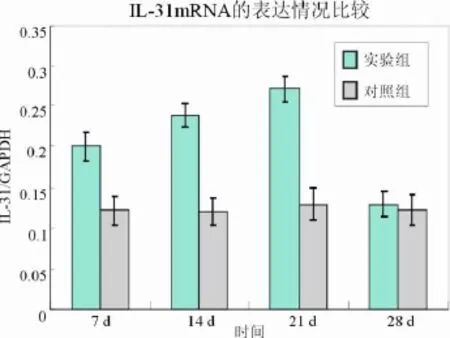
图6 两组 IL-31m RNA表达情况

图7 实验组 IL-31m RNA琼脂糖凝胶电泳结果
图8 实验组 GAPDHm RNA琼脂糖凝胶电泳结果
2 RT-PCR法测定肺组织中 IL-31mRNA含量的变化 见附表及图 6~ 8。实验组中 IL-31m RNA表达水平在第 7、14、21天高于对照组(P <0.05)。
讨 论
肺间质纤维化是多种细胞和细胞因子参与的免疫炎症相关疾病[2],临床上各种类型肺纤维化皆以成纤维细胞增殖及大量细胞外基质聚集为特征[3]。多种细胞因子组成的复杂网络在肺局部损伤、炎症反应以及随后的组织修复和纤维化过程中起着重要作用[4]。
IL-31是 2004年新报道的细胞因子,在生理状态下 IL-31基因表达水平较低,炎性反应时主要由活化的 T细胞产生。 IL-31R α在人Ⅱ型肺泡上皮细胞微量表达,支气管上皮细胞有轻度表达[5]。 IL-31在支气管哮喘等疾病中发挥作用,同时还具有调节细胞增殖,诱导趋化因子等作用[6]。IL-31属 IL-6家族成员,IL-6可诱导肺内成纤维细胞合成释放 C反应蛋白等急性期蛋白,促进非特异性的炎症反应。肺泡巨噬细胞被激活可通过分泌 IL-6而参与早期肺泡炎和后期肺纤维化的形成。IL-6可独自或与 TNF-α联合作用促进纤维化的形成[7]。
在参与肺纤维化的细胞因子网络中,T GF-β是目前研究较为明确的细胞因子,其促进纤维化生成的分子机制已基本肯定。有报道,在原代培养的肺泡上皮细胞、肺成纤维细胞、肺泡巨噬细胞中均有 IL-31R α mRNA表达,用 T GF-β刺激后检测到在原代培养的肺泡上皮细胞中 IL-31R α mRNA的表达增多。研究表明,IL-31R α的表达增多与 IL-31的增多呈关联性[8]。推测 TGF-β除本身具有促纤维化功能之外,还可能刺激 IL-31的表达,二者共同参与肺纤维化的发生和发展。本实验研究结果显示,正常对照组小鼠肺内仅有少量 IL-31mRNA的表达。在实验组小鼠的病变早期(第 7天),肺组织中的 IL-31m RNA表达水平即增高,且随天数增加,含量呈增高趋势,到第 21天时达到高峰。由此可见,IL-31参与肺纤维化形成的各个阶段,但主要在肺纤维化中后期发挥重要作用。
本研究结果表明,IL-31在肺纤维化各阶段表达明显高于正常对照组,提示在肺纤维化过程中起重要作用,是参与肺纤维化形成的新的细胞因子。 IL-31在肺纤维化中发挥的作用以及与 TGF-β等其它细胞因子之间的关系尚待进一步探讨。
[1] Diveu C,Lelievre E,Perret D,et al.GPL,a novel cytokine receptor related to GP130 and leukemia inhibitory factor receptor.JBiol Chem,2003,278(50):49850-49859.
[2] 杨振平,王万征.特发性肺纤维化 36例临床分析[J].陕西医学杂志,2009,38(7):821-822.
[3] 席建堂,万毅新.肺纤维化病因学进展[J].陕西医学杂志,2006:35(6):721-723.
[4] Coker PK,Laurent GJ.Pulmonary fibrosis:cytokines in the balance.Eur Respir J,1998,11(6):1218-1221.
[5] Jawa RS,Wang Y,Chattopadhyay S,et al.Suny Buffalo expression and regulation of receptors for interleukin 31,a novel cytokine.J Surg Res,2007,137(2):316-317.
[6] Dillon SR,Sprecher C,Hammond A,et al.Interleukin-31,a cytokine produced by activated T cell,induces dermatitis in mice.Nat Immunol,2004,5(7):752-760.
[7] Smith RE,Strieter RM,Phan SH,et al.TN F and IL-6 mediate M IP-1α expression in bleomycin-induced lung injury.J Leukoc Biol,1998,64(4):528-536.
[8] Jawa RS,Chattopadhyay S,Tracy E,et al.Regulated expression of the IL-31receptor in bronchial and alveolar epithelial cells,pulmonary fibroblasts,and pulmonary macrophages.J Interferon Cytokine Res,2008,28(4):207-219.

