PepT1基因绝对荧光定量PCR标准曲线的建立
李慧锋,李丽,张丽娟,徐玉良,李武峰
(山西农业大学生命科学学院,山西太谷 030801)
小肽跨膜转运是一种自然界普遍存在的现象,在人、动物、细菌、真菌以及高等植物发芽种子中都有发现[1]。小肽转运载体PepT1是质子依赖型转运载体,是动物组织内一个重要的生理过程,通常是通过动物小肠进行表达的[2]。
小肽对动物营养有着特殊的意义,一方面在吸收过程中,小肽与游离氨基酸的吸收是两个相互独立的转运系统,与游离氨基酸相比,小肽具有吸收速度快、耗能低、不易饱和,且各种肽之间转运无竞争性与抑制性等特点,有关资料表明在蛋白质消化过程中,以肽形式存在的氨基酸浓度远比游离氨基酸存在的浓度大,而且肽的吸收速度也快[3~4]。另一方面它也可以提高动物的生产性能,如改善肉质、促进动物对矿物元素的吸收和利用,并为动物营养学家们配制高效的饲粮配方提供理论依据,为进一步改善饲粮蛋白质的利用效率、节约蛋白质资源开辟新的途径。
小肽转运蛋白参与二肽和三肽的跨膜转运,二肽和三肽吸收是逆浓度进行的,其转运系统主要是依赖pH非耗能性Na+/H+泵转运系统。质子原动力为小肽的跨膜转运提供能量,使之有别于其它物质跨膜转运而成为一种独特的转运机制,对于小肽的吸收利用具有重要作用。
为了测定鸡肠道中的小肽转运载体PepT1基因的绝对表达量,我们采用了SYBR Green模式的荧光定量PCR技术。该方法是利用荧光染料SYBR Green I与DNA双链结合后释放荧光的特点而建立的一种应用较广的荧光定量PCR技术,它具有成本低,不需设计探针,且适合于高度变异基因的检测等优点[5],并可避免污染所导致的假阳性发生。近年来发展很快,以其快速、灵敏、特异性强等优点广泛应用到基因表达水平的实验分析中[6~9]。绝对定量的目的是测定目的基因在样本中的分子数目,即通常所说的拷贝数。而相对定量的目的是测定目的基因在两个或多个样本中的含量的相对比例,而不需要知道它们在每个样本中的拷贝数。绝对定量的数据易于理解,而且清楚明了,最后用建立出的标准曲线对未知样品进行定量分析。
本研究旨在建立SYBR绝对荧光定量PCR来研究其肠道中PepT1基因在不同生长时期的表达变化规律。采用鸡小肠总 RNA反转录成cDNA,并经过克隆PepT1基因的部分片段等步骤制备出荧光定量 PCR标准曲线,用于测定不同个体中PepT1基因mRNA表达的拷贝数。研究其肠道中PepT1基因在不同生长时期的表达变化规律。
1 材料和方法
1.1 实验材料
1.1.1 实验用鸡
选择艾维茵肉鸡,用于提取小肠组织总RNA。
1.1.2 仪器和试剂
台式高速冷冻离心机,旋片式真空泵,PCR仪,荧光定量PCR仪,恒温振荡器,微量核酸测定仪。反转录酶M-MLV,E.Z.N.A.TMPlasmid Mini KitⅠ,2×SYBR Premix EX TaqⅡ均由Takara公司生产。
1.1.3 引物
PCR克隆引物:上游引物ACTGTCAATCCAATCCTG,下游引物GACAGTCACGTTCTGAAGA,扩增产物长度为282 bp,引物由北京优博基因科技有限公司合成。荧光定量PCR引物:上游引物CCCCTGAGGAGGATCACTGTT;下游引物CAAAAGAGCAGCAGCAACGA;扩增产物长度为66 bp,该引物的扩增产物位于以上的克隆片段内,也是由北京优博基因科技有限公司合成。
1.2 总RNA的提取、定量及合成cDNA
1.2.1 总 RNA的提取、定量
将1.6 mL Trizol提前加到2 mL进口离心管中,4℃存放1~2 h;用研钵研磨组织样至粉状,然后转移至装有T rizol的离心管中,使劲震荡使溶液混匀;在装有裂解物的离心管中加入0.32 mL的氯仿,用力振荡混匀,4℃离心17 800 g,16 min;将上清液转移到已加入等体积的异丙醇离心管中,轻轻颠倒混匀,室温静置10 min,4℃离心17 800 g,12 min;弃上清液,在 RNA离心管中加入 1 mL75%乙醇,振荡清洗,4℃离心8 000 g,5 min;小心吸弃上清液,干燥5 min;加入适量DEPC水使RNA沉淀溶解,存放于-70℃。用微量核酸测定仪测定RNA的浓度。
1.2.2 cDNA的合成
反转录在25 μ L体系中进行,首先按 RNA浓度计算不同编号的RNA需要的总RNA的体积,按计算值依次添加2 μ g总 RNA,加入 OligodT 2 μ L,置 70 ℃水浴 5 min;然后依次加入 M-MLV RT 5 ×Buffer 5 μ L,10 mmol◦ L-1dNTPs 5 μ L,200 U ◦μ L-1M-MLV 1 μ L,RNA 抑制酶 0.625 μ L,用DEPC处理的ddH2O补至25 μ L。反应程序为37℃2 h,95℃5 min,产物置-20℃备用。
1.3 荧光定量PCR标准曲线的制备
1.3.1 PepT1基因部分片段的扩增
PCR反应体系为 80 μ L:8 μ L10 ×Buffer,2.5 mmol◦ L-1dNTP 6.4 μ L,5 μ mol◦L-1克隆引物上游和下游各 8 μ L,rTaq酶 1.6 μ L,cDNA 模板4 μ L,ddH2O 44 μ L(Takara Taq,10 ×PCR Buffer,dNTP Mixture购自Takara公司)。PCR反应程序为:94℃预变性→94℃1 min→60℃30 s→72℃1 min,35个循环;72℃延伸8 min,反应结束后,将扩增产物经1%的琼脂糖凝胶电泳观察。
1.3.2 连接转化
按照DNA回收试剂盒的操作说明对PCR产物进行纯化、回收。将纯化产物与PMD18载体连接,连接体系为 10 μ L,其反应组分为:PMD18 载体1 μ L,纯化后的 DNA 4 μ L,SolutionⅠ5 μ L,将连接体系置于4℃冰箱中过夜后加入到200 μ L感受态大肠杆菌DH5α中(PMD18载体,感受态细胞 DH5α均购自Takara公司),冰浴30 min后42℃热击90 s,冰浴5 min,加入无氨苄青霉素的 LB液体培养基800 μ L,37℃摇菌1 h,取200 μ L菌液均匀涂于LB培养基上,过夜培养后挑取单菌落白斑,放入50 mL LB液体培养基37℃、200 r◦min-1振荡过夜培养。
1.3.3 提取质粒
取出40 mL菌液,分别放入8个5 mL的离心管中,按照E.Z.N.A.TM Plasmid Mini KitⅠ试剂盒的使用说明,在室温离心1 min,10 000 g,弃上清,加入250 μ L试剂盒所配备的溶液solutionⅠ ,混匀;再加入 250μ L solution Ⅱ,混匀;最后加入350 μ L solutionⅢ混匀,则出现白色絮状物。再在室温下离心10 min,13 000 g,用移液枪把液体移到制备管里,放入2 mL的收集管中,在室温下离心1 min,10 000 g。把废液弃去,重新用2 mL收集管,加入 500 μ LBufferHB,清洗制备管 ,在室温下离心1 min,10 000 g,这步是确保蛋白质能去掉。把废液弃去,加入700 μ L DNA Wash Buffer,加之前要确保Wash Buffer加入乙醇(若没加乙醇则会溶解DNA),在室温下离心1 min,10 000 g,把废液弃去,室温下离心2 min,13 000 g,干燥。把制备管放在一个干净的1.5 mL离心管中,加入60 μ L ddH2O,室温下放置 2 min,离心 1 min,13 000 g。使其DNA溶解。
1.3.4 测浓度计算质粒拷贝数
由于我们所使用的是小量质粒提取试剂盒,提出来质粒的浓度比较低,但我们需要高浓度的质粒,所以我们要将溶液浓缩。首先用移液枪把8个离心管的质粒混到一个离心管里,放到真空泵上,打开真空泵,使得水分蒸发,溶液浓缩,直到溶液浓缩到60 μ L。测其浓度为254.9 mg◦L-1.按以下公式计算质粒拷贝数:质粒拷贝数(copies◦μ L-1)=6.02×1023(copies◦mol-1)×质粒浓度(g◦μ L-1)/质粒分子量(g◦mol-1),则得出质粒拷贝数为1.67×1011。
1.3.5 标准曲线的建立
将标准质粒用ddH2O进行10倍系列稀释,分别稀释成1×1010~1×105copies◦μ L-1的6个梯度,作为模板(稀释的时候用移液枪吹打30次,振荡10 s,然后离心,使得溶液充分混匀),进行荧光定量PCR来建立标准曲线。25 μ L荧光定量PCR体系:模板 1μ L,荧光定量 PCR 上、下游引物各0.5 μ L,SYBR Premix Ex Taq Ⅱ 12.5 μ L,ddH2O 10.5 μ L。PCR反应程序为:95℃3 min;95℃10 s→60℃30 s→72℃30 s,40个循环;72℃5 min;生成溶解曲线步骤:55℃30 s,每30 s升温0.5℃,81个循环。根据荧光值的变化规律,系统将自动生成标准曲线和溶解曲线。
1.4 荧光绝对定量PCR测定PepT1基因的表达
依照1.3.5中体系将所得cDNA进行荧光定量PCR,通过标准曲线得出出雏当天小鸡的cDNA的起始拷贝数。取出出雏当天小鸡的cDNA样品中的1个样做两个重复,进行荧光定量PCR,各加入底物 1 μ L,上、下游引物各 0.5 μ L,SYBR Premix Ex Taq Ⅱ12.5 μ L,ddH2O 10.5 μ L 。 通过PCR反应程序,系统将自动生成结果。
2 结果与分析
2.1 克隆和定量片段PCR扩增
用克隆引物进行PCR反应,反应结束后,将扩增产物经1%的琼脂糖凝胶电泳观察(图1)。结果均扩增出大小为282 bp的特异性片段,与预期大小一致。

图1 PCR电泳图Fig.1 Electropherogram of PCR product
2.2 绝对定量标准曲线
通过Real-time PCR仪扩增,自动检测PepT1基因的标准曲线和溶解曲线(图2,图3)。

图2 鸡PepT1基因Real-time PCR标准曲线Fig.2 The Standard curve of Real-time PCR of PepT1 gene of chicken
图2得到的标准曲线为:Y=-3.205X+34.170(Y:Ct值,X:起始模板量)。曲线回归系数R2=0.990,这说明在标准质粒稀释质量浓度范围内具有良好的线性关系。曲线的扩增效率为E=105.1%。
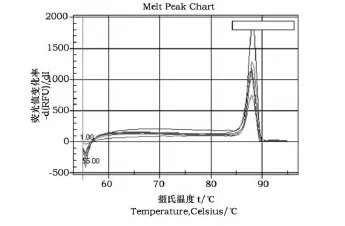
图3 鸡PepT1基因扩增的溶解曲线图Fig.3 The melting curve of PepT1 gene of chicken amplification product
图3溶解曲线表现为单一的峰值,产物的Tm值均一,说明引物具有很好的特异性。
以上结果显示本研究建立的标准曲线能够准确地反映目的产物的扩增。
2.3 荧光绝对定量PCR测定PepT1基因的表达
表1为出雏当天小鸡的cDNA样品中PepT1基因表达的起始拷贝数。
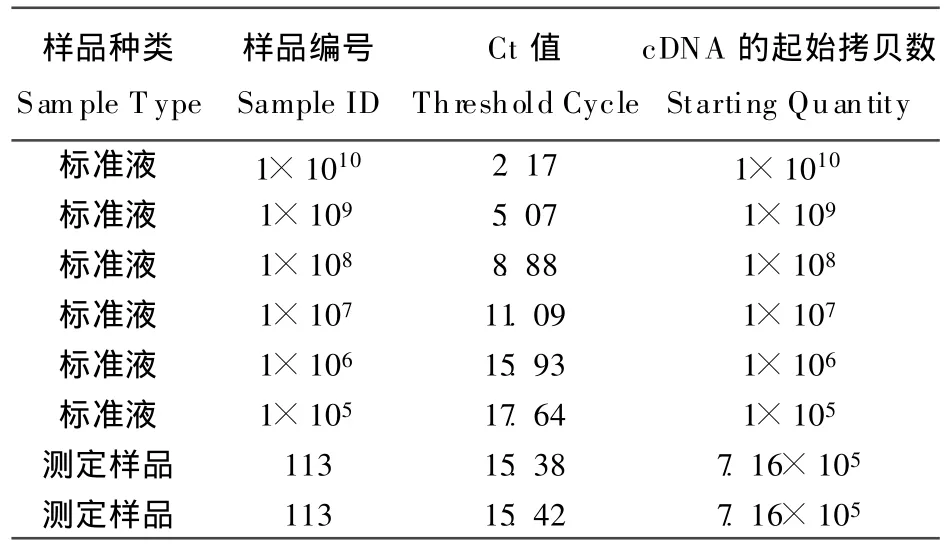
表1 出雏当天小鸡的PepT1基因表达的起始拷贝数Table 1 Starting quantity of PepT1 expression in Chicken at day of hatch
结果得出未知样品113中PepT1基因表达的起始拷贝数为7.16×105。这表明 1 μ L cDNA 样品中经荧光定量PCR方法检测到PepT1基因的mRNA的绝对数量为7.16×105个。在反转录过程中,我们在25 uL反应体系中用到的总RNA为2 μ g,因此可得出每 μ L cDNA 样品是由 0.08 μ g总RNA反转录得到。最终我们可以算出PepT1基因在小肠细胞每μ g总RNA中的绝对表达量为7.16×105/0.08=8.95×106拷贝。
3 讨论与结论
本试验首先将鸡小肠PepT1的部分克隆片段插入质粒载体,将质粒作一系列等体积的倍比稀释,来作为PCR反应的底物,经过PCR反应,最后检测出来用作标准来测定未知样品。检验结果表明该方法具有高的特异性和准确性,同时具有高敏感性,能够用于鸡小肠PepT1mRNA的定量分析。
迄今为止,小肽在体内的代谢、利用机制,以及日粮中究竟有多少氮以小肽的形式被吸收尚不清楚;参与小肽吸收利用的调节因素,包括消化道激素、生长激素和体内有关代谢产物等,以及在不同动物生长发育过程中,日粮蛋白质的种类和数量、体内激素和有关代谢产物对PepT1基因表达的调控作用,都有待于深入研究[10]。如何利用在消化过程产生的肽种类、数量、比例,以及小肽不同于游离氨基酸吸收利用的特点对饲料中的可利用氨基酸进行重新评定,也需深入研究。在进行鸡的分子生物学研究时,Real-time PCR是作为有力的工具之一,本试验建立的鸡PepT1基因的绝对荧光定量方法,具有检测范围广(Ct值范围从2~18),特异性强(熔解线分析显示产物特异的单个峰)的特点,将为测定鸡小肠PepT1基因在小肠中的绝对表达提供基础。
[1]孙建义,许梓荣,李卫芬,等.小肽转运蛋白(Pep T1)基因研究进展[J].动物营养学报,2002,14(4):1-6.
[2]M atthew S D M.Protein absorption of peptide:development and present state of subject[M].New York:Wiley-Liss,1991:355-357.
[3]Hannelore D.Molecular and integrative phy siology of intestinal peptide transport[J].Annu.Rev.Physio l,2004,66:361-384.
[4]Holmberg A,Kaim J,Persson A,et al.Effects of digestive status on the reptilian gut[J].Comp.Biochem.Physiol.2002,133(3):499-518.
[5]张鋆.荧光实时定量PCR技术初探[J].生命科学趋势,2003,1(4):1228.
[6]Bustin S A.Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays[J].J M ol Endocrinal,2000,25:169-193.
[7]武聚富,张中文,吴国娟,等.鸡传染性支气管炎病毒荧光定量PCR标准曲线的建立[J].北京农学院学报,2009,24(4):40-43.
[8]Niesters H G.Quantitation of viral load using real-time amplification techniques[J].Methods,2001,25:419-429.
[9]王霞泰,蒋伟娇,周双海,等.猪GM-CSF荧光定量PCR检测方法的建立[J].北京农学院学报,2009,24(2):51-53.
[10]邓敦,钟华宜,印遇龙,等.小肽转运蛋白(PepT1)及其活性调控[J].广西农业生物科学,2005,24(4):352-357.

