卵巢癌卡铂耐药相关肿瘤抑制基因差异表达的研究
唐兆前,李 力,张 玮,王 琪,唐步坚
多药耐药是卵巢癌化疗过程中普遍存在的现象,是影响疗效的重要因素。迄今为止对多药耐药尚无有效的预测和诊断指标供临床参考,因而处理多为后置性,这也是导致卵巢癌治疗失败的重要原因。卵巢癌多药耐药机制复杂,主要原因在于多种基因共同参与耐药性的形成。基因芯片技术是近几年在分子生物学研究方面的新技术,该技术是一项探索疾病发生发展的分子机制、提供基因诊断与治疗理论依据的前沿性生物技术。已有研究证实肿瘤组织细胞中的抑癌基因参与了多药耐药的调节机制[1-2]。本研究利用本实验室原有的卵巢癌卡铂耐药表达谱芯片,应用生物信息学方法分析筛选出17个肿瘤抑制基因,并应用 RT-PCR技术对结果进行检测和验证,为探讨卵巢癌卡铂耐药机制提供可靠的实验数据。
1 材料与方法
1.1 材料 RNA抽提试剂 TRIzol购自 Invitrogen公司;反转录试剂盒 Revert Aid Fiststrand cDNA Synthesis Kit购自 Fermentas公司;凝胶成像系统 quality-one,Chromo4 Real-Time PCR Detector实时荧光定量 PCR仪均购自美国 Bio-rad公司;基因芯片为 2006年上海康成生物公司制作的卵巢癌卡铂耐药细胞系 SKOV3-CB及其亲本细胞 SKOV3细胞系的表达谱芯片。SKOV3-CB细胞系较其亲本 SKOV3细胞系差异表达下调倍数两倍以上基因 1 554个。
1.2 生物信息学分析 在 “www.ncbi.nlm.nih.gov”网站查找肿瘤抑制基因 “tumor suppressor gene”的信息,查询 1 554个基因,筛选出 17个肿瘤抑制基因。
1.3 细胞系及细胞培养条件 化疗敏感细胞系 SKOV3系本实验室冻存,来源于中国科学院上海生物细胞研究所细胞库。耐卡铂细胞株 SKOV3/CB系本实验室模拟临床周期性化疗采用间断大剂量药物作用于亲代细胞建株诱导建立[3],耐药指数3.31。常规用 1640培养液 (含 10%的小牛血清,青霉素 G 100 U/ml,链霉素 62.5μg/ml)培养,37℃、5%CO2、0.5%胰蛋白酶消化传代。
1.4 总 RNA提取及反转录
1.4.1 总 RNA制备 细胞长满瓶底的 70%~80%时,收获细胞 1~5×107,移入 1.5 ml离心管中,加入 1 ml Trizol,混匀,室温静置 5min。参考 Trizol说明书依次加入 0.2ml氯仿,振荡 15 s,静置 2m in。4℃离心,12 000×g离心 15 min,取上清液。加入 0.5ml异丙醇,将管中液体轻轻混匀,室温静置 10min。4℃离心,12 000×g离心 10 min,弃上清。加入1ml75%乙醇,轻轻洗涤沉淀。4℃,7 500×g离心 5 min,弃上清。晾干,加入适量的 DEPC水溶解 (65℃促溶 10~15 min)。所提取的总 RNA经凝胶电泳后,使用紫外分光光度仪检测抽提总 RNA的质量和浓度。要求 A260/A280=1.8~2.0,并计算 RNA含量。
1.4.2 cDNA合成 反应体系 20μl。取 Oligo2dT 0.5μg,每一标本取总 RNA 2μg,Rnasin 40 U,dNTP终浓度 0.5mmol/L,5×反应缓冲液4μl,DTT终浓度为 0.01mol/L,M2MuLV逆转录酶 200 U,加无 RNA酶水至20μl。42℃50min,70℃15min行反转录。合成好的 cDNA置 -80℃保存备用。
1.5 real-time RT-PCR反应
1.5.1 引物设计 根据 Genebank人类基因的 cDNA序列,应用引物设计软件 Primer5.0设计引物,引物由上海生工生物技术有限公司合成如下:RNASET2上游 5′TTGGCAGAAGCCTGGAAC 3′下游 5′CTGGCAAGGGCATCTTTA3′118 bp,VHL上游5′ATCGTCAGGTCGCTCTACG3′下游 5′GATATGCTGCAATTCCCACT 3′431 bp,DLG1上游 5′TGTCATCCTACCCACCATACC 3′下游 5′TCTTTCAACGCTTCAACTGCT 3′336 bp,COPS2上游5′TGGTGCAGTGCATATTGGATA 3′下游 5′CTGACTACAGCCTGGTTGAGA 3′154 bp,NOL7上游 5′GGAGGAAGACGAGGAAGGG 3′下游 5′CCTGGCGATTTCTTGATGT 3′258 bp,GGNBP2上游 5′CGTTGTTTGGTCCCGATTC 3′下游 5′ATTTGCTCCAGCCGTTGTC 3′254 bp,RBL1上 游 5′ACCACCAAAGTTACCACGAA 3′下游 5′AGGTCCAGGAGGCATTCTC 3′417 bp,S100A2上游 5′AAGAGGGCGACAAGTTCAAG 3′下游5′CAAGAGTTCTGCTTCAGGGTC 3′243 bp,PARG1上游 5′GATTCCTACCCTCTCGCTCC 3′下 游 5′GCTTCTCCTCATTCCCCCT 3′115 bp,PERP上游 5′GGTCCAAACCTGTTGCCATAG 3′下游 5′CAGAGAAACTCAAATCCCCGA 3′467 bp,TCF3上游5′TCCTACAGTGGGCTAGGGC 3′下游 5′CTTTGGGATTCAGGTTCCG 3′403 bp,DNAJA3上游 5′GGCTCCATCATCATATCGC 3′下游 5′TTAGCCTCTTTGGAACTCGTAT 3′406 bp,PCGF2上游 5′ACGAGGACGAGCCACTGAA 3′下 游 5′GGAGCCTTGTCGCTGACTGA 3′202 bp,ING1上游 5′ATGATCGGCTGCGACAAC 3′下游 5′CCATCCCTATGAAAGGAATGG 3′315 bp,CYLD上游 5′TGATGGAGTGCAGCTTTGTAGT 3′下游 5′GAGTGGTGGTGAAGAACGGTC 3′367 bp,RARRES3上游 5′ACACCAAGAGCCCAAACC 3′下 游 5′GCATCCAGCAACAACCAG 3′442 bp,RBBP8上游 5′TGTGGAAGCCCTAACTCTGC 3′下游 5′ATCGGTGAATCTGGAATAACGT 3′473 bp,GAPDH上游 5′-GAAGATGGTGATGGGATTTC-3′下游 5′-CAAGTTCTACAATCAAGTGC-3′225 bp。
1.5.2 反应体系及条件 各基因分管扩增,反应体系均为25.5μl,其中 cDNA模板 1.0μl、10×buffer(Mg2+20 mM)2.5 μl、 dNTPs(2.5mM)1μl、Taq酶 0.2μl(2 u)、 各基因上下游引物 (10 pmol/μl)各 1μl、 无 RNA酶的水 18.3μl、Sabgreen I 0.5μl。在DNA EngineOpticonTM 2连续荧光检测系统 (美国 Bio-rad公司)中进行扩增反应。反应条件为:94℃变性 3min,94℃30 s,60℃30 s,72℃3 min,72℃10 min重复 40个循环,4℃保存。阴性对照以无 RNA酶的水代替 cDNA模板,每例样品及对照均设 3个平行复孔,取平均值。反应结束后,由软件自动得出荧光反应曲线以及每个标本反应体系的扩增效率 (efficiency)及 CT值。
1.6 结果计算 SKOV3-CB相对于 SKOV3表达计算公式:XN,q/XN,cb=[ER,qCT,R,q/EqCT,q]÷[ER,cbCT,R,cb/EcbCT,cb]。ER,q为反应体系模板为 SKOV3-CB内参基因 GAPDH的扩增效率CT、R、q为反应体系模板为 SKOV3-CB内参基因 GAPDH的 CT值;Eq为反应体系模板为 SKOV3-CB目的基因的扩增效率,CT、q为反应体系模板为 SKOV3-CB的目的基因 CT值;ER,cb为反应体系模板为 SKOV3内参基因 GAPDH的扩增效率,CT、R、cb为反应体系模板为 SKOV3内参基因的 CT值,Ecb为反应体系模板为SKOV3目的基因的扩增效率,CT、cb为反应体系模板为 SKOV3目的基因的 CT值。
1.7 统计学方法 以原卵巢癌卡铂耐药基因表达谱芯片检测所筛查的肿瘤抑制基因表达下调结果与 RT-PCR验证下调结果的符合率作为分析的指标。
2 结果
2.1 总 RNA提取及反转录 耐药细胞及敏感细胞株 OD260/280值为 1.8~2.0,电泳可见清析 28S、18S,5S条带 (见图1)。以 GAPDH引物对提取的 RNA进行 PCR,电泳可见清析的条带 (见图 2)。
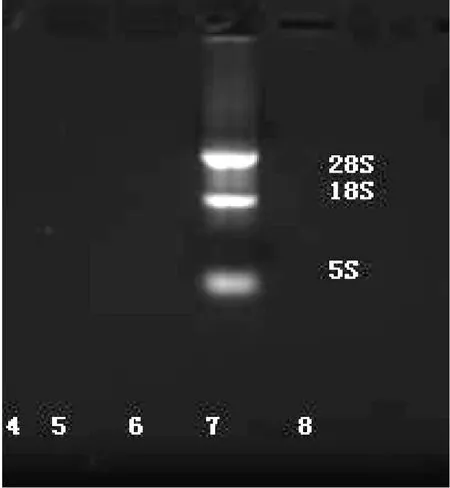
图 1 总 RNA电泳分析Figure 1 Electrophoresis analysis of total RNA
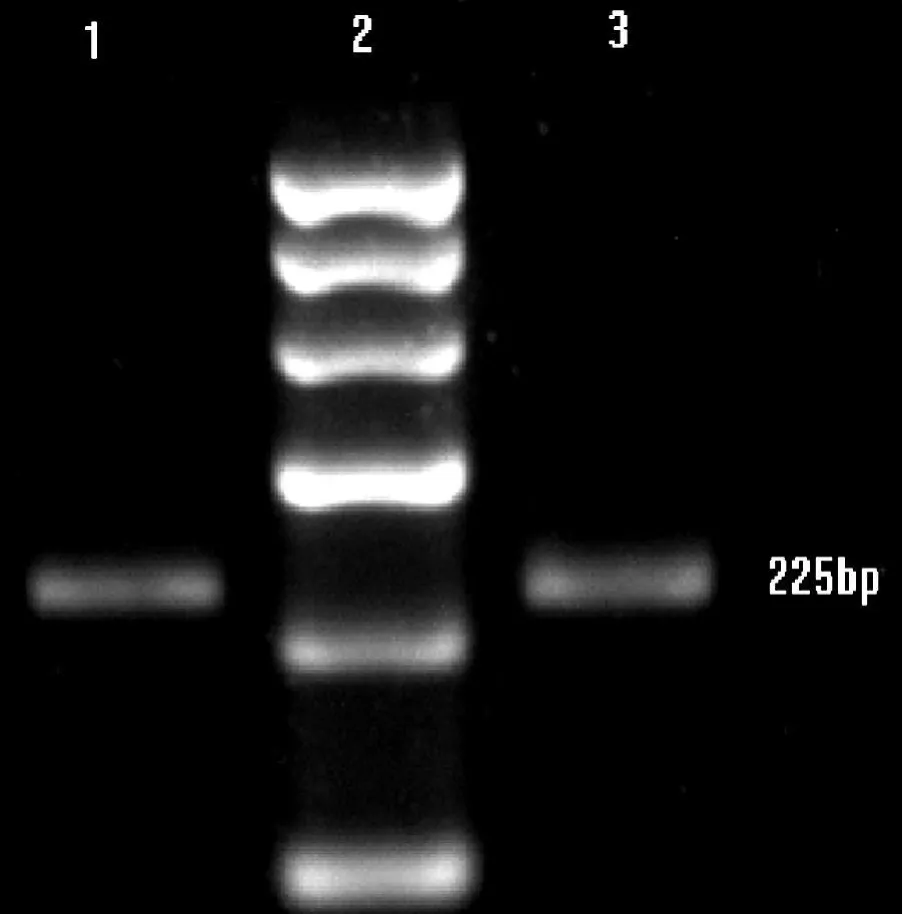
图 2 提取的 RNA PCR结果Figure 2 PCR result of extracted totalRNA
2.2 Real-time PCR 反应结束后,计算机内分析软件 Monitor opticon自动分析目的基因与 GAPDH的实时荧光曲线。其熔解曲线显示,各反应体系均出现单一的熔解峰,具有特异性。荧光 PCR仪器自动显示各反应体系扩增效率及 CT值 (见图 3,图 4)。
图 3 扩增效率以百分比显示Figu re 3 Amplification efficiency with percentage
图 4 扩增效率不以百分比显示Figu re 4 Amplification efficiency without percentage
2.3 real-time PCR验证 17个肿瘤抑制基因表达的结果RNASET2,VHL,DLG1,COPS2,NOL7,RBL1,S100A2,PARG1,PERP,TCF3,DNAJA3,ING1,CYLD,RARRES3,RBBP8基因差异表达下调,下调倍数分别为 24.47、65.24、10.81、21.30、 72.94、 5.95、 27.13、 1.57、 1.32、 12.93、46.80、7.57、 14.90、 14.00、 23.98。 GGNBP2,PCGF2,DLG1等基因差异表达上调,上调倍数分别为 5.76、2.19和17.10,基因芯片差异表达结果与 real-time PCR所验证表达下降趋势的结果符合率为 82.35%,下调两倍以上的基因符合率为 64.70%(见表 1)。
3 讨论
卵巢癌的治疗原则是以手术为主,同时辅以铂类为基础的联合化疗的综合治疗。提高疗效的同时,卵巢癌细胞获得性耐药成为临床治疗的主要障碍。探索耐药机制就成为解决耐药、改善化疗效果的关键。既往研究认为 MDR1、MRP、LRP、GST等基因的高表达及 TopoⅡ活性的改变是导致卵巢癌细胞产生多药耐药的主要相关原因,但最近研究表明卵巢癌耐药机制涉及癌基因、DNA合成与修复、细胞信号和传递蛋白、蛋白翻译合成类以及细胞骨架和运动、离子通道和运输蛋白、代谢、发育相关等多种基因[4]。因而由研究单一基因进入到多基因协同作用研究阶段成为一种趋势,同时也说明肿瘤细胞对化疗药物的易患性并非由单因素的标志物所决定,单个机制的途径不能解释肿瘤耐药的发生[5]。所以目前普遍认为,肿瘤细胞对化疗耐药是一个多基因、多因素和多步骤的复杂过程,它们之间存在相互依赖又相互制约的调节关系。
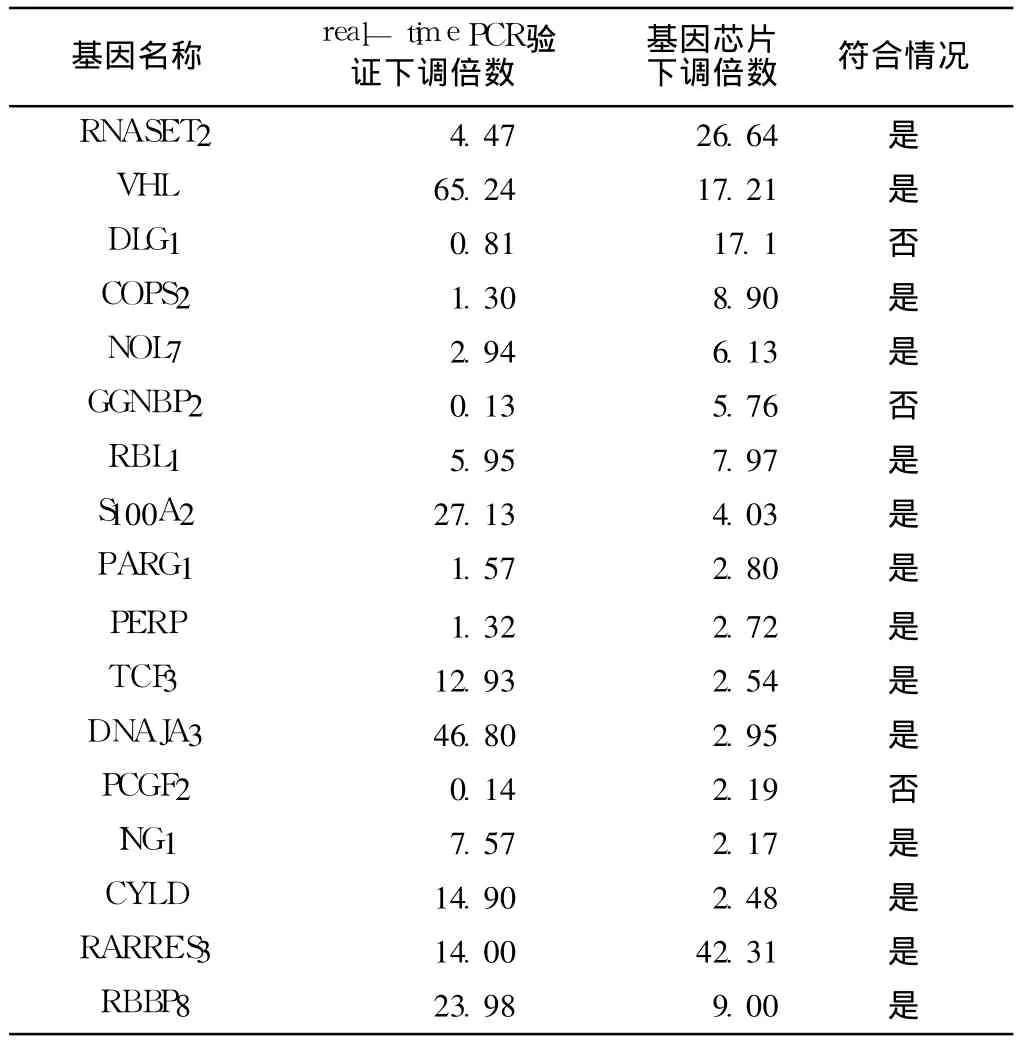
表 1 卵巢癌 SKOV 3-KB细胞系同 SKOV 3细胞系相比较各基因表达下调倍数及下调趋势符合情况Table 1 Folds and accordance trend of expression downregulation of SKOV 3-CB cell line compared with SKOV 3 cell line
肿瘤抑制基因在控制细胞生长、增殖及分化、凋亡过程中起着十分重要的负调节作用,在肿瘤的耐药机制研究中越来越受到重视。研究发现此类基因在卵巢癌的化疗耐药中发挥着重要的作用[6-7]。
基因芯片具有高通量特点,能够在一次试验中从基因组水平对成千上万种基因的表达进行快速和高效的检测,因而已成为研究多种基因参与耐药机制的一种有效手段。但芯片数据存在一定系统误差,只能作为一种粗略定量分析手段,不能精确定量[8],因而基因表达谱芯片检查结果不可避免地存在假阳性。目前的观点认为对于基因芯片检查的结果需要应用定量PCR或其他技术方法验证[9],以保证结果的可靠。基因表达谱芯片验证方法有多种,不同验证方法结果差异较大,传统的RT-PCR验证由于缺乏对转录水平准确的定量灵敏度和重复性,相对而言,real-time PCR是一种更为精确的能够对转录水平精确定量的验证,从而与基因芯片检查结果更可能的一致[10]。本实验采用 real-time PCR技术对原有卵巢癌卡铂耐药基因表达谱芯片进行验证。筛查的 17个肿瘤抑制基因中,原基因芯片中 14个肿瘤抑制基因检测结果与验证的差异表达结果下调趋势一致,符合率 82.35%,假阳性率为 17.65%。其中差异表达下调两倍以上的 RNASET2,VHL,NOL7,S100A2,TCF3,DNAJA3,ING1,CYLD,RARRES3,RBBP8 10个基因,符合率 64.70%。因而,本研究结果肯定了卵巢癌卡铂耐药表达谱基因芯片的价值,同时也说明了对基因芯片检测的结果验证的必要性以及进一步提高基因芯片检出结果的准确性内在要求。
在肿瘤抑制基因与耐药的研究中发现,肿瘤抑制基因启动子 CpG岛高甲基化而导致基因沉默与卵巢癌的耐药有关[1-2]。因而本实验所验证的肿瘤抑制基因,为后续探讨其可能的表观遗传学机制的实验提供了可靠的数据。实验表明利用基因芯片技术分析基因差异表达是一种有效的方法,多肿瘤抑制基因可能以不同的作用方式导致卵巢癌卡铂耐药的形成。
1 Watanabe Y,Ueda H,Etoh T,et al.A change in promotermethylation of hMLH 1 isa cause of acquired resistance to platinum-based chemotherapy in epithelial ovarian cancer[J].Anticancer Res,2007,27(3B):1449-1452.
2 Staub J,Chien J,Pan Y,etal.Epigenetic silencing of HSulf-1 in ovarian cancer:implications in chemoresistance[J].Oncogene,2007,26(34):4926-4978.
3 栾英姿,李力,黎丹戎,等.五种卵巢癌耐药细胞系的建立及其部分耐药相关基因的表达 [J].中华妇产科杂志,2004,39(6):403-407.
4 张文晶,李红霞,宋磊,等.应用基因芯片技术筛选卵巢癌紫杉醇耐药差异表达基因 [J].肿瘤防治研究,2006,33(1):32-35.
5 Vase PA.Resistance to chemotherapy in advanced ovarian cancer:mechanisms and current strategies[J].Br JCancer,2003,89(Suppl3):S23.
6 Zhou C,Smith JL,Liu J.RoleofBRCA 1 in cellular resistance to paclitaxel and ionizing radiation in an ovarian cancer cell line carrying a defective BRCA 1[J].Oncogene,2003,22(16):2396-2404.
7 Metzinger DS,Taylor DD,Gercel-Taylor C,et al.Induction of p53 and drug resistance following treatment with cisplatin or paclitaxel in ovarian cancer cell lines[J].Cancer Lett,2006,236(2):302-328.
8 罗瑶,许宏,李瑶,等 .表达谱基因芯片的可靠性验证分析 [J].遗传学报,2003,30(7):611-618.
9 Hembruff SL,Villeneuve DJ,Parissenti AM,etal.The optimization of quantitative reverse transcription PCR for verification of cDNAm icroarray data[J].Anal Biochem,2005,345(2):237-249.
10 Chaib H,CockrellEK,Rubin MA,et al.Profiling and verification of gene expression patterns in normalandmalignanthuman prostate tissues by cdna microarray analysis[J].Neoplasia,2001,3(1):43-52.
