吡格列酮对老年冠心病合并胰岛素抵抗患者血浆纤溶酶原激活物抑制物 1及短期预后的影响
胡硕强,曹树军,俞小薇,李 宁
老年冠心病患者常合并胰岛素抵抗 (IR)和纤溶活性降低,基础和临床研究表明胰岛素抵抗和纤溶酶原激活物抑制物1(PAI-1)水平升高是动脉粥样硬化和冠心病的独立危险因素,并能增加主要心脏不良事件 (major adverse cardiac events,MACE)发生率[1-2]。噻唑烷二酮类药物 (TZD)是临床常用的胰岛素增敏剂,TZD对心血管有无保护作用目前仍存在争议[3],本研究通过观察吡格列酮对老年冠心病合并胰岛素抵抗患者血浆 PAI-1水平及对近期预后的影响,为指导临床早期应用 TZD控制心血管危险因素提供依据。
1 对象与方法
1.1 研究对象 选择 2007年 8月—2008年 12月在我院门诊治疗或住院治疗的老年冠心病伴胰岛素抵抗患者 76例,其中男 50例,女 26例,年龄 61~84岁,平均 (71.5±10.2)岁。冠心病诊断依据典型临床表现或影像学检查 [包括冠脉造影和冠脉 CT血管造影 (CTA)],其中稳定性心绞痛 19例,急性冠脉综合征包括不稳定性心绞痛和急性心肌梗死 57例,患者均行口服葡萄糖耐量试验 (OGTT试验)且胰岛素抵抗指数(HOMA-IR)>2.8。排除左室射血分数 (LVEF)<40%、糖尿病、急慢性感染、恶性肿瘤、血液系统疾病及肝、肾功能有明显异常者。
1.2 方法 将76例患者按随机数字表法分为吡格列酮组 (n=38)和对照组 (n=38),对照组给予基础治疗,吡格列酮组接受吡格列酮 (瑞彤,15 mg/d)+基础治疗。两组基础治疗相同,给予肠溶阿司匹林、血管紧张素转化酶抑制剂(ACEI)类、β-受体阻滞剂、氯吡格雷、他汀类、硝酸酯类药物和 PCI治疗等。两组均随访6个月,分别在治疗前后检测血浆 PAI-1活性、HOMA-IR,并记录主要 MACE。PAI-1采用酶联免疫吸附法 (ELISA)测定,血清空腹胰岛素(FINS)采用放射免疫法测定。HOMA-IR:采用 HOMA(homeostasismodelassessment)模型计算 (即 HOMA-IR=FIN×FPG/22.5),HOMA-IR≥2.8者为抵抗 (模型按上海 2 217人的统计方法结果,引自台湾陈燕如 《胰岛素敏感性及抗性之测定法》)。空腹血糖 (FPG)、总胆固醇 (TC)、三酰甘油(TG)、高密度脂蛋白胆固醇 (HDL-C)、低密度脂蛋白胆固醇 (LDL-C)采用全自动生化分析仪测定,餐后 2 h血糖(2 hPG)测定采用葡萄糖氧化酶法。用药期间用监测肝肾功和心肌酶等。
1.3 统计学方法 采用 SPSS 13.0统计软件包进行统计分析。计量资料各指标若服从正态分布,用(x—±s)表示,非正态分布者取自然对数转化为正态分布,组间比较采用 t检验,组内比较用配对 t检验。计数资料以率表示,采用 χ2检验。相关分析采用 Pearson直线相关分析。以 P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线临床资料比较 两组在年龄、性别构成、体质指数 (BMI)、冠心病类型、血压、血糖、血脂、HOMA-IR、LVEF等方面比较,差异无统计学意义 (P>0.05,见表 1),具有可比性。
2.2 两组患者治疗前后血脂、血糖、空腹胰岛素、HOMAIR、PAI-1的比较 与治疗前相比,两组患者治疗后 TC、LDL-C均明显降低,差异有统计学意义 (P<0.05),但治疗后两组间 TC、LDL-C比较,差异无统计学意义 (P>0.05)。与治疗前及对照组治疗后比较,吡格列酮组治疗后 TG、2 hPG、FINS、HOMA-IR、PAI-1水平均显著降低,HDLC水平显著升高,差异有统计学意义 (P<0.05,见表 2)。直线相关分析显示,PAI-1下降幅度与 HOMA-IR、FINS下降幅度呈正相关 (r值分别为 0.59和 0.51,P值分别为 0.03和0.04)。
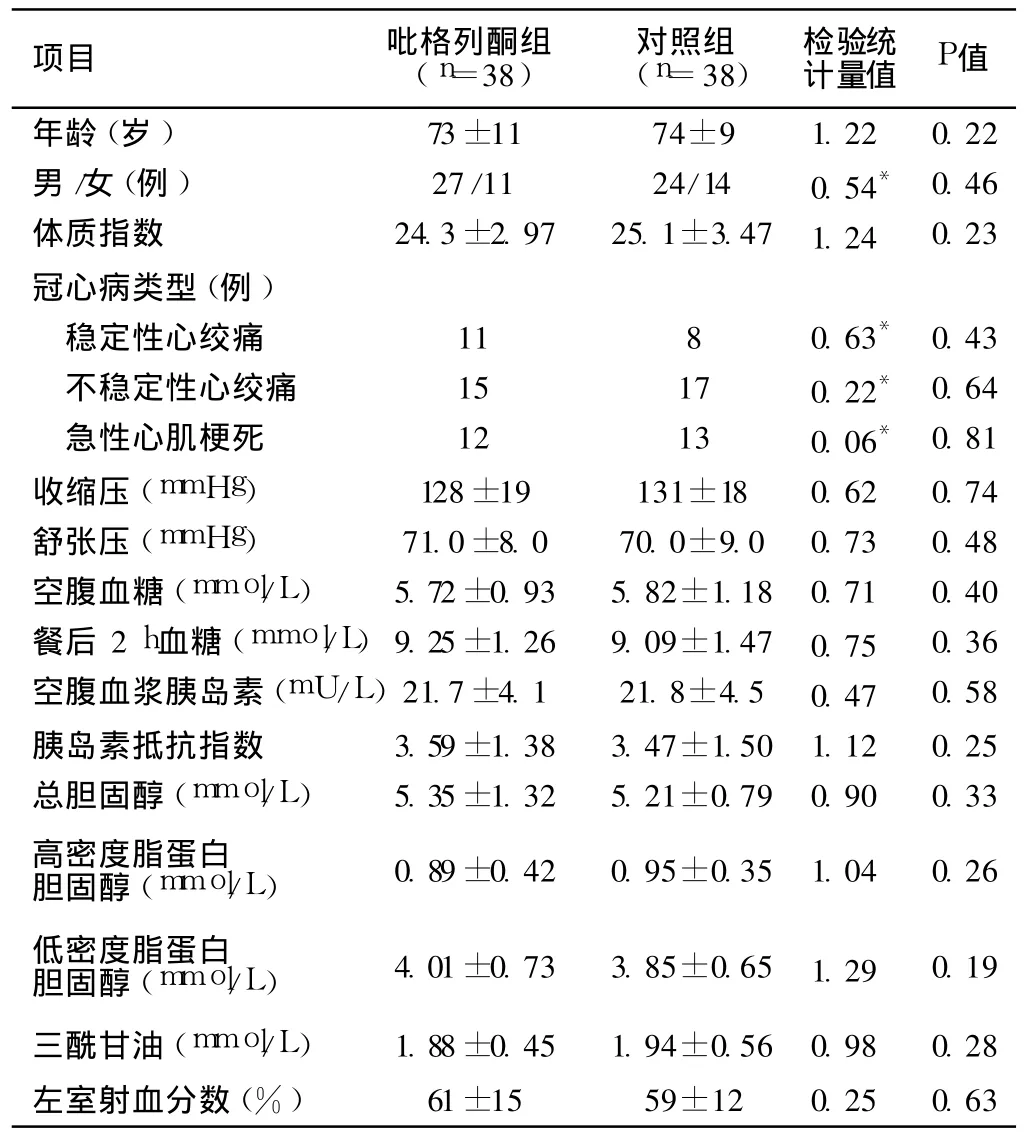
表 1 两组基线临床资料的比较Table 1 Comparison of baseline clinical data between two groups
2.3 两组患者随访 6个月内 MACE发生情况比较 两组患者均门诊定期随访及电话随访 6个月,记录患者一般情况和MACE事件,包括不稳定心绞痛、再次心肌梗死、再次血运重建、死亡等。吡格列酮组 MACE发生率明显降低,差异有统计学意义 (P<0.05,见表 3)。

表2 两组患者治疗前后血脂、血糖、FINS、HOMA-IR及PAI-1比较(x—±s)Table 2 Comparison of TG,TC,LDL-C,HDL-C,FPG,2hPG,FINS,HOMA-IR,PAI-1 between two groups
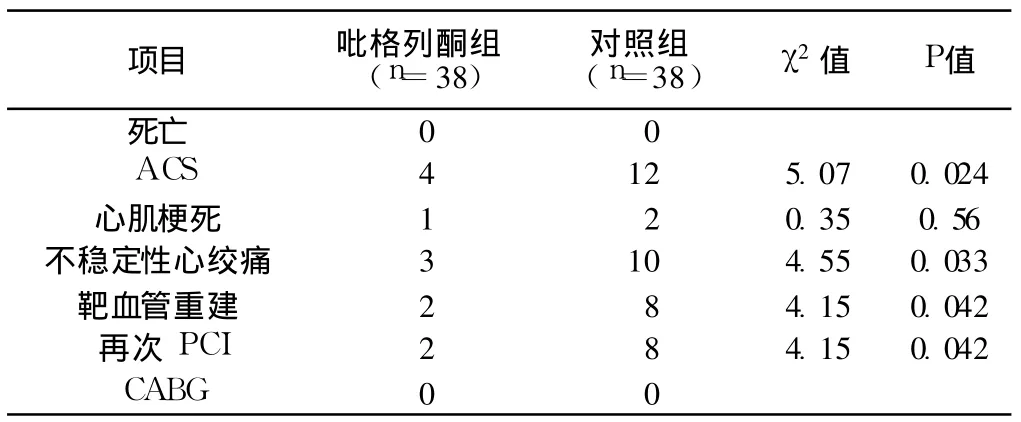
表 3 两组患者主要心脏不良事件 (MACE)发生情况比较 (例)Table 3 Comparison of MACE between two groups
2.4 不良反应 吡格列酮组随访期间有 3例头痛,4例转氨酶轻度升高,5例轻度水肿,经对症处理后能坚持服药。
3 讨论
TZD类药物是临床常用的胰岛素增敏剂,其作用主要是通过激活过氧化物酶增殖体激活物受体 γ(PPAR-γ)提高细胞对胰岛素作用的敏感性。目前大量临床试验已证明 TZD类药物可改变糖尿病患者的 IR状态,降低 TG水平,升高 HDL-C水平[4-7]。本研究也发现吡格列酮组治疗 6个月后 2 hPG、FINS、HOMA-IR均显著下降,同时 TG水平显著降低,HDL-C水平显著升高,其机制可能是吡格列酮激活脂肪细胞PPAR-γ受体,减少参与游离脂肪酸转化和氧化的基因表达,影响脂肪细胞内的游离脂肪酸代谢,降低脂肪组织的脂肪分解[8]。
PAI-1是血浆纤溶系统的主要抑制物,是重要的心血管病危险因素,在冠心病伴高胰岛素血症患者动脉粥样硬化的发生发展中起着重要的作用[9],PAI-1水平表达增加也是支架植入术后发生严重心血管事件的独立危险因素[10]。PAI-1可与纤溶酶原激活物 (t-PA)和尿激酶结合,抑制纤溶活性。在血管腔表面存在着 t-PA和 PAI-1的动态平衡,这种平衡破坏导致血管局部纤溶蛋白分解的活性降低,使纤溶蛋白易于沉积,微血栓不断形成、集聚形成血栓;PAI-1持续升高,使机体处于低纤溶状态,导致纤溶蛋白网架形成,使成纤维细胞在其上聚集、增殖,释放间质胶原,加速纤维化进程,促进动脉粥样硬化的发生。实验证明胰岛素可通过 mRNA的诱导作用增加肝细胞合成及分泌 PAI-1,血浆 INS与 PAI-1活性、游离及总 PAI-1含量呈显著正相关[11];多项研究也报道PAI-1水平与 IR、代谢综合征、空腹胰岛素水平、血脂、BMI和血压等具有相关性[11-14]。本研究发现,与治疗前及对照组治疗后比较,吡格列酮治疗 6个月后能显著降低老年冠心病伴胰岛素抵抗患者的 PAI-1水平,PAI-1下降幅度与 HOMA-IR、FINS下降幅度呈正相关。这表明吡格列酮可能通过改善胰岛素抵抗以及由其引起的高胰岛素血症来降低 PAI-1水平,同时也提示 PAI-1水平增高是胰岛素抵抗增加心血管风险的中间环节之一。
此外,本研究通过为期 6个月的随访发现,吡格列酮组MACE发生率显著低于对照组,提示吡格列酮能改善老年冠心病伴 IR患者的短期预后,其机制可能与吡格列酮改善胰岛素抵抗、降低 PAI-1活性有关。虽然 Nissen等[15]发表的 Meta研究称罗格列酮会大幅度提高患者心血管方面原因导致心肌梗死的发生率和病死率,但 RECORD研究中期分析显示罗格列酮、格列本脲和二甲双胍 3组心血管事件的发生率无明显差异。目前缺乏针对吡格列酮心血管效益/风险特定目的的前瞻性临床试验,最终确定吡格列酮、罗格列酮的心血管的安全性仍需要大规模的前瞻性临床研究。
总之,在老年冠心病合并胰岛素抵抗患者中应用吡格列酮不仅能够显著改善胰岛素抵抗和糖脂代谢紊乱,还能显著降低PAI-1水平和改善此类患者的短期预后,提示其具有心血管保护作用。
1 Zhao LP,Lü AK,Shen WF,et al.Influence of insulin resistance on long-term outcomes in patients[J].Chinese Medical Journal,2010,123(6):651-657.
2 Ha H,Oh EY,Lee HB.The role of plasm inogen activator inhibitor 1 in renal and cardiovascular diseases[J].Nephrology,2009,5(4):203-211.
3 Quinn CE,Hamilton PK,LockhartCJ,etal.Thiazolidinediones:effectson insulin resistance and the cardiovascular system[J].British Journal of Pharmacology,2008,153(4):636-645.
4 杨娜,丁世芳.噻唑烷二酮类药物干预动脉粥样硬化的研究进展[J].中国动脉硬化杂志,2009,17(9):783-786.
5 职冬悦,邵晋康 .甘精胰岛素联合吡格列酮治疗对初发及药物继发失效 2型糖尿病患者胰岛功能及糖耐量转归的影响 [J].河北医药,2008,30(11):1676.
6 殷松楼,周冬梅,奚珏,等 .吡格列酮对 2型糖尿病患者氧化应激的影响 [J].中国全科医学,2010,13(3):888.
7 肖云玲,高海青,刘向群,等 .罗格列酮对老年单纯高甘油三酯血症患者的胰岛素抵抗作用 [J].中国老年学杂志,2007,27(7):686-687.
8 Brun RP.Differential activation of adipogentsis by multiple PPAR isoforms[J].Genes Dev,1994,10:974-984.
9 Olexa P,Olexova M.Plasm inogen activator inhibitor-1(PAI-1),ischemic heart disease and diabetes mellitus[J].Vnitr Lek,2003,49(3):222-226.
10 Marcucci R,Brogi D,Sofi F,et al.PA I-1 and homocysteine,but not lipoprotein(a)and thrombophilic polymorphisms,are independently associated with the occurrence ofmajor adverse cardiac eventsafter successful coronary stenting[J].Heart,2006,92(3):377-381.
11 赵红梅,吴铿 .吡格列酮在抗动脉粥样硬化中的作用 [J].中国全科医学,2010,13(2):553.
12 梁伟,焦洁茹.老年冠心病患者血浆纤溶活性与胰岛素抵抗的关系 [J].临床心血管病杂志,2002,6(18):278-279.
13 Alessi MC,Juhan-Vague I.PAI-1 and the metabolic syndrome:links,causes,and consequences[J].Arterioscler Thromb Vasc Biol,2006,26(10):2200-2207.
14 Mertens I,Verrijken A,Michiels JJ,et al.Among inflammation and coagulation markers,PAI-1 isa true componentof themetabolic syndrome[J].Int JObes,2006,30(8):1308-1314.
15 Nissen SE,Wolski K.Effect of rosiglitazone on the risk ofmyocardial infarction and death from cardiovascular causes[J].N Engl Med,2007,356(24):2457-2471.

