针药结合对急性局灶性脑缺血-再灌注大鼠脑组织自由基代谢的影响
徐 晶 ,张 蓓 ,张青川 ,辛随成
(1.河北医科大学中医学院,河北 石家庄 050091; 2.北京市针灸医院,北京 100700;3.北京王府中西医结合医院,北京 102209; 4.北京中医药大学针灸学院,北京 100029)
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级健康成年SD大鼠120只,雄性,体重280 g~320 g,由北京维通利华实验动物技术有限责任公司提供。许可证号:SCXK(京)2002-0003。
1.1.2 试剂与仪器 SOD试剂盒、MDA试剂盒、NO试剂盒(尚柏生物医学技术有限公司);华佗牌SDZ-Ⅱ型电针仪(苏州医疗用品厂有限公司);华佗牌28号×1.0寸无菌毫针 (苏州医疗器械厂有限公司);MDF-U50V超低温冰箱 (日本);ZH-DSQ型大鼠灌胃器(河南原阳振华教学仪器厂);ZK-380低温冷冻离心机(德国);ER-182A上皿电子天平(日本)。
1.1.3 实验药物 由黄芪、赤芍、川芎、当归、地龙、桃仁、红花按照补阳还五汤原方的配伍比例配制,煎煮3次,药液混合浓缩至1 mL,相当于2 g生药。
1.2 实验方法
1.2.1 分组 常规饲养5 d,禁食12 h后开始实验[1-2]。120只SD大鼠,采用完全随机设计的方法,分为两大组,作为两不同时间点的研究对象,再分别将两组随机分为4小组,即假手术对照组(手术过程同模型组,不做线栓阻断大脑中动脉和抓取)、模型组(线栓阻断大脑中动脉后再灌+抓取)、头针组(线栓阻断大脑中动脉后再灌+电针“百会”透“曲鬓”)和针药组(线栓阻断大脑中动脉后再灌+补阳还五汤灌胃+电针“百会”透“曲鬓”),每组 15 只。
1.2.2 模型制备 参照Zea Longa E L等[3]建立的方法并改进,由颈外动脉插入栓子。应用10%水合氯醛腹腔注射麻醉大鼠后,仰卧位固定,碘伏消毒局部。颈部正中切口,逐层分离皮层、肌层、气管,以暴露左侧颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)和翼腭动脉(PPA),向离心端分离出 ICA、ECA,在ECA发出1 cm处结扎并剪断,然后分离ICA、ECA间的细小交通支,结扎游离。用动脉夹夹闭CCA、ICA和PPA后,在ECA残端剪一约0.2 mm的切口,将ECA残端拉直到与ICA成直线的角度,从切口处插预先制备的倒锥形头端栓线进入到ICA中,避开PPA,继续直至颅底入颅,遇微阻力时停止,即到达大脑前动脉(ACA)近端,从而阻断了MCA的起始部,栓线的插入深度约18 mm~25 mm,ECA切口外保留2 cm长的线端。松开动脉夹,逐层缝合切口,并用碘伏消毒缝合处。于缺血2 h后拔出线栓2 cm,建立脑缺血-再灌注模型[4~6]。
1.2.3 神经症状行为学评估 大鼠在造模手术清醒后(2 h 内)即依据 Zea Longa E L 等[3]确定的 5 级评分方法进行神经功能评分:0分:正常活动;1分:不能充分伸展右前肢;2分:向右侧转圈;3分:向右侧倾倒;4分:不能自发行走,意识障碍。将模型成功(2~3分)的大鼠用于实验。
1.2.4 处理方法 造模成功后,于缺血2 h再灌注后1 h(动物均已清醒)及缺血2 h再灌注后13 h给予治疗。针药组先灌胃后针刺。针刺方法:将大鼠固定在实验架上,先取大鼠头顶部相当于人体百会穴区(位于顶骨正中[7]),常规消毒后,以 28号 1.0寸毫针快速刺入皮下。然后沿皮向左前下方(相当于人体曲鬓穴处)平刺,进针深度约1 cm,将针柄连接至电针仪的一电极上,另一电极接上生理盐水浸湿的纱布夹于大鼠的左耳上,强度2 mA、频率为2/10 Hz的疏密波,留针20 min。使用灌胃器按1.2 mL/kg剂量进行药物灌胃治疗。假手术组、模型组不予治疗,只做抓取1次。
1.2.5 取材与指标检测 两大组动物分别于缺血2 h再灌注后12 h(I2 h/R12 h组)、缺血2 h再灌注后1 d(I2 h/R1 d组)时迅速断头开颅取脑,在大脑中动脉梗死区脑组织取材[8],并在冰盘上用4℃生理盐水冲洗,滤纸吸去水分。将所取脑组织匀浆,以pH 8.0的PBS缓冲液制成10%的匀浆液,以10000 r/min离心20 min后,取上清液。脑组织SOD活力测定用黄嘌呤氧化酶法,脑组织MDA含量测定用硫代巴比妥酸(TBA)法,脑组织NO含量测定用硝酸还原酶法。采用SAS统计软件包进行统计,所有数据采用平均数±标准差表示,以单因素方差分析判定各组组间差异(P<0.05)。
2 结 果
2.1 局灶性脑缺血再灌注模型(MCAO)大鼠行为学改变
在MCAO术清醒(约1 h)后,2 h内观察模型动物神经功能缺失症状,所有纳入实验的动物均出现:①静止时不能充分伸展右前爪,行走时向右侧转圈或倾倒;②动物爬板实验时,总是落向右侧;③提尾实验时,右前肢内收,头弯向右上;④出现霍纳氏征(瞳孔缩小)。神经功能评分均在2~3分。
2.2 SOD活性测定
I2 h/R12 h模型组、头针组和针药组大鼠的脑组织SOD活性与假手术对照组比较,均明显减低 (P<0.05,P<0.01),且头针组和针药组数值明显高于模型组(P<0.05),但头针组与针药组差异不明显。I2 h/R1 d模型组、头针组和针药组数值仍明显低于假手术对照组(P<0.05,P<0.01),同时前两者之间比较差异有统计学意义(P<0.01),但头针组与针药组比较差异无统计学意义。结果见表1。
表1 各组大鼠缺血脑组织SOD活性值 (±sd)
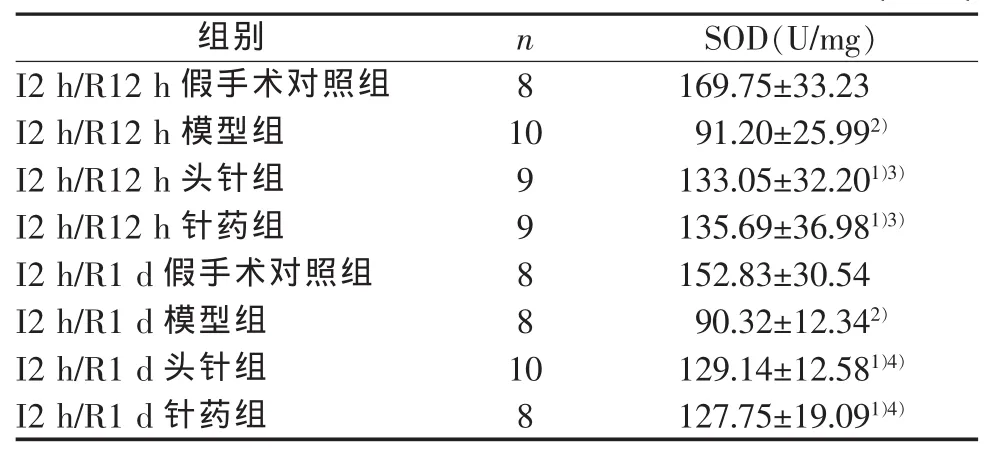
表1 各组大鼠缺血脑组织SOD活性值 (±sd)
注 : 与 同时 间 点 取 材 的 假 手 术 对 照 组 比 较 ,1)P<0.05,2)P<0.01;与同时间点取材的模型组比较,3)P<0.05,4)P<0.01
组别 n S O D(U/m g)I 2 h/R 12 h假手术对照组 8 169.75±33.23 I 2 h/R 12 h 模型组 10 91.20±25.99 2)I 2 h/R 12 h 头针组 9 133.05±32.20 1)3)I 2 h/R 12 h 针药组 9 135.69±36.98 1)3)I 2 h/R 1 d假手术对照组 8 152.83±30.54 I 2 h/R 1 d 模型组 8 90.32±12.34 2)I 2 h/R 1 d 头针组 10 129.14±12.58 1)4)I 2 h/R 1 d 针药组 8 127.75±19.09 1)4)
2.3 MDA含量测定
I2 h/R12 h模型组较假手术对照组脑组织MDA含量明显升高(P<0.05),但头针组、针药组与模型组和假手术对照组比较差异无统计学意义。I2 h/R1 d假手术对照组与模型组、头针组数值均存在显著差异(P<0.01),头针组较针药组MDA含量高(P<0.05)。同时,针药组与假手术对照组大鼠的脑组织MDA含量比较差异无统计学意义。结果见表2。
表2 各组大鼠缺血脑组织MDA含量 (±sd)

表2 各组大鼠缺血脑组织MDA含量 (±sd)
注 : 与 同时 间 点 取 材 的 假 手 术 对 照 组 比 较 ,1)P<0.05,2)P<0.01;与同时间点取材的模型组比较,3)P<0.01
组别 n M D A(n m o l/m g)I 2 h/R 12 h假手术对照组 8 3.88±1.75 I 2 h/R 12 h 模型组 10 6.15±1.96 1)I 2 h/R 12 h头针组 9 5.18±1.70 I 2 h/R 12 h针药组 9 4.32±1.28 I 2 h/R 1 d假手术对照组 8 3.56±0.72 I 2 h/R 1 d 模型组 8 6.20±0.59 2)I 2 h/R 1 d 头针组 10 5.17±0.98 2)3)I 2 h/R 1 d 针药组 8 4.29±0.56 3)
2.4 NO含量测定
I2 h/R12 h模型组较假手术对照组NO含量明显升高(P<0.05),但头针组、针药组与模型组与假手术组比较差异无统计学意义。I2 h/R1 d模型组较假手术对照组数值明显升高(P<0.01)。头针组、针药组与模型组大鼠脑组织NO含量比较差异有统计学意义(P<0.05)。 结果见表 3。
表3 各组大鼠缺血脑组织NO含量 (±sd)
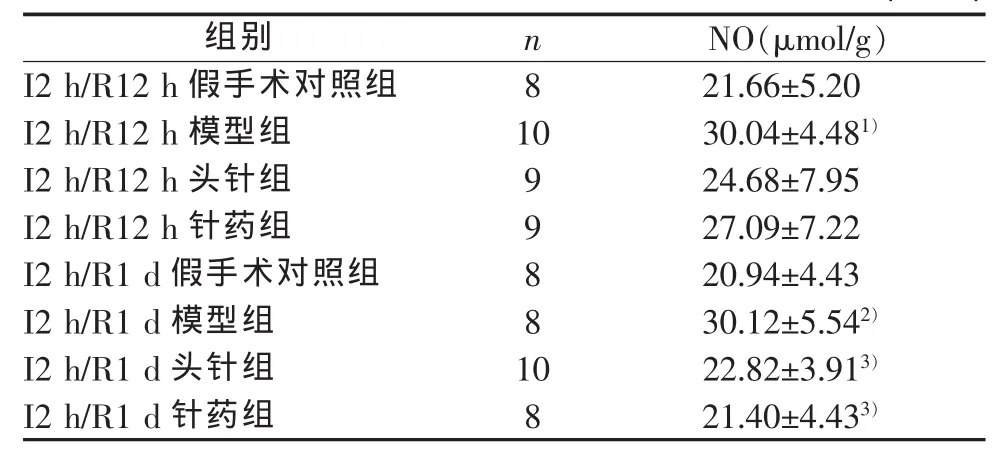
表3 各组大鼠缺血脑组织NO含量 (±sd)
注 : 与 同 时 间 点 取 材 的 假 手 术 对 照 组 比 较 ,1)P<0.05,2)P<0.01;与同时间点取材的模型组比较,3)P<0.01
组别 n N O(μ m o l/g)I 2 h/R 12 h假手术对照组 8 21.66±5.20 I 2 h/R 12 h 模型组 10 30.04±4.48 1)I 2 h/R 12 h头针组 9 24.68±7.95 I 2 h/R 12 h针药组 9 27.09±7.22 I 2 h/R 1 d假手术对照组 8 20.94±4.43 I 2 h/R 1 d 模型组 8 30.12±5.54 2)I 2 h/R 1 d 头针组 10 22.82±3.91 3)I 2 h/R 1 d 针药组 8 21.40±4.43 3)
3 讨 论
祖国医学对于中风的记载,源于《内经》,相关病名如大厥、薄厥、煎厥、偏枯、仆击、痱风等。随着后代医家对中风认识的不断加深,尤其在病因病机方面阐释颇多,归结起来不外乎虚(阴虚、气虚)、火(心火、肝火)、风(肝风、外风)、痰(风痰、湿痰)、气(气逆)、血(血瘀),病因病机概括为病因积累、正衰积损,外加诸邪丛生、气血逆乱,脑脉痹阻或血溢脑脉之外。《内经》首先提出中风病变部位在头,“百会”居头之巅,是督脉之要穴,为手足三阳、督脉及足厥阴之会,统领一身之阳,内系于脑;“曲鬓”为足太阳、少阳之会,三条阳经从头至足,纵贯全身,具有统领一身阳气的功能。以上两穴位合用,贯穿多条经脉,起到了一经带多经,一穴带多穴的整合作用,起通调督脉、醒脑开窍、宁神定志之功。而王清任在《医林改错·论小儿抽风不是风》中说:“元气既虚,必不能达于血管,血管无气,必停留而瘀”,因此气虚血瘀是最基本的病理机制。故本实验以补阳还五汤益气活血,益气则气行以消脉中之瘀,气旺以资新血化源,故可治本;化瘀则瘀除脑通,为治标之法,标本同治可化瘀不伤正。
现代医学研究显示,人体的各组织器官在代谢过程中都会产生自由基,毒性很强,可以攻击细胞的脂类、蛋白质、核酸等。在抗氧化系统正常的生理情况下,自由基的产生与清除之间处于动态平衡。急性脑血管病发生后,无论是缺血性或是出血性损伤均可引起自由基生成增加,通过一系列复杂的级联反应诱导细胞死亡。同时,自由基引发的线粒体膜脂质过氧化反应或细胞内形成的脂质过氧化物作用于线粒体膜,使膜的流动性及液态改变,从而导致线粒体功能障碍,加重自由基对机体的损伤。再灌注期脑组织内自由基的升高,使细胞膜磷脂中多聚不饱和脂肪酸和脂肪酸的不饱和双键更易受到攻击,引发脑血管通透性的增加、破坏血脑屏障,加重神经元损害和脑水肿[9]。有实验显示,自由基的脂质过氧化作用增强主要发生在再灌注期[10]。脑缺血后Ca2+通道过度激活[11],NO合成过量,也从多方面影响脑血管的通透性,形成脑水肿,加重脑组织的损伤[12-14]。
通过对比研究显示,在脑缺血-再灌注急性期,模型动物缺血局部脑组织中SOD活性明显升高,MDA含量显著降低,二者呈负相关,提示局部自由基代谢水平升高,脂质过氧化反应显著增强。脑缺血-再灌注急性期脑组织中NO含量明显升高,可能系Ca2+通道过度开放,受到Ca2+-CaM直接调节的NOS被大量激活,合成过量NO。单一头针或针药结合治疗均可通过提高SOD活性并下调脑组织MDA含量,减轻氧自由基介导的脂质过氧化反应,并以针药结合疗效更为显著。两治疗方案均通过抗氧自由基作用,并改善线粒体功能而改善脑组织的能量代谢,使蛋白激酶活性升高,从而使NOS磷酸化,活性降低,减少了NO的合成。头针和针药结合通过抑制自由基代谢来减轻脑缺血-再灌注损伤,是两种方案治疗缺血性脑血管病的重要途径之一,并以针药综合疗法效果更优,早期干预治疗对本病的恢复有着积极的意义,为临床治疗缺血性脑损伤提供了实验室佐证。
[1]张勇.大鼠大脑中动脉缺血再灌注动物模型制作体会[J].神经疾病与精神卫生,2006,6(3):261.
[2]Garcia J H.A reliable method to occludea middle cerebral artery in wistar rats[J].Stroke,1993,24(9):1423.
[3]Zea Longa E L,Weinstein R P,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats [J].Stroke,1989,20(1):84.
[4]王志萍,曾因明.线栓法制备大鼠局灶性脑缺血再灌注模型的研究进展[J].国外医学·麻醉学与复苏分册,2005,26(3):144.
[5]曹霞,曹秉振,郭述芬.大鼠大脑中动脉局灶性脑缺血模型的时间梗死体积相关研究[J].解放军医学杂志,2002,25(2):123.
[6]邓志宽,董为伟.电刺激小脑顶核对局灶性脑缺血“治疗时间窗”影响的实验研究[J].中华医学杂志,2003,83(13):1173.
[7]林文注,王佩.实验针灸学[M].上海:上海科学技术出版社,1994:68.
[8]任秀君.手十二井穴刺络放血法对实验性脑缺血组织一氧化氮浓度的影响[J].北京中医药大学学报,2001,24(2):51.
[9]Fukui S,Ookawara T,Nawashiro H,et al.Post-ischemic transcriptional and translational responses of EC-SOD in mouse brain and serum [J].Free Radic Biol Med,2002:32(3):289.
[10]张雄.鼠脑缺血性损伤早期海马区PAF和LPO含量的动态观察及其意义[J].卒中与神经疾病,1999,6(4):216.
[11]Michael J,O’Neill,Tracey K,et al.ARL 17477,a selective nitric oxide synthase inhibitor,with neuroprotective effects in animal models of global and focal cerebral ischemia[J].Brain Res,2000,871(4):234.
[12]张梅丽.缺血性脑血管病患者血清NO水平变化及自由基损伤[J].实用老年医学,1998,12(5):209-211.
[13]Meng W,Tobin J R,Busija D W,et al.Glutamate-induced cerebral vasodilation is mediated by nitric oxide through N-ethyl-D-as-partate receptors[J].Stroke,1995,26(5):857.
[14]Dawso V L,Dawson T M,Batley D A,et al.Mechanism of nitric oxide-mediated neurotoxity in primary brain cultures[J].J Neurosic,1993,13(6):2651.

