离子交换层析纯化重组福安泰-03功能域的工艺条件研究
苏伟明,马润娣,于立坚 (广东海洋大学海洋药物研究与开发重点实验室,广东湛江524025)
于廷曦 Cell Biology Group,Department of Surgery,Department of Pathology,University of Maryland School of Medicine and Baltimore Veterans Affairs Medical Center,Baltimore,MD 21201,USA
离子交换层析主要利用蛋白质等电点 (pI)的差异使其分离,即在一定的缓冲体系中,不同蛋白质与离子交换凝胶有不同的结合能力,而不同浓度的NaCl可以把不同结合力的蛋白质从层析柱上先后洗脱下来。由于离子交换层析具有处理量大、分辨率较高和成本低廉的特点[1],因此,该技术在众多蛋白质分离中得到广泛应用。
福安泰-03(Fuantai-03,FAT-03)功能域从赤魟组织中分离得到,分子量大约为43000Da,具有强抗血管生成活性和强抗肿瘤生长和转移作用[2~5]。将用DNA重建技术构建的、含FAT-03功能域基因的质粒整合入 BL121(DE3)大肠杆菌中,其表达的蛋白质即重组福安泰-03功能域 (recombinant functional domain of Fuantai-03,rFAT-03)。将重组福安泰-03功能域分离纯化是获得具有实用价值产品的关键步骤。下面,笔者在20℃、上样量一致、层析介质相同的条件下对离子交换层析纯化重组福安泰-03功能域功能域的工艺条件进行了研究。
1 试验部分
1.1 材料
HiTrap Desalting5×5ml(17-1408-01)脱盐预装柱、HiT rap DEAE Sepharose FF琼脂糖凝胶、XK 26/20柱均为美国GE公司产品;L-还原型谷胱甘肽 (AMRESCO公司);Tris(Genriew公司);丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、T EMED、SDS购自北京鼎国生物广州分公司,其余试剂均为国产分析纯。
1.2 仪器
AKTA explorer 100蛋白质快速纯化开拓系统 (美国GE公司);Avant J-25大容量高速冷冻离心机 (美国贝克曼公司);3K30高速冷冻离心机 (德国SIGMA公司);420A pH计 (美国奥力龙公司);Mini trans垂直电泳槽加转印系统 (美国Bio-Rad公司);FR-1000凝胶成像系统 (上海复日公司);Milli-Q RG(美国Millipore公司);2501紫外分光光度计 (日本岛津公司)。
1.3 试验方法
1)样品处理 调整原液蛋白浓度为1mg/ml,上样体积为400ml,用0.22μ m滤膜过滤,脱气10min。
2)缓冲液的配制 上样缓冲液 (0.1 mol/L Tris-HCl)的配制过程如下:称取Tris 12.11g,加去离子水500ml,搅拌溶解。用0.1mol/L HCl调pH至8.8,用去离子水定容至1000ml;洗脱缓冲液(1mol/L NaCl+0.1 mol/L T ris-HCl)的配制过程如下:称取Tris 12.11 g和NaCl 58.44 g,加去离子水500 ml,搅拌溶解。用0.1 mol/L HCl调pH至8.8,用去离子水定容至1000ml。
3)离子交换层析 采用XK26/20柱,填料为DEAE Sepharose FF琼脂糖凝胶 (50ml),在AKTA explorer 100蛋白质快速纯化开拓系统上进行。用上样缓冲液平衡5个柱床体积以上,至基线平稳。通过上样泵上样400ml,流速8ml/min。上样完毕后,用上样缓冲液洗至基线平稳,再用洗脱缓冲液采用以下3种不同洗脱条件进行洗脱:①线性梯度洗脱。即用洗脱缓冲液从0%到100%洗脱6个柱床体积,收集洗脱峰。②固定梯度和线性梯度混合洗脱。先用20%洗脱缓冲液直接洗脱3个柱床体积,再用洗脱缓冲液从20%到100%洗脱2个柱床体积,收集洗脱峰。③不同阶段线性梯度洗脱。先用洗脱缓冲液从30%到60%洗脱3个柱床体积,再用洗脱缓冲液从60%到100%洗脱2个柱床体积,收集洗脱峰。
4)脱盐 采用HiTrap脱盐柱进行脱盐,上样1ml,流速5ml/min,收集样品。
5)总蛋白量测定 采用Lowry法[6],以牛血清白蛋白为基准。
6)SDS-PAGE电泳 利用SDS-聚丙烯酰胺电泳[7]测定粗品和层析分离后样品的纯度,分离胶为10%聚丙烯酰胺凝胶,考马斯亮蓝染色。用 FR-1000凝胶成像系统处理SDS-PAGE凝胶。利用SMART VIEW分析软件对电泳图谱进行分析。
7)UNICORN 5.11软件分析 用UNICORN 5.11软件对离子层析图谱进行分析。
2 试验结果与分析
用UNICORN 5.11软件对离子层析图谱进行得率分析和SMART VIEW分析软件对电泳图谱进行纯度分析,3种不同洗脱条件下的具体分析结果如下。
2.1 线性梯度洗脱
采用线性梯度洗脱时,其离子交换层析图谱如图1(a)所示,由图1(a)可知出现2个洗脱峰,1#得率只有11.16%,2#得率为88.84%。SDS-PAGE电泳图如图2(a)所示,由图2(a)可知,1#峰为目的蛋白,但有杂带,纯度为90.1%,2#峰中有目的蛋白,但分离不完全。
2.2 固定梯度和线性梯度混合洗脱
采用固定梯度和线性梯度混合洗脱时,其离子交换层析图谱如图1(b)所示。由图1(b)可知出现3个洗脱峰,3个峰分离不完全,1#得率为27.73%,2#得率为11.75%,3#得率为60.51%。SDS-PAGE电泳图如图2(b)所示。由图2(b)可知,1#峰为目的蛋白,纯度为99.5%,2#有部分目的蛋白。
2.3 不同阶段线性梯度洗脱
采用不同阶段线性梯度洗脱时,其离子交换层析图谱如图1(c)所示。由图1(c)可知出现2个洗脱峰,1#和2#分离比较完全,1#得率为35.97%,2#得率为64.03%。SDS-PAGE电泳图如图2(c)所示。由图2(c)可知,1#为目的蛋白,呈单一条带,纯度为99.5%,2#基本上无目的蛋白。
综上所述,采用不同阶段线性梯度洗脱时,重组福安泰-03功能域和小分子物质已完全分离开来,目的蛋白纯度很高,且得率最高。因此,使用该洗脱条件可获得最佳分离纯化效果。
3 结 语
在上样缓冲液为0.1mol/L Tris-HCl、洗脱缓冲液为1mol/L NaCl+0.1mol/L T ris-HCl、pH为8.8的条件下,利用HiTrap DEAE Sepharose FF琼脂糖凝胶吸附柱,先用洗脱缓冲液从30%到60%洗脱3个柱床体积,再用洗脱缓冲液从60%到100%洗脱2个柱床体积,最后收集洗脱峰。通过上述操作能获得最佳分离纯化效果,即重组福安泰-03功能域的纯度最高,得率最大。因此,该试验条件的确定为制备足量高纯度重组福安泰-03功能域提供了重要参考。
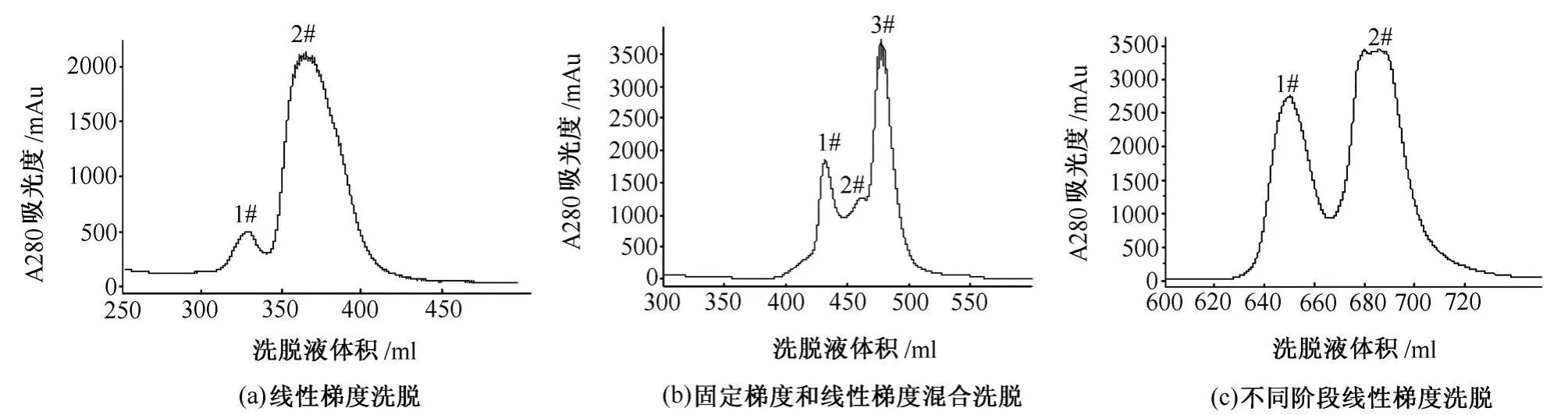
图1 离子交换层析图谱
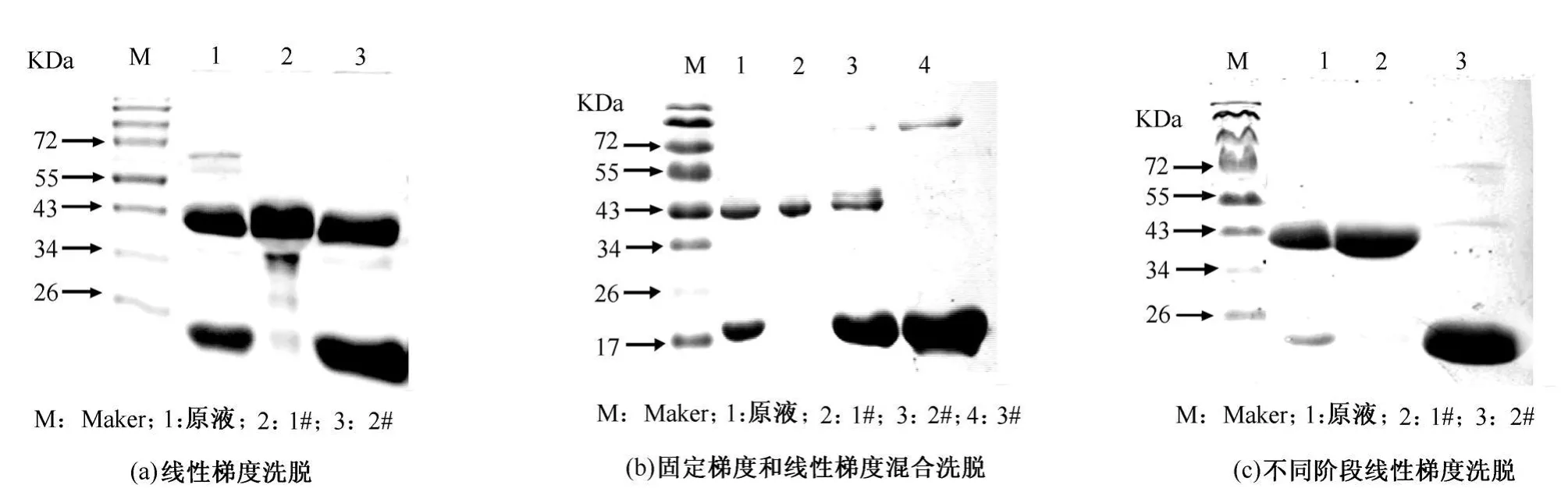
图2 SDS-PAGE电泳图
[1]薛文娇,范代娣,尚龙安,等.离子交换批量层析纯化重组类人胶原蛋白 [J].化学工程,2006,34(11):8~11.
[2]苏伟明,马润娣,于立坚,等.一种新的源自赤魟的强血管生成抑制剂福安泰-03的分离和鉴定 [J].中国生物化学与分子生物学报,2009,25(9):849~854.
[3]于立坚,马润娣,廖铭能,等.福安泰-03对肿瘤血管生成的抑制作用 [J].中国药理学通报,2008,24(11):1445~1449.
[4]廖铭能,徐海瑛,马润娣,等.福安泰-03对高转移人卵巢癌细胞HO-8910PM侵袭能力的影响 [J].细胞生物学杂志,2009,31:384~388.
[5]黄来珍,王长秀,马润娣,等.福安泰-03对小鼠癌细胞转移相关基因和转移行为的影响 [J].中国细胞生物学学报,2010,32(4):223~228.
[6]Lowry O H,Rosebrough N J,Farry A L,et al.Protein measurement with the folin phenol reagent[J].J Biol Chem,1951,193:265~275.
[7]李建武,余瑞元,袁明秀,等.生物化学实验原理和方法 [M].北京:北京大学出版社,1994.

