钠能从硫酸铜中置换出铜单质吗?
王胤琪
(通山县黄沙铺镇中学湖北咸宁437652)
钠能从硫酸铜中置换出铜单质吗?
王胤琪
(通山县黄沙铺镇中学湖北咸宁437652)
相信看到这个问题大家都能给出一个否定的回答,在初中化学的金属活动性顺序中前三位的金属都不能将位于其后的不活泼金属从它们的水溶液中置换出来。同理,钠与任何一种盐的水溶液反应,都不能置换出金属元素,因为钠首先与水反应生成氢氧化钠和氢气,若氢氧化钠能与盐中的金属离子反应生成难溶于水的氢氧化物,则可使反应继续进行,而使得最终的反应产物是难溶性氢氧化物,钠盐及氢气,否则只能是钠和水反应。
一、现象引发的问题
在做Na与CuSO4溶液的反应时,原本溶液中应出现蓝色絮状沉淀,但却在蓝色的沉淀中夹杂了部分棕黑色的物质,棕黑色物质的出现说明该反应并没有按着我们预期的原理进行,副反应的发生导致异常现象的出现。实际上人们普遍忽视了因为反应条件的不同给这个反应带来的复杂性。笔者曾代表通山县参加于2009年10月在武汉举行的湖北省首届“万高达杯”中学化学实验技能创新大赛,题目即为“钠能否置换出硫酸铜中的铜”。本文以作者参赛的切身体会,并结合相关文献知识撰写而成,个人的拙著希望能给广大同仁在教学上有所帮助。
这次比赛采用探究性试题,改变了传统的命题模式。参赛者通过对试题的理解、知识的运用、技巧的变化和多视角的思考,设计不同的实验方案,得出不同的结论,从而多角度考察了参赛教师的知识视野、应变技巧、实验设计、操作规范、分析问题与解决问题的能力以及环保意识。
二、实验设计的思路
试剂硫酸铜分为无水硫酸铜(CuSO4)和五水合硫酸铜(CuSO4·5H2O)两种,市售的试剂大多为结晶水合物。五水合硫酸铜中的水以分子的形式结合于阴、阳离子之间,晶体里所含的结晶水不很稳定,加热时,容易失去。可以设计使得钠分别与含结晶水和不含结晶水的两种CuSO4在不同的条件下反应,CuSO4·5H2O由于含有结晶水,所以反应后的产物与溶液中的相同。
三、实验操作的过程
1.Na与CuSO4溶液的反应
取一粒绿豆大小的Na,除去氧化层并吸干表面的煤油投入CuSO4溶液中,反应剧烈放热,生成的Cu(OH)2受热分解为黑色CuO:
2Na+CuSO4+2H2O=Na2SO4+Cu(OH)2↓+H2↑;Cu(OH)2
=△CuO+H2O若在新鲜的钠片上滴加1~2滴浓CuSO4溶液,反应非常剧烈,显著放热,生成大量棕褐色的固体物质,将该物质洗涤干净后加入少量的浓氨水,物质会慢慢全部溶解,溶液会逐渐呈现出深蓝色,说明其中含有Cu2O。
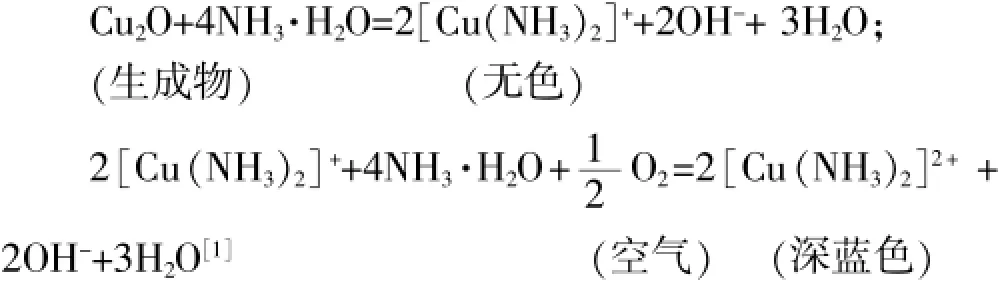
因此,Na与CuSO4溶液的反应,不论溶液是浓还是稀,都不能置换出铜。
2.Na与无水CuSO4的反应
(1)室温条件下的反应
取绿豆大小的钠经表面处理后立即放入无水CuSO4粉末里,使粉末将钠均匀包裹住,防止空气中的氧将钠氧化。室温下放置一段时间后,两物质均无明显变化。
说明在室温下Na与无水CuSO4不能发生反应。
(2)加热条件下的反应
取适当大小的钠,均匀包埋于粉末中置于坩埚里,并将粉末压实,防止加热时容器里的氧气将反应物和产物氧化。把处理好后的坩埚于酒精灯火焰上加热,10~20s后坩埚中伴随着轻微的爆炸声,突然喷发出一股黄色的火焰。反应结束后,往坩埚中加入少量水,使未反应完的CuSO4粉末溶解,倒出溶液,坩埚可见附着有亮红色的固体。往里加入少量浓H2SO4,固体无变化,加热片刻后亮红色固体溶解,溶液逐渐变蓝,同时有刺激性气味气体放出,该气体能使湿润的红色品红试纸褪色。相关的化学方程式:2Na+CuSO4=△Cu+Na2SO4;Cu+2H2SO4(浓)=△CuSO4+SO2↑+H2O。即在加热条件下,使用干燥的无水CuSO4粉末,能够被置换出铜单质。实验时钠的用量一定要控制好,否则会发生剧烈爆炸,其次要避免氧气将反应物和产物氧化变质。
四、探究过程的反思
化学实验是最富有创造性的教学过程和学习活动,科学探究是实验的核心,反应条件是化学反应发生的关键因素,针对不同的条件可以设计出不同的探究方案,问题是开放式的,分析的思路更是可以有多种。当然,这也揭示了化学变化的无穷奥妙。
[1]刘怀乐.中学化学教学思维[M].重庆:重庆出版集团,重庆出版社,2009.3
1008-0546(2010)12-0076-01
G633.8
B
10.3969/j.issn.1008-0546.2010.12.043
——以硫酸铜饱和溶液析出晶体的计算为例

